Disulfida
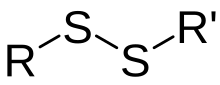
Dalam kimia, disulfida biasanya merujuk unit struktur terdiri daripada pasangan tersambung atom sulfur. Disulfida biasanya merujuk sebatian kimia yang mengandungi ikatan disulfida, seperti difenil disulfida, C6H5S-SC6H5.
Dalam biologi[sunting | sunting sumber]
Struktur protein[sunting | sunting sumber]
Ikatan disulfida boleh terbentuk dalam keadaan pengoksidaan, dan memainkan peranan penting dalam lipatan dan kestabilan beberapa protein, biasanya protein dirembeskan ke medium ekstrasel.[1] Oleh kerana kebanyakan kawasan sel memiliki kecenderungan ke arah penurunan, secara amnya, ikatan disulfida tidak stabil dalam sitosol, dengan beberapa pengecualian, melainkan jika terdapat sulfhidril oksidase.[2]

Ikatan disulfida dalam protein terbentuk antara kumpulan tiol sisa sisteina melalui proses lipatan oksidatif. Satu lagi asid amino yang mengandungi sulfur, metionina, tidak boleh membentuk ikatan disulfida. Ikatan disulfida biasanya dilambangkan dengan tanda sempang singkatan sisteina, sebagai contoh, apabila merujuk kepada ribonuklease A, ditulis "ikatan disulfida Cys26–Cys84", atau "ikatan disulfida 26–84", atau paling ringkas "C26–C84",[3] di mana ikatan disulfida difahami dan tidak perlu disebut. Prototaip ikatan disulfida protein ialah sistina, peptida dua asid amino yang terdiri daripada dua sisteina yang disambungkan oleh ikatan disulfida. Struktur ikatan disulfida boleh digambarkan dengan sudut dihedral χss antara atom Cβ−Sγ−Sγ−Cβ, yang biasanya hampir kepada ±90°.
Penghasilan[sunting | sunting sumber]
Ikatan disulfida biasanya terbentuk daripada pengoksidaan kumpulan tiol/sulfhidril (−SH), terutamanya dalam konteks biologi, seperti yang berikut:[4]
Tindak balas[sunting | sunting sumber]
Aspek paling penting bagi ikatan disulfida ialah pembelahannya, yang berlaku melalui penurunan. Pelbagai penurun boleh digunakan. Dalam biokimia, tiol seperti β-merkaptoetanol (β-ME) atau ditiotreitol (DTT) berfungsi sebagai penurun; reagen tiol digunakan secara berlebihan untuk memacu keseimbangan ke kanan:
Rujukan[sunting | sunting sumber]
- ^ Sevier, C. S.; Kaiser, C. A. (2002). "Formation and transfer of disulphide bonds in living cells". Nature Reviews Molecular Cell Biology . 3 (11): 836–847. doi:10.1038/nrm954. PMID 12415301. S2CID 2885059.
- ^ Hatahet, F.; Nguyen, V. D.; Salo, K. E.; Ruddock, L. W. (2010). "Disruption of reducing pathways is not essential for efficient disulfide bond formation in the cytoplasm of E. coli". Microbial Cell Factories. 9 (67): 67. doi:10.1186/1475-2859-9-67. PMC 2946281. PMID 20836848.
- ^ Ruoppolo, M.; Vinci, F.; Klink, T. A.; Raines, R. T.; Marino, G. (2000). "Contribution of individual disulfide bonds to the oxidative folding of ribonuclease A". Biochemistry. 39 (39): 12033–12042. doi:10.1021/bi001044n. PMID 11009618.
- ^ Witt, D. (2008). "Recent developments in disulfide bond formation". Synthesis. 2008 (16): 2491–2509. doi:10.1055/s-2008-1067188.


