Karbon trioksida
- Halaman ini adalah tentang oksida karbon yang tidak stabil. Jangan dikelirukan dengan CO2-
3.
| |
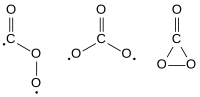
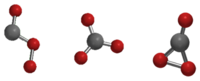 Isomer-isomer karbon trioksida, Cs, D3h dan C2v.
| |
| Pengecam | |
|---|---|
Imej model 3D Jmol
|
|
| |
| Sifat | |
| CO3 | |
| Jisim molar | 60.01 g·mol−1 |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| Rujukan kotak info | |
Karbon trioksida (CO3) ialah oksida karbon (oksokarbon) yang tidak stabil. Tiga isomernya yang mungkin boleh terhasil, masing-masing dengan kumpulan titik simetri molekul Cs, D3h dan C2v, telah dikaji secara teori, dan keadaan C2v didapati merupakan keadaan dasar molekul tersebut.[1][2]
Karbon trioksida boleh dihasilkan di dalam zon hanyut nyahcas korona negatif melalui tindak balas antara karbon dioksida (CO2) dan atom oksigen (O) yang dihasilkan daripada molekul oksigen oleh elektron bebas dalam plasma.[3]
Selain itu, satu lagi cara penghasilan CO3 ialah melalui fotolisis ozon, O3, yang terlarut dalam CO2 cair atau campuran CO2/SF6 pada -45 °C, disinari cahaya 2537 Å. Pembentukan CO3 ada terjadi, tetapi kelihatan ia mereput secara spontan kepada karbon dioksida dan oksigen dengan cara 2CO3 → 2CO2 + O2 dengan jangka hayat kurang daripada seminit.[4]
Karbon trioksida boleh juga dihasilkan dengan menghembuskan ozon pada ais kering (CO2 pejal), dan ia juga telah dikesan dalam tindak balas antara karbon monoksida, CO, dan oksigen molekul, O2.
Rujukan[sunting | sunting sumber]
- ^ Tim Kowalczyk, Electronic structure and spectroscopy of carbon trioxide
- ^ T. Kowalczyk; A. I. Krylov (Aug 2007). "Electronic structure of carbon trioxide and vibronic interactions involving Jahn-Teller states". J. Phys. Chem. A. 111 (33): 8271–8276. doi:10.1021/jp073627d. ISSN 1089-5639. PMID 17661455.
- ^ Sabin, J. R; Kim, H (1971). "A theoretical study of the structure and properties of carbon trioxide". Chemical Physics Letters. 11 (5, ): 593–597. Bibcode:1971CPL....11..593S. doi:10.1016/0009-2614(71)87010-0.CS1 maint: extra punctuation (link)
- ^ DeMore W. B., Jacobsen C. W. (1969). "Formation of carbon trioxide in the photolysis of ozone in liquid carbon dioxide". Journal of Physical Chemistry. 73 (9): 2935–2938. doi:10.1021/j100843a026.
Bacaan lanjut[sunting | sunting sumber]
- Electronic structure and spectroscopy of carbon trioxide
- Sobek V., Skalný J. D. (1993). "A simple model of processes in the drift region of negative corona discharge in a mixture of air with halocarbons". Czechoslovak Journal of Physics. 43 (8): 807. Bibcode:1993CzJPh..43..807S. doi:10.1007/BF01589802. Diarkibkan daripada yang asal pada 2013-01-04. Dicapai pada 2014-06-08. Cite has empty unknown parameter:
|coauthors=(bantuan) - Pople J. A. , Seeger U., Seeger R., Schleyer P. v. R. (2004). "The structure of carbonate". Journal of Computational Chemistry. 1 (2): 199–203. doi:10.1002/jcc.540010215.CS1 maint: multiple names: authors list (link)
- Moll N. G., Clutter D. R., Thompson W. E. (1966). "Carbonate: Its Production, Infrared Spectrum, and Structure Studied in a Matrix of Solid CO2". The Journal of Chemical Physics. 45 (12): 4469–4481. Bibcode:1966JChPh..45.4469M. doi:10.1063/1.1727526.CS1 maint: multiple names: authors list (link)
- Gimarc B. M., Chou T. S. (1968). "Geometry and Electronic Structure of Carbon Trioxide". The Journal of Chemical Physics. 49 (9): 4043–4047. Bibcode:1968JChPh..49.4043G. doi:10.1063/1.1670715.
- DeMore W. B., Dede C. (1970). "Pressure dependence of carbon trioxide formation in the gas-phase reaction of O(1D) with carbon dioxide". Journal of Physical Chemistry. 74 (13): 2621–2625. doi:10.1021/j100707a006.
- Francisco J. S., Williams I. H. (1985). "A theoretical study of the force field for carbon trioxide". Chemical Physics. 95 (3): 373. Bibcode:1985CP.....95..373F. doi:10.1016/0301-0104(85)80160-9.
