Kelenjar adrenal
| Kelenjar adrenal | |
|---|---|
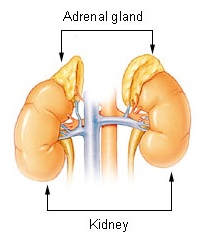 Kelenjar adrenal terletak di atas buah pinggang. | |
 | |
| Butiran | |
| Pendahulu | Mesoderma dan kresta saraf |
| Sistem | Sistem endokrin |
| Arteri | Arteri suprarenal Superior, tengah dan inferior |
| Urat | Vena suprarenal |
| Saraf | Pleksus seliak dan renal |
| Limfa | Nodus limfa lumbar |
| Pengenalpastian | |
| nama bahasa Latin | Glandula suprarenalis |
| MeSH | D000311 |
| TA | A11.5.00.001 |
| FMA | FMA:9604 |
| Terminologi anatomi | |
Kelenjar adrenal (juga dikenali sebagai kelenjar suprarenal) ialah kelenjar endokrin yang menghasilkan pelbagai hormon termasuk adrenalina dan steroid aldosteron dan kortisol.[1][2] Mereka ditemui di atas buah pinggang. Setiap kelenjar mempunyai korteks luar yang menghasilkan hormon steroid dan medula di dalam. Korteks adrenal itu sendiri dibahagikan kepada tiga zon utama: zona glomerulosa, zona fasikulata dan zona retikularis.[3]
Korteks adrenal menghasilkan tiga jenis utama hormon steroid: mineralokortikoid, glukokortikoid dan androgen. Mineralokortikoid (seperti aldosteron) yang dihasilkan dalam zona glomerulosa membantu dalam pengawalan tekanan darah dan keseimbangan elektrolit. Glukokortikoid kortisol dan kortison disintesis dalam zona fasikulata; fungsi hormon-hormon ini termasuk pengawalan metabolisme dan penghalangan sistem imun. Lapisan paling dalam korteks, zona retikularis, menghasilkan androgen yang ditukar kepada hormon seks berfungsi sepenuhnya dalam gonad dan organ sasaran lain.[4] Penghasilan hormon steroid dipanggil steroidogenesis, dan melibatkan beberapa tindak balas dan proses yang berlaku dalam sel korteks.[5] Medula pula menghasilkan katekolamina, yang berfungsi untuk menghasilkan tindak balas cepat ke seluruh badan dalam situasi stres.[4]
Beberapa penyakit endokrin melibatkan disfungsi kelenjar adrenal. Pengeluaran kortisol yang berlebihan membawa kepada sindrom Cushing, manakala pengeluaran yang tidak mencukupi dikaitkan dengan penyakit Addison. Hiperplasia adrenal kongenital ialah penyakit genetik yang dihasilkan oleh disregulasi mekanisme kawalan endokrin.[4][6] Pelbagai tumor boleh timbul daripada tisu adrenal dan biasanya ditemui dalam pengimejan perubatan apabila mencari penyakit lain.[7]
Struktur[sunting | sunting sumber]

Kelenjar adrenal terletak pada kedua-dua belah badan di dalam retroperitoneum, di atas dan sedikit di bahagian tengah buah pinggang. Dalam manusia, kelenjar adrenal kanan berbentuk piramid, manakala sebelah kiri berbentuk bulan sabit penuh atau separa, dan agak lebih besar.[8] Kelenjar adrenal berukuran kira-kira 5 cm panjang, 3 cm lebar, dan sehingga 1 cm tebal.[9] Berat gabungan mereka dalam julat manusia dewasa antara 7 hingga 10 gram.[10] Kelenjar berwarna kekuningan.[8]
Kelenjar adrenal dikelilingi oleh kapsul berlemak dan terletak di dalam fasia renal, yang juga mengelilingi buah pinggang. Septum (dinding) tisu penghubung yang lemah memisahkan kelenjar daripada buah pinggang.[11] Kelenjar adrenal berada betul-betul di bawah diafragma, dan dilekatkan pada krus diafragma oleh fascia renal.[11]
Setiap kelenjar adrenal mempunyai dua bahagian yang berbeza, masing-masing mempunyai fungsi yang unik, korteks adrenal luaran dan medula dalaman, dengan kedua-duanya menghasilkan hormon.[12]
Korteks adrenal[sunting | sunting sumber]
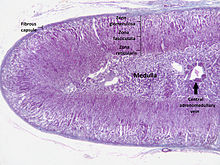
Korteks adrenal adalah kawasan luar dan juga bahagian terbesar kelenjar adrenal. Ia dibahagikan kepada tiga zon berasingan: zona glomerulosa, zona fasikulata dan zona retikularis. Setiap zon bertanggungjawab untuk menghasilkan hormon tertentu. Korteks adrenal adalah lapisan paling luar kelenjar adrenal. Di dalam korteks terdapat tiga lapisan yang dipanggil "zon". Apabila dilihat di bawah mikroskop, setiap lapisan mempunyai penampilan yang berbeza, serta fungsi yang berbeza.[13] Korteks adrenal ditumpukan kepada pengeluaran hormon, iaitu aldosteron, kortisol dan androgen.[14]
Zona glomerulosa[sunting | sunting sumber]
Zon paling luar korteks adrenal ialah zona glomerulosa. Ia terletak serta-merta di bawah kapsul berserabut kelenjar. Sel-sel dalam lapisan ini membentuk kumpulan bujur, dipisahkan oleh helai nipis tisu penghubung dari kapsul berserat kelenjar, dan membawa kapilari yang luas.[15]
Lapisan ini adalah tapak utama untuk penghasilan aldosteron, sejenis mineralokortikoid, melalui tindakan enzim aldosteron sintase.[16][17] Aldosteron memainkan peranan penting dalam pengawalan jangka panjang tekanan darah.[18]
Zona fasikulata[sunting | sunting sumber]
Zona fasikulata terletak di antara zona glomerulosa dengan zona retikularis. Sel dalam lapisan ini bertanggungjawab untuk menghasilkan glukokortikoid seperti kortisol.[19] Ia merupakan zon terbesar dalam kalangan ketiga-tiga zon, meliputi hampir 80% daripada jumlah korteks.[3] Dalam zon ini, sel-sel disusun dalam lajur berorientasikan jejari ke arah medula. Sel mengandungi banyak titisan lipid, mitokondrion yang banyak dan retikulum endoplasma licin yang kompleks.[15]
Zona retikularis[sunting | sunting sumber]
Lapisan kortikal paling dalam, zona retikularis, terletak bersebelahan dengan medula. Ia menghasilkan androgen, terutamanya dehidroepiandrosteron (DHEA), DHEA sulfate (DHEA-S), dan androstenadion (molekul pendahulu testosteron) pada manusia.[19] Sel-sel kecilnya membentuk kord dan kelompok yang tidak teratur, dipisahkan oleh kapilari dan tisu penghubung. Sel-sel mengandungi kuantiti sitoplasma dan titisan lipid yang agak kecil, dan kadangkala memaparkan pigmen lipofuskin coklat.[15]
Medula[sunting | sunting sumber]
Medula adrenal berada di tengah-tengah setiap kelenjar adrenal, dan dikelilingi oleh korteks adrenal. Sel-sel kromafin medula ialah sumber utama badan bagi katekolamina, seperti adrenalina dan noradrenalina (juga masing-masing epinefrina dan norepinefrina), yang dikeluarkan oleh medula. Kira-kira 20% noradrenalina dan 80% adrenalina dirembeskan di sini.[19]
Medula adrenal didorong oleh sistem saraf simpatetik melalui gentian praganglion yang berasal dari saraf tunjang toraks, dari vertebra T5–T11.[20] Memandangkan ia memiliki saraf gentian praganglion, medula adrenal boleh dianggap sebagai ganglion simpatetik khusus.[20] Tidak seperti ganglion simpatetik lain, medula adrenal tidak mempunyai sinaps yang berbeza, dan rembesannya dilepaskan terus ke dalam darah.
Bekalan darah[sunting | sunting sumber]
Kelenjar adrenal mempunyai salah satu kadar bekalan darah terhebat bagi setiap gram tisu mana-mana organ: sehingga 60 arteri kecil boleh memasuki setiap kelenjar.[21] Tiga arteri biasanya membekalkan setiap kelenjar adrenal:[8]
- Arteri suprarenal superior, cabang arteri frenik inferior
- Arteri suprarenal tengah, cabang langsung aorta abdomen
- Arteri suprarenal inferior, cabang arteri renal
Pembuluh darah ini membekalkan rangkaian arteri kecil dalam kapsul kelenjar adrenal. Helaian nipis kapsul-kapsul ini memasuki kelenjar sambil membawa darah.[8]
Darah vena dialirkan dari kelenjar oleh urat suprarenal, biasanya satu untuk setiap kelenjar:[8]
- Vena suprarenal kanan mengalir ke dalam vena kava inferior
- Vena suprarenal kiri mengalir ke dalam vena renal kiri atau vena frenik inferior kiri.
Vena adrenomedula pusat dalam medula ialah suatu saluran darah yang luar biasa. Strukturnya berbeza daripada vena lain kerana otot licin dalam media tunikanya (lapisan tengah) tersusun dalam berkas yang mencolok dan berorientasikan longitud.[3]
Variasi[sunting | sunting sumber]
Kelenjar adrenal mungkin tidak ada sama sekali, atau mungkin bercantum di garis tengah di belakang aorta.[12] Ini dikaitkan dengan keabnormalan lahir lain seperti kegagalan buah pinggang untuk berkembang, atau percantuman buah pinggang.[12] Kelenjar boleh berkembang dengan ketiadaan korteks secara sebahagian atau sepenuhnya, atau mungkin berkembang di lokasi luar kelaziman.[12]
Fungsi[sunting | sunting sumber]

Kelenjar adrenal merembeskan beberapa hormon berbeza yang dimetabolismekan oleh enzim sama ada di dalam kelenjar atau di bahagian lain badan. Hormon ini terlibat dalam beberapa fungsi biologi penting.[23]
Kortikosteroid[sunting | sunting sumber]
Kortikosteroid ialah sekumpulan hormon steroid yang dihasilkan daripada korteks kelenjar adrenal, dari mana ia dinamakan.[24]
- Mineralokortikoid seperti aldosteron mengawal keseimbangan garam ("mineral") dan tekanan darah.[25]
- Glukokortikoid seperti kortisol mempengaruhi kadar metabolisme protein, lemak dan gula ("glukosa").[26]
- Androgen seperti dehidroepiandrosteron.
- Mineralokortikoid
Kelenjar adrenal menghasilkan aldosteron, suatu mineralokortikoid yang penting dalam pengawalan keseimbangan garam ("mineral") dan isi padu darah. Dalam buah pinggang, aldosteron bertindak pada tubul berlingkar distal dan duktus pengumpul dengan meningkatkan penyerapan semula natrium dan perkumuhan kedua-dua ion kalium dan hidrogen.[18] Aldosteron bertanggungjawab dalam penyerapan semula kira-kira 2% turasan glomerulus yang ditapis.[27] Pengekalan natrium juga merupakan tindak balas kolon distal dan kelenjar peluh kepada rangsangan reseptor aldosteron. Angiotensin II dan kalium ekstrasel adalah dua pengawal selia utama pengeluaran aldosteron.[19] Jumlah natrium yang terdapat dalam badan mempengaruhi isipadu ekstrasel, yang seterusnya mempengaruhi tekanan darah. Oleh itu, kesan aldosteron dalam pengekalan natrium adalah penting untuk pengawalan tekanan darah.[28]
- Glukokortikoid
Kortisol ialah glukokortikoid utama manusia; dalam spesies tanpa kortisol, peranan ini diwakili oleh kortikosteron. Glukokortikoid memiliki banyak kesan terhadap metabolisme. Seperti namanya, ia meningkatkan kandungan glukosa darah. Ini berpunca daripada peningkatan pemerolehan asid amino daripada protein, dan perangsangan sintesis glukosa daripada asid-asid amino ini di hati. Di samping itu, ia juga meningkatkan tahap asid lemak bebas yang boleh digunakan sel sebagai alternatif kepada glukosa bagi penghasilan tenaga. Glukokorticoid juga memberi kesan di luar tahap gula darah, termasuk penghalangan sistem imun dan kesan antiradang yang kuat. Kortisol mengurangkan kebolehan osteoblas untuk menghasilkan tisu tulang, dan mengurangkan penyerapan kalsium di saluran gastrousus.[28]
Kelenjar adrenal merembeskan kortisol dalam tahap asas, tetapi juga boleh menghasilkan letupan hormon sebagai tindak balas kepada hormon adrenokortikotropik (ACTH) dari pituitari anterior. Kortisol tidak dikeluarkan secara sama rata sepanjang hari - kepekatannya dalam darah adalah tertinggi pada awal pagi dan paling rendah pada waktu petang akibat daripada irama sirkadian rembesan ACTH.[28] Kortison ialah produk tidak aktif daripada tindakan enzim 11β-HSD terhadap kortisol. Reaksi yang dimangkinkan oleh 11β-HSD boleh diterbalikkan, yang bermaksud bahawa ia boleh menukar kortison yang diberikan kepada kortisol yang aktif secara biologi.[28]
- Pembentukan

Semua kortikosteroid mula-mula wujud sebagai kolesterol sebagai pendahulu. Oleh itu, langkah pertama dalam steroidogenesis ialah pengambilan atau sintesis kolesterol. Sel yang menghasilkan hormon steroid boleh memperoleh kolesterol melalui dua laluan. Sumber utama adalah melalui kolesterol diet yang diangkut melalui darah sebagai ester kolesterol dalam lipoprotein ketumpatan rendah (LDL). LDL memasuki sel melalui endositosis pengantara reseptor . Sumber kolesterol yang lain ialah sintesis dalam retikulum endoplasma sel. Sintesis boleh mengimbangi apabila tahap LDL rendah secara luar biasa.[4] Dalam lisosom, ester kolesterol ditukar kepada kolesterol bebas yang kemudiannya digunakan dalam steroidogenesis atau disimpan dalam sel.[29]
Bahagian awal penukaran kolesterol kepada hormon steroid melibatkan beberapa enzim daripada keluarga sitokrom P450 yang terletak di dalam membran dalaman mitokondrion. Pengangkutan kolesterol dari luar ke membran dalam dipermudahkan oleh protein pengawalseliaan akut steroidogenik, dan merupakan langkah pengehad kadar sintesis steroid.[29]
Lapisan kelenjar adrenal berbeza mengikut fungsi, dengan setiap lapisan mempunyai enzim berbeza yang menghasilkan hormon berbeza daripada pendahulu sepunya.[4] Langkah enzim pertama dalam penghasilan semua hormon steroid ialah pembelahan rantai sisi kolesterol, tindak balas yang membentuk pregnenolon sebagai produk dan dimangkinkan oleh enzim P450scc, juga dikenali sebagai kolesterol desmolase. Selepas penghasilan pregnenolon, enzim khusus setiap lapisan kortikal mengubah suainya. Enzim yang terlibat dalam proses ini termasuk kedua-dua mitokondria dan mikrosom P450 dan dehidrogenase hidroksisteroid. Biasanya, beberapa langkah perantaraan di mana pregnenolon diubah suai beberapa kali diperlukan untuk membentuk hormon berfungsi.[5] Enzim yang memangkinkan tindak balas dalam laluan metabolik ini terlibat dalam beberapa penyakit endokrin. Sebagai contoh, bentuk hiperplasia adrenal kongenital yang paling biasa berkembang akibat kekurangan 21-hidroksilase, enzim yang terlibat dalam langkah perantaraan pengeluaran kortisol.[30]
- Pengawalaturan
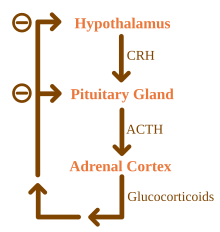
Glukokortikoid berada di bawah pengaruh pengawalseliaan paksi hipotalamus-pituitari-adrenal (HPA). Sintesis glukokortikoid dirangsang oleh hormon adrenokortikotropik (ACTH), hormon yang dilepaskan ke dalam aliran darah oleh pituitari anterior. Sebaliknya, pengeluaran ACTH dirangsang oleh kehadiran hormon pelepasan kortikotropin (CRH) yang dikeluarkan oleh neuron hipotalamus. ACTH bertindak pada sel adrenal terlebih dahulu dengan meningkatkan tahap StAR dalam sel, dan kemudian, semua enzim P450 steroidogenik. Paksi HPA ialah contoh sistem maklum balas negatif, di mana kortisol sendiri bertindak sebagai perencat langsung kedua-dua sintesis CRH dan ACTH. Paksi HPA juga berinteraksi dengan sistem imun melalui peningkatan rembesan ACTH dengan kehadiran molekul tertentu tindak balas keradangan.[4]
Rembesan mineralokortikoid dikawal terutamanya oleh sistem renin-angiotensin-aldosteron (RAAS), kepekatan kalium, dan secara kecil-kecilan, kepekatan ACTH.[4] Penderia tekanan darah dalam radas jukstaglomerulus buah pinggang melepaskan enzim renin ke dalam darah, yang memulakan lata tindak balas yang membawa kepada pembentukan angiotensin II. Reseptor angiotensin dalam sel zona glomerulosa mengenali bahan tersebut, dan apabila terikat, merangsang pembebasan aldosteron.[31]
Androgen[sunting | sunting sumber]
Sel-sel zona retikularis kelenjar adrenal menghasilkan hormon seks lelaki atau androgen, dengan molekul paling penting ialah DHEA. Secara amnya, hormon ini tidak mempunyai kesan keseluruhan dalam badan lelaki, dan ditukar kepada androgen yang lebih kuat seperti testosteron dan DHT atau kepada estrogen (hormon seks wanita) dalam gonad, bertindak dengan cara ini sebagai perantaraan metabolik.[32]
Katekolamina[sunting | sunting sumber]
Adrenalina dan noradrenalina ialah katekolamina, sebatian larut air yang mempunyai struktur yang diperbuat daripada kumpulan katekol dan kumpulan amina. Kelenjar adrenal bertanggungjawab bagi penghasilan kebanyakan adrenalina yang beredar di dalam badan, tetapi hanya untuk sejumlah kecil noradrenalin yang beredar.[23] Hormon ini dikeluarkan oleh medula adrenal yang mengandungi rangkaian saluran darah yang padat. Adrenalina dan noradrenalina bertindak dengan berinteraksi dengan adrenoreseptor di seluruh badan dengan kesan yang termasuk peningkatan tekanan darah dan kadar denyutan jantung.[23] Tindakan adrenalina dan noradrenalina bertanggungjawab terhadap tindak balas lawan atau lari yang dicirikan oleh pernafasan yang lebih cepat dan kadar denyutan jantung, peningkatan tekanan darah, dan penyempitan saluran darah di banyak bahagian badan.[33]
- Pembentukan
Katekolamin dihasilkan dalam sel kromafin dalam medula kelenjar adrenal daripada tirosina, asid amino tak perlu yang diperoleh daripada makanan atau dihasilkan daripada fenilalanina dalam hati. Enzim tirosina hidroksilase menukar tirosin kepada L-DOPA dalam langkah pertama sintesis katekolamin. L-DOPA kemudiannya ditukar kepada dopamina sebelum ia boleh ditukar kepada noradrenalin. Dalam sitosol, noradrenalin ditukar kepada epinefrin oleh enzim feniletanolamina N-metiltransferase (PNMT) dan disimpan dalam granul. Glukokortikoid yang dihasilkan dalam korteks adrenal merangsang sintesis katekolamina dengan meningkatkan tahap tirosina hidroksilase dan PNMT.[4][13]
Pembebasan katekolamina dirangsang oleh pengaktifan sistem saraf simpatetik. Saraf splanknik sistem saraf simpatetik menginervasi medula kelenjar adrenal. Apabila diaktifkan, ia membangkitkan pembebasan katekolamin daripada butiran simpanan dengan merangsang pembukaan saluran kalsium dalam membran sel.[34]
Ekspresi gen dan protein[sunting | sunting sumber]
Genom manusia termasuk kira-kira 20,000 gen pengekodan protein dan 70% daripadanya diekspresikan dalam kelenjar adrenal dewasa normal.[35][36] Hanya kira-kira 250 gen yang lebih khusus mengalami ekspresi dalam kelenjar adrenal berbanding organ dan tisu lain. Gen khusus kelenjar adrenal dengan tahap ekspresi tertinggi termasuk ahli superkeluarga enzim sitokrom P450 enzim. Protein yang sepadan dinyatakan dalam petak berbeza kelenjar adrenal, seperti CYP11A1, HSD3B2 dan FDX1 yang terlibat dalam sintesis hormon steroid dan dinyatakan dalam lapisan sel korteks, dan PNMT dan DBH terlibat dalam sintesis noradrenalina dan adrenalina, dan dinyatakan dalam medula.[37]
Perkembangan[sunting | sunting sumber]
Kelenjar adrenal terdiri daripada dua jenis tisu heterogen. Bahagian tengah ialah medula adrenal yang menghasilkan adrenalina dan noradrenalina dan melepaskannya ke dalam aliran darah, sebagai sebahagian daripada sistem saraf simpatetik. Di sekeliling medula ialah korteks yang menghasilkan pelbagai hormon steroid. Tisu ini datang daripada pendahulu embriologi yang berbeza dan mempunyai laluan perkembangan pranatal yang berbeza. Korteks kelenjar adrenal berasal dari mesoderma, manakala medula berasal dari kresta saraf asal ektoderma.[12]
Kelenjar adrenal bayi baru lahir jauh lebih besar berdasarkan perbandingan dengan saiz badan berbanding orang dewasa.[38] Sebagai contoh, pada usia tiga bulan, kelenjar adalah empat kali ganda saiz buah pinggang. Saiz kelenjar berkurangan secara relatif selepas kelahiran, terutamanya kerana pengecutan korteks. Korteks yang hampir hilang sepenuhnya pada umur 1, berkembang semula dari umur 4 hingga 5 tahun. Kelenjar ini mempunyai berat kira-kira 1 g semasa lahir,[12] dan berkembang menjadi berat dewasa kira-kira 4 gram setiap satu.[28] Dalam janin, kelenjar pertama kali dikesan selepas minggu keenam perkembangan.[12]
Korteks[sunting | sunting sumber]
Tisu korteks adrenal berasal daripada mesoderma perantaraan. Ia pertama kali muncul 33 hari selepas persenyawaan, menunjukkan keupayaan pengeluaran hormon steroid menjelang minggu kelapan dan mengalami pertumbuhan pesat semasa trimester pertama kehamilan. Korteks adrenal janin berbeza daripada bentuk dewasa kerana ia terdiri daripada dua zon berbeza: zon "janin" dalaman, yang membawa sebahagian besar aktiviti penghasil hormon, dan zon "definitif" luar, yang berada dalam fasa percambahan sel. Zon janin menghasilkan sejumlah besar androgen adrenal yang digunakan oleh plasenta untuk biosintesis estrogen.[39] Perkembangan kortikal kelenjar adrenal dikawal kebanyakannya oleh ACTH, hormon yang dihasilkan oleh kelenjar pituitari yang merangsang sintesis kortisol.[40] Semasa midgestation, zon janin menduduki sebahagian besar isipadu kortikal dan menghasilkan 100-200 mg/hari DHEA-S, androgen dan prekursor kedua-dua androgen dan estrogen - hormon seks wanita.[41] Hormon adrenal, terutamanya glukokortikoid seperti kortisol, adalah penting dalam perkembangan organ pranatal, terutamanya kematangan paru-paru. Kelenjar adrenal mengecil saiznya selepas kelahiran kerana kehilangan pesat zon janin, dengan penurunan yang sepadan dalam rembesan androgen.[39]
Adrenark[sunting | sunting sumber]
Pada zaman kanak-kanak awal, sintesis androgen dan rembesan kekal rendah, tetapi beberapa tahun sebelum akil baligh (dari umur 6-8 tahun), perubahan berlaku dalam kedua-dua aspek anatomi dan fungsi pengeluaran androgen kortikal yang membawa kepada peningkatan rembesan steroid DHEA dan DHEA-S. Perubahan ini adalah sebahagian daripada proses yang dipanggil adrenark yang hanya ada pada manusia dan beberapa primat lain. Adrenark adalah bebas daripada ACTH atau gonadotropin, dan berkorelasi dengan penebalan progresif lapisan zona retikularis. Secara fungsian, adrenark menyediakan sumber androgen bagi perkembangan rambut ketiak dan kemaluan sebelum permulaan akil baligh.[42][43]
Medula[sunting | sunting sumber]
Medula adrenal berasal daripada sel kresta saraf yang berasal dari lapisan ektoderma embrio. Sel-sel ini berhijrah dari kedudukan awalnya dan berkumpul di sekitar aorta dorsal, saluran darah primitif, yang mengaktifkan pembezaan sel-sel ini melalui pembebasan protein yang dikenali sebagai protein morfogenetik tulang (BMP). Sel-sel ini kemudiannya menjalani penghijrahan kedua dari aorta dorsal untuk membentuk medula adrenal dan organ sistem saraf simpatetik lain.[44] Sel-sel medula adrenal dipanggil sel kromafin kerana ia mengandungi butiran yang bernoda dengan garam kromium, satu ciri yang tidak terdapat dalam semua organ simpatetik. Glukokortikoid yang dihasilkan dalam korteks adrenal pernah dianggap bertanggungjawab bagi pembezaan sel kromafin. Penyelidikan lebih terkini menunjukkan bahawa sebenarnya, BMP-4 yang dirembeskan dalam tisu adrenal bertanggungjawab secara utamanya untuk ini, dan glukokortikoid hanya memainkan peranan dalam perkembangan sel lanjutan.[45]
Kepentingan klinikal[sunting | sunting sumber]
Fungsi normal kelenjar adrenal mungkin terjejas oleh keadaan seperti jangkitan, tumor, gangguan genetik dan penyakit autoimun, atau sebagai kesan sampingan terapi perubatan. Gangguan ini menjejaskan kelenjar sama ada secara langsung (seperti jangkitan atau penyakit autoimun) atau akibat daripada disregulasi pengeluaran hormon (seperti dalam beberapa jenis sindrom Cushing) yang membawa kepada lebihan atau kekurangan hormon adrenal dan gejala yang berkaitan.
Pengeluaran berlebihan kortikosteroid[sunting | sunting sumber]
Sindrom Cushing[sunting | sunting sumber]
Sindrom Cushing ialah suatu manifestasi lebihan glukokortikoid. Ia boleh disebabkan oleh rawatan yang berpanjangan dengan glukokortikoid atau disebabkan oleh penyakit asas yang menghasilkan perubahan pada paksi HPA atau pengeluaran kortisol. Punca boleh dikhususkan lagi, sama ada berpuncakan ACTH atau bebas. Penyebab paling biasa sindrom Cushing endogen ialah adenoma pituitari yang menyebabkan pengeluaran ACTH yang berlebihan. Penyakit ini menghasilkan pelbagai jenis tanda dan gejala termasuk obesiti, diabetes, peningkatan tekanan darah, rambut badan yang berlebihan (hirsutisme), osteoporosis, kemurungan, dan yang paling ketara, tanda regangan pada kulit disebabkan oleh penipisannya yang progresif.[4][6]
Aldosteronisme primer[sunting | sunting sumber]
Apabila zona glomerulosa menghasilkan aldosteron berlebihan, hasilnya ialah aldosteronisme primer. Punca untuk keadaan ini ialah hiperplasia dua hala (pertumbuhan tisu yang berlebihan) kelenjar, atau adenoma yang menghasilkan aldosteron (keadaan yang dipanggil sindrom Conn). Aldosteronisme primer menghasilkan hipertensi dan ketidakseimbangan elektrolit, meningkatkan pengekalan natrium kekurangan kalium.[6]
Kekurangan adrenal[sunting | sunting sumber]
Kekurangan adrenal (kekurangan glukokortikoid) berlaku dalam 5 per 10,000 penduduk lazim.[6] Kekurangan jenis primer (termasuk penyakit Addison dan punca genetik) melibatkan gangguan korteks secara terus. Gangguan yang berlaku dalam paksi HPA berpuncakan luar kelenjar dikira sebagai kekurangan adrenal sekunder.
Penyakit Addison[sunting | sunting sumber]

Penyakit Addison merujuk kepada hipoadrenalisme primer, iaitu kekurangan pengeluaran glukokortikoid dan mineralokortikoid oleh kelenjar adrenal. Dalam masyarakat Barat, penyakit Addison biasanya merupakan keadaan autoimun, di mana badan menghasilkan antibodi terhadap sel korteks adrenal. Di seluruh dunia, penyakit ini lebih kerap disebabkan oleh jangkitan, terutamanya daripada tuberkulosis. Ciri khas penyakit Addison ialah hiperpigmentasi kulit, yang muncul dengan gejala tidak khusus lain seperti keletihan.[4]
Komplikasi yang dilihat dalam penyakit Addison yang tidak dirawat dan jenis kekurangan adrenal primer yang lain ialah krisis adrenal, kecemasan perubatan di mana paras glukokortikoid dan mineralokortikoid yang rendah mengakibatkan kejutan hipovolemik dan gejala seperti muntah dan demam. Krisis adrenal secara berperingkat boleh menyebabkan pengsan dan koma.[4] Pengurusan krisis adrenal termasuk suntikan hidrokortison.[46]
Kekurangan adrenal sekunder[sunting | sunting sumber]
Dalam kekurangan adrenal sekunder, gangguan paksi hipotalamus-pituitari-adrenal membawa kepada penurunan rangsangan korteks adrenal. Selain daripada penghalangan paksi oleh terapi glukokortikoid, punca paling biasa kekurangan ini ialah tumor yang menjejaskan pengeluaran hormon adrenokortikotropik (ACTH) oleh kelenjar pituitari.[6] Kekurangan adrenal jenis ini biasanya tidak menjejaskan pengeluaran mineralokortikoid yang sebaliknya berada di bawah kawal atur sistem renin-angiotensin.[4]
Hiperplasia adrenal kongenital[sunting | sunting sumber]
Hiperplasia adrenal kongenital ialah penyakit kongenital di mana mutasi enzim yang menghasilkan hormon steroid mengakibatkan kekurangan glukokortikoid, dan kerosakan sistem maklum balas negatif paksi HPA. Dalam paksi HPA, kortisol (glukokortikoid) menghalang pembebasan CRH dan ACTH, hormon yang merangsang sintesis kortikosteroid. Oleh kerana kortisol tidak dapat disintesis, hormon ini dikeluarkan dalam kuantiti yang tinggi dan sebaliknya merangsang pengeluaran steroid adrenal lain. Bentuk hiperplasia adrenal kongenital yang paling biasa adalah disebabkan oleh kekurangan 21-hidroksilase. 21-hidroksilase diperlukan dalam penghasilan kedua-dua mineralokortikoid dan glukokortikoid, tetapi bukan androgen. Oleh itu, rangsangan ACTH korteks adrenal mendorong pembebasan jumlah androgen adrenal yang berlebihan, yang boleh membawa kepada perkembangan alat kelamin dan ciri seks sekunder yang tidak jelas.[30]
Tumor adrenal[sunting | sunting sumber]

Tumor adrenal biasanya dijumpai sebagai insidentaloma, tumor asimtomatik yang tidak dijangka ditemui semasa pengimejan perubatan. Ia dilihat dalam kira-kira 3.4% daripada imbasan CT,[7] dan dalam kebanyakan kes ia adalah adenoma benigna.[48] Karsinoma adrenal sangat jarang berlaku, dengan kejadian 1 kes per juta setahun.[4]
Feokromositoma ialah tumor medula adrenal yang timbul daripada sel kromafin. ia boleh menghasilkan pelbagai gejala yang tidak khusus, termasuk sakit kepala, berpeluh, kebimbangan dan palpitasi. Tanda-tanda biasa termasuk hipertensi dan takikardia . Pembedahan, terutamanya laparoskopi adrenal, ialah rawatan yang paling biasa bagi feokromositoma kecil.[49]
Rujukan[sunting | sunting sumber]
- ^ Santulli G. MD (2015). Adrenal Glands: From Pathophysiology to Clinical Evidence. Nova Science Publishers, New York, NY. ISBN 978-1-63483-570-1.
- ^ "Adrenal gland". Medline Plus/Merriam-Webster Dictionary. Dicapai pada 11 February 2015.
- ^ a b c Ross M, Pawlina W (2011). Histology: A Text and Atlas (ed. 6th). Lippincott Williams & Wilkins. m/s. 708, 780. ISBN 978-0-7817-7200-6.
- ^ a b c d e f g h i j k l m Melmed, S; Polonsky, KS; Larsen, PR; Kronenberg, HM (2011). Williams Textbook of Endocrinology (ed. 12th). Saunders. ISBN 978-1437703245.
- ^ a b Miller, WL; Auchus, RJ (2011). "The molecular biology, biochemistry, and physiology of human steroidogenesis and its disorders". Endocrine Reviews. 32 (1): 81–151. doi:10.1210/er.2010-0013. PMC 3365799. PMID 21051590.
- ^ a b c d e Longo, D; Fauci, A; Kasper, D; Hauser, S; Jameson, J; Loscalzo, J (2012). Harrison's Principles of Internal Medicine (ed. 18th). New York: McGraw-Hill. ISBN 978-0071748896.
- ^ a b Nieman, LK (2010). "Approach to the patient with an adrenal incidentaloma". The Journal of Clinical Endocrinology and Metabolism. 95 (9): 4106–13. doi:10.1210/jc.2010-0457. PMC 2936073. PMID 20823463.
- ^ a b c d e Thomas, edited by Paul; Molecular, School of; Australia, Biomedical Science, University of Adelaide, Adelaide, South Australia (2013). Endocrine Gland Development and Disease. Burlington: Elsevier Science. m/s. 241. ISBN 9780123914545.CS1 maint: extra text: authors list (link)
- ^ Antonio Carlos A. Westphalen and Bonnie N. Joe (2006). "CT and MRI of Adrenal Masses". Appl Radiol. 35 (8): 10–26.
- ^ O'Hare, A. Munro Neville, Michael J. (1982). The Human Adrenal Cortex Pathology and Biology – An Integrated Approach. Springer London. m/s. Chapter 4: Structure of the adult cortex. ISBN 9781447113171.
- ^ a b Moore KL, Dalley AF, Agur AM (2013). Clinically Oriented Anatomy, 7th ed. Lippincott Williams & Wilkins. m/s. 294, 298. ISBN 978-1-4511-8447-1.
- ^ a b c d e f g Kay, Saundra. "Adrenal Glands". Medscape. Dicapai pada 1 August 2015.
- ^ a b Whitehead, Saffron A.; Nussey, Stephen (2001). Endocrinology: an integrated approach. Oxford: BIOS. m/s. 122. ISBN 978-1-85996-252-7.
- ^ Jefferies, William McK (2004). Safe uses of cortisol. Springfield, Ill: Charles C. Thomas. ISBN 978-0-398-07500-2.
- ^ a b c Young B, Woodford P, O'Dowd G (2013). Wheater's Functional Histology: A Text and Colour Atlas (ed. 6th). Elsevier. m/s. 329. ISBN 978-0702047473.
- ^ "The product of the CYP11B2 gene is required for aldosterone biosynthesis in the human adrenal cortex" (PDF). Mol. Endocrinol. 5 (10): 1513–1522. October 1991. doi:10.1210/mend-5-10-1513. PMID 1775135. Diarkibkan daripada yang asal (PDF) pada 2022-10-09.
- ^ "Cloning and expression of a rat cytochrome P-450 11 beta-hydroxylase/aldosterone synthase (CYP11B2) cDNA variant". Biochem Biophys Res Commun. 194 (1): 112–117. July 1993. doi:10.1006/bbrc.1993.1792. PMID 8333830.
- ^ a b Marieb, EN; Hoehn, K (2012). Human anatomy & physiology (ed. 9th). Pearson. m/s. 629. ISBN 978-0321743268.
- ^ a b c d Dunn R. B.; Kudrath W.; Passo S.S.; Wilson L.B. (2011). "10". Kaplan USMLE Step 1 Physiology Lecture Notes. m/s. 263–289.
- ^ a b Sapru, Hreday N.; Siegel, Allan (2007). Essential Neuroscience. Hagerstown, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-9121-2.
- ^ Mirilas P, Skandalakis JE, Colborn GL, Weidman TA, Foster RS, Kingsnorth A, Skandalakis LJ, Skandalakis PN (2004). Surgical Anatomy: The Embryologic And Anatomic Basis Of Modern Surgery. McGraw-Hill Professional Publishing. ISBN 978-960-399-074-1.
- ^ "OpenStax CNX". cnx.org. Dicapai pada 2015-08-01.
- ^ a b c Colledge, Nicki R.; Walker, Brian R.; Ralston, Stuart H., penyunting (2010). Davidson's principles and practice of medicine (ed. 21st). Edinburgh: Churchill Livingstone/Elsevier. m/s. 768–778. ISBN 978-0-7020-3085-7.
- ^ "Corticosteroid". TheFreeDictionary. Dicapai pada 23 September 2015.
- ^ Marieb Human Anatomy & Physiology 9th edition, chapter:16, page:629, question number:14
- ^ "Corticosteroid". TheFreeDictionary. Dicapai pada 23 September 2015.
- ^ Sherwood, Lauralee (2001). Human physiology: from cells to systems. Pacific Grove, CA: Brooks/Cole. ISBN 978-0-534-56826-9. OCLC 43702042.
- ^ a b c d e Boron, WF.; Boulapep, EL. (2012). Medical Physiology (ed. 2nd). Philadelphia: Saunders. ISBN 978-1437717532.
- ^ a b Miller, WL; Bose, HS (2011). "Early steps in steroidogenesis: intracellular cholesterol trafficking". Journal of Lipid Research. 52 (12): 2111–2135. doi:10.1194/jlr.R016675. PMC 3283258. PMID 21976778.
- ^ a b Charmandari, E; Brook, CG; Hindmarsh, PC (2004). "Classic congenital adrenal hyperplasia and puberty". European Journal of Endocrinology. 151 (Suppl 3): 77–82. CiteSeerX 10.1.1.613.6853. doi:10.1530/eje.0.151U077. PMID 15554890. Diarkibkan daripada yang asal pada 2015-02-04.
- ^ Crowley, SD; Coffman, TM (2012). "Recent advances involving the renin–angiotensin system". Experimental Cell Research. 318 (9): 1049–1056. doi:10.1016/j.yexcr.2012.02.023. PMC 3625040. PMID 22410251.
- ^ Hall JE, Guyton AC (2010). Guyton and Hall Textbook of Medical Physiology, 12th edition. Saunders. ISBN 978-1416045748.
- ^ Henry Gleitman, Alan J. Fridlund and Daniel Reisberg (2004). Psychology (ed. 6). W. W. Norton & Company. ISBN 978-0-393-97767-7.
- ^ García, AG; García de Diego, AM; Gandía, L; Borges, R; García Sancho, J (2006). "Calcium signaling and exocytosis in adrenal chromaffin cells". Physiological Reviews. 86 (4): 1093–1131. doi:10.1152/physrev.00039.2005. PMID 17015485.
- ^ "The human proteome in adrenal gland – The Human Protein Atlas". www.proteinatlas.org. Dicapai pada 2017-09-21.
- ^ Uhlén, Mathias; Fagerberg, Linn; Hallström, Björn M.; Lindskog, Cecilia; Oksvold, Per; Mardinoglu, Adil; Sivertsson, Åsa; Kampf, Caroline; Sjöstedt, Evelina (2015-01-23). "Tissue-based map of the human proteome". Science (dalam bahasa Inggeris). 347 (6220): 1260419. doi:10.1126/science.1260419. ISSN 0036-8075. PMID 25613900.
- ^ Bergman, Julia; Botling, Johan; Fagerberg, Linn; Hallström, Björn M.; Djureinovic, Dijana; Uhlén, Mathias; Pontén, Fredrik (2017-02-01). "The Human Adrenal Gland Proteome Defined by Transcriptomics and Antibody-Based Profiling". Endocrinology. 158 (2): 239–251. doi:10.1210/en.2016-1758. ISSN 0013-7227. PMID 27901589.
- ^ Barwick, T.D.; Malhotra, A.; Webb, J.A.W.; Savage, M.O.; Reznek, R.H. (September 2005). "Embryology of the adrenal glands and its relevance to diagnostic imaging". Clinical Radiology. 60 (9): 953–959. doi:10.1016/j.crad.2005.04.006. PMID 16124976.
- ^ a b "Development and Function of the Human Fetal Adrenal Cortex: A Key Component in the Feto-Placental Unit". Endocrine Reviews. 32 (3): 317–355. 2011. doi:10.1210/er.2010-0001. PMC 3365797. PMID 21051591.
- ^ "Mechanisms of adrenal gland growth: signal integration by extracellular signal regulated kinases1/2". Journal of Molecular Endocrinology. 42 (3): 191–203. 2009. doi:10.1677/JME-08-0160. PMID 19052254.
- ^ "Developmental and Functional Biology of the Primate Fetal Adrenal Cortex". Endocrine Reviews. 18 (3): 378–403. 1997. doi:10.1210/edrv.18.3.0304. PMID 9183569.
- ^ Hornsby, PJ (2012). "Adrenarche: a cell biological perspective". The Journal of Endocrinology. 214 (2): 113–119. doi:10.1530/JOE-12-0022. PMID 22573830.
- ^ Rege, J; Rainey, WE (2012). "The steroid metabolome of adrenarche". The Journal of Endocrinology. 214 (2): 133–143. doi:10.1530/JOE-12-0183. PMC 4041616. PMID 22715193.
- ^ Huber K (2006). "The sympathoadrenal cell lineage: Specification, diversification, and new perspectives". Developmental Biology. 298 (2): 335–343. doi:10.1016/j.ydbio.2006.07.010. PMID 16928368.
- ^ "Resolved and open issues in chromaffin cell development". Mechanisms of Development. 130 (6–8): 324–329. 2013. doi:10.1016/j.mod.2012.11.004. PMID 23220335.
- ^ Hydrocortisone Emergency Factsheet for Ambulance Personnel The Pituitary Foundation
- ^ Data and references for pie chart are located at file description page in Wikimedia Commons.
- ^ Mantero, F; Terzolo, M; Arnaldi, G; Osella, G; Masini, AM; Alì, A; Giovagnetti, M; Opocher, G; Angeli, A (2000). "A survey on adrenal incidentaloma in Italy. Study Group on Adrenal Tumors of the Italian Society of Endocrinology". The Journal of Clinical Endocrinology and Metabolism. 85 (2): 637–644. doi:10.1210/jcem.85.2.6372. PMID 10690869.
- ^ Martucci, VL; Pacak, K (2014). "Pheochromocytoma and paraganglioma: diagnosis, genetics, management, and treatment". Current Problems in Cancer. 38 (1): 7–41. doi:10.1016/j.currproblcancer.2014.01.001. PMC 3992879. PMID 24636754.
