Penjujukan protein

Penjujukan protein ialah proses praktikal untuk menentukan jujukan asid amino bagi keseluruhan atau sebahagian daripada protein atau peptida. Ini mungkin berfungsi untuk mengenal pasti protein atau mencirikan pengubahsuaian selepas translasi. Lazimnya, penjujukan protein separa menyediakan maklumat yang mencukupi (satu atau lebih tag jujukan) untuk mengenalpastinya dengan merujuk kepada pangkalan data jujukan protein yang diperoleh daripada konsep translasi gen.
Dua kaedah langsung utama penjujukan protein ialah spektrometri jisim dan degradasi Edman menggunakan penjujuk protein. Kaedah spektrometri jisim kini paling banyak digunakan untuk penjujukan dan pengenalpastian protein tetapi degradasi Edman kekal sebagai alat yang berharga untuk mencirikan terminal N protein.
Penentuan komposisi asid amino[sunting | sunting sumber]
Ia selalunya wajar untuk mengetahui komposisi asid amino yang tidak tersusun bagi protein sebelum cuba untuk mencari urutan tersusun, kerana pengetahuan ini boleh digunakan untuk memudahkan penemuan ralat dalam proses penjujukan atau untuk membezakan antara keputusan yang tidak jelas. Pengetahuan tentang kekerapan asid amino tertentu juga boleh digunakan untuk memilih protease yang akan digunakan dalam pembelahan protein. Penyertaan salah asid amino bukan piawai dalam tahap rendah (cth. norleusina) ke dalam protein juga boleh ditentukan.[1] Kaedah umum yang sering dirujuk sebagai analisis asid amino[2] untuk menentukan kekerapan asid amino adalah seperti berikut:
- Hidrolisis kuantiti protein yang diketahui kepada asid amino juzuk.
- Asingkan dan mengukur kuantiti asid amino dalam beberapa cara.
Hidrolisis[sunting | sunting sumber]
Hidrolisis dilakukan dengan memanaskan sampel protein dalam asid hidroklorik 6 M kepada 100–110 °C selama 24 jam atau lebih lama. Protein dengan banyak kumpulan hidrofobik yang besar mungkin memerlukan tempoh pemanasan yang lebih lama. Walau bagaimanapun, keadaan ini sangat kuat sehingga beberapa asid amino (serina, treonina, tirosina, triptofan, glutamina, dan sisteina) terdegradasi. Untuk mengelakkan masalah ini, Biochemistry Online mencadangkan agari sampel dipanaskan ecara berasingan untuk masa yang berbeza, menganalisis setiap penyelesaian yang terhasil dan mengekstrapolasi kembali kepada masa hidrolisis sifar. Rastall mencadangkan pelbagai reagen untuk mencegah atau mengurangkan degradasi, seperti reagen tiol atau fenol untuk melindungi triptofan dan tirosina daripada serangan klorin, dan sistein prapengoksidaan. Beliau juga mencadangkan mengukur kuantiti ammonia yang berkembang untuk menentukan tahap hidrolisis amida.
Pemisahan dan kuantiti[sunting | sunting sumber]
Asid amino boleh diasingkan dengan kromatografi pertukaran ion kemudian diterbitkan untuk memudahkan pengesanannya. Lebih biasa, asid amino diterbitkan kemudian diselesaikan dengan HPLC fasa terbalik.
Analisis asid amino terminal N[sunting | sunting sumber]
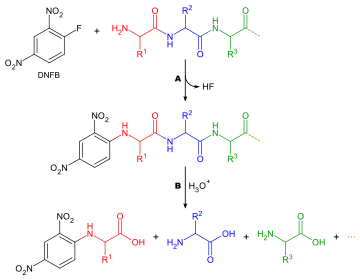
Menentukan asid amino yang menjadi terminal N bagi rantai peptida adalah berguna kerana dua sebab: untuk membantu susunan serpihan peptida individu ke dalam rantai keseluruhan, dan kerana pusingan pertama degradasi Edman sering tercemar oleh kekotoran, dan oleh itu, tidak tidak memberikan penentuan tepat asid amino terminal N. Kaedah umum untuk analisis asid amino terminal N berikut:
- Tindak balas peptida dengan reagen yang secara selektif akan melabelkan asid amino terminal.
- Hidrolisis protein.
- Tentukan asid amino dengan kromatografi dan perbandingan dengan piawai.
Terdapat banyak reagen berbeza yang boleh digunakan untuk melabelkan asid amino terminal. Kesemuanya bertindak balas dengan kumpulan amina dan oleh itu juga akan terikat kepada kumpulan amina dalam rantai sampingan asid amino seperti lisina - atas sebab ini adalah perlu untuk berhati-hati dalam mentafsir kromatogram untuk memastikan tempat yang betul dipilih. Dua daripada reagen yang lebih biasa ialah reagen Sanger (1-fluoro-2,4-dinitrobenzena) dan terbitan dansil seperti dansil klorida. Fenilisotiosianat, reagen degradasi Edman, juga boleh digunakan. Soalan yang sama digunakan di sini seperti dalam penentuan komposisi asid amino, dengan pengecualian bahawa penanda tidak diperlukan, kerana reagen menghasilkan derivatif berwarna dan hanya analisis kualitatif diperlukan. Dengan itu, asid amino tidak perlu dielusi daripada lajur kromatografi, dan hanya dibandingkan dengan piawai. Pertimbangan lain yang perlu diambil kira ialah, memandangkan mana-mana kumpulan amina akan bertindak balas dengan reagen pelabelan, kromatografi pertukaran ion tidak boleh digunakan, dan kromatografi lapisan nipis atau kromatografi cecair tekanan tinggi harus digunakan sebaliknya.
Analisis asid amino terminal C[sunting | sunting sumber]
Bilangan kaedah yang tersedia untuk analisis asid amino C-terminal adalah jauh lebih kecil daripada bilangan kaedah yang tersedia untuk analisis N-terminal. Kaedah yang paling biasa ialah menambah karboksipeptidase kepada larutan protein, mengambil sampel pada selang masa yang tetap, dan menentukan asid amino terminal dengan menganalisis plot kepekatan asid amino terhadap masa. Kaedah ini akan sangat berguna dalam kes polipeptida dan terminal N yang disekat protein. Penjujukan terminal C akan sangat membantu dalam mengesahkan struktur utama protein yang diramalkan daripada jujukan DNA dan untuk mengesan sebarang pemprosesan pasca translasi produk gen daripada jujukan kodon yang diketahui.
Penguraian Edman[sunting | sunting sumber]
Penguraian Edman ialah tindak balas yang sangat penting dalam penjujukan protein, kerana ia membolehkan komposisi asid amino tersusun bagi protein ditemui. Penjujukan Edman automatik kini digunakan secara meluas, dan mampu menyusun peptida sehingga lebih kurang 50 asid amino panjang. Tatacara tindak balas penjujukan protein oleh degradasi Edman adalah seperti yang berikut; beberapa langkah dihuraikan seterusnya.
- Putuskan sebarang ikatan disulfida dalam protein dengan agen penurunan seperti 2-merkaptoetanol. Kumpulan pelindung seperti asid iodoasetik mungkin diperlukan untuk mengelakkan ikatan daripada terbentuk semula.
- Pisahkan dan bersihkan rantai individu kompleks protein, jika terdapat lebih daripada satu.
- Tentukan komposisi asid amino setiap rantai.
- Tentukan asid amino terminal setiap rantai.
- Pecahkan setiap rantai kepada serpihan di bawah 50 asid amino panjang.
- Pisahkan dan bersihkan serpihan.
- Tentukan urutan setiap serpihan.
- Ulang dengan corak belahan yang berbeza.
- Bina urutan keseluruhan protein.
Pemutusan peptida[sunting | sunting sumber]
Peptida yang lebih panjang daripada kira-kira 50–70 asid amino tidak boleh dijujukan dengan pasti oleh degradasi Edman. Oleh kerana itu, rantai protein yang panjang perlu dipecahkan kepada serpihan kecil yang kemudiannya boleh dijujukan secara individu. Pemutusan ini dilakukan sama ada oleh endopeptidase seperti tripsin atau pepsin atau oleh reagen kimia seperti sianogen bromide. Enzim yang berbeza memberikan corak belahan yang berbeza, dan pertindihan antara serpihan boleh digunakan untuk membina jujukan keseluruhan.
Alat bioinformatik[sunting | sunting sumber]
Alat bioinformatik wujud untuk membantu dengan tafsiran spektrum jisim (lihat penjujukan peptida de novo), untuk membandingkan atau menganalisis jujukan protein (lihat analisis jujukan), atau mencari pangkalan data menggunakan jujukan peptida atau protein (lihat BLAST).
Rujukan[sunting | sunting sumber]
- ^ "Biosynthesis and incorporation into protein of norleucine by Escherichia coli". The Journal of Biological Chemistry. 264 (1): 531–9. January 1989. PMID 2642478.
- ^ Michail A. Alterman; Peter Hunziker (2 December 2011). Amino Acid Analysis: Methods and Protocols. Humana Press. ISBN 978-1-61779-444-5.
