Osteogenesis imperfecta
PENAFIAN: Untuk pengetahuan sahaja. Sila dapatkan nasihat doktor atau pakar perubatan bertauliah mengenai kesihatan anda. Maklumat perubatan dan penjagaan kesihatan dalam laman ini tidak bertujuan menggantikan jagaan profesional, khidmat nasihat, diagnosis atau rawatan doktor/pakar perubatan bertauliah. Laman ini tidak mempunyai jawapan kepada semua masalah kesihatan dan perubatan yang dialami. Jawapan kepada masalah umum mungkin tiada kaitan langsung dengan keadaan kesihatan anda. Sekiranya anda menyedari tanda/gejala penyakit atau jatuh sakit, sila hubungi doktor/pakar perubatan bertauliah untuk rawatan segera. |
| Osteogenesis imperfecta | |
|---|---|
| Pengelasan dan sumber luaran | |
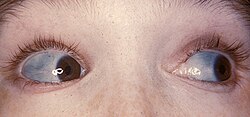 The classic blue sclerae of a person with osteogenesis imperfecta | |
| ICD-10 | Q78.0 |
| ICD-9 | 756.51 |
| P. Data Penyakit | 9342 |
| MedlinePlus | 001573 |
| eMedicine | ped/1674 |
| MeSH | D010013 |
Osteogenesis imperfecta (OI dan kadang-kadang dikenali sebagai penyakit tulang rapuh, atau "Lobstein syndrome"[1]) adalah gangguan tulang genetik. Mereka dengan keadaan OI dilahirkan dengan tisu penghubung cacat, atau tanpa keupayaan untuk membinanya, biasanya kerana kekurangan kolagen Jenis I.[2] kekurangan ini timbul akibat penggantian asid amino glycine pada asid amino lebih besar dalam struktur kolagen tiga helik. Rantaian sisi asid amino yang lebih mewujudkan halangan sterik yang membentuk bonjol di binaan kolagen, yang seterusnya mempengaruhi kedua-dua molekul nanomekanikal serta tindak balas antara molekul, yang kedua-dua terjejas.[3] Akibatnya, badan boleh bertindak balas dengan hidrolising struktur kolagen yang tidak sempurna. Jika badan tidak memusnahkan kolagen yang tidak sempurna, hubungan antara gentian halus kolagen dan kristal hidroksiapatit untuk membentuk tulang berubah, menyebabkan kerapuhan.[4] Satu lagi mekanisme penyakit yang dicadangkan ialah bahawa keadaan tegasan di gentian halus kolagen berubah di lokasi mutasi, di mana daya ricih ("shear forces") tempatan yang lebih besar mendorong kepada kegagalan pesat gentian halus walaupun pada beban yang sederhana sebagai keadaan tekanan homogen yang berlaku dalam gentian halus kolagen sihat.[3] Penyeidikan baru ini mencadangkan bahawa OI perlu difahami sebagai suatu fenomena skala-besaran, yang membabitkan mekanisme di peringkat genetik, nano, mikro dan makro-tisu.
Sebagai gangguan genetik, OI dalam sejarah telah telah dilihat sebagai gangguan autosomal dominanpada kolagen Jenis I. Dalam beberapa tahun yang lalu, bentuk resesif autosom telah dikenal pasti. Kebanyakan mereka dengan OI mewarisinya dari ibu atau bapa tetapi dalam 35% kes-kes itu merupakan seorang individu dengan mutasi (de novo atau "kadang-kala").
Jenis[sunting | sunting sumber]
Terdapat lapan jenis OI berlainan, Jenis I merupakan yang paling biasa, sungguhpun simptomnya berbeza anda seseorang dengan seseorang yang lain.
| Jenis | Gambaran | Gen | OMIM |
| I | lemah | Null COL1A1 allele | 166240 (IA), 166200 (IB) |
| II | terusk dan biasanya membawa maut dalam tempoh pranatal | COL1A1, COL1A2, | 166210 (IIA), 610854 (IIB) |
| III | dianggap berkembang dan mencacatkan | COL1A1, COL1A2 | 259420 |
| IV | mencacatkan, tetapi dengan sklera normal | COL1A1, COL1A2 | 166220 |
| V | berkongsi ciri-ciri klinikal dengan Jenis IV, tetapi memiliki jumpaan ("seperti jaring") yang unik secara histologi | unknown | 610967 |
| VI | berkongsi ciri-ciri klinikal dengan Jenis IV, tetapi memiliki jumpaan ("sisik ikan") yang unik secara histologi | unknown | 610968 |
| VII | autosomal recessive, dikaitkan dengan proton berkait dengan kartilage | CRTAP | 610682 |
| VIII | teruk kepada maut, autosomal recessive, dikaitkan dengan leprecan protin | LEPRE1 | 610915 |
Jenis I[sunting | sunting sumber]
Kolagen yang dihasilkan berkualiti biasa tetapi dihasilkan dalam kuantiti yang tidak mencukupi:
- Tulang mudah patah
- Tulang belakang lengkung sedikit
- Sendi yang longgar
- Tone otot pucat
- Perubahan warna sclera (mata putih), yang biasanya memberikannya warna biru-kelabu. Warna biru-kelabu sclera itu adalah disebabkan dasar urat choroidal yang telus. Ini adalah kerana sclera lebih nipis daripada biasa kerana kolagen Jenis I yang cacat yang membetuk dengan sempurna.
- Kehilangan pendengaran awal pada sesetengah kanak-kanak
- Mata membonjol sedikit
IA dan IB ditakrifkan agar dibezakan antara kehadiran/ketiadaan imperfecta dentinogenesis, (ciri-ciri gigi lut cahaya; tiada pada IA, wujud pada IB). Jangka hayat berkurangan sedikit berbanding dengan penduduk umum yang disebabkan oleh kemungkinan komplikasi tulang patah dan maut yang berkaitan dengan Jenis I OI seperti "invagination basilar".
Jenis II[sunting | sunting sumber]
Kolagen dari kualiti dan kuantiti yang tidak mencukupi
- Kebanyakan kes mati dalam tempoh tahun pertama disebabkan kegagalan pernafasan atau pendarahan intraseberal "intracerebral hemorrhage".
- masalah pernafasan teruk akibat paru-paru tidak terbentuk dengan sempurna
- Kecacatan tulang teruk dan bantut
Jenis II juga boleh dipecahkan dengan lanjut kepada himpunan A, B, C, yang dibezakan melalui penilaian radiografik pada tulang panjang dan rusuk. Jenis IIA memaparkan tulang panjang yang pendek dan lebar dengan tulang rusuk bermanik ("beaded ribs"). Jenis IIB memaparkan tulang panjang yang lebar dan pendek dengan tulang rusuk yang hanya sedikit atau tiada bermanik ("beading"). Jenis IIC memaparkan tulang panjang yang nipis dan lebih panjang dan tulang rusuk yang bermanik.
Jenis III[sunting | sunting sumber]
Kolagen tidak terbentuk dengan sempurna. Cukup kolagen dihasilkan tetapi cacat
- Tulang rapuh, kadang-kala sebelum kelahiran
- Tulang cacat, sering kali teruk
- Kemingkinan masalah pernafasan
- Kerdil, tulang belakang bengkok dan kadang-kala tulang rusuk berbentuk tong
- Muka segi tiga[5]
- Sendi longgar
- Tone otot yang pucat pada tangan dan kaki
- Pucat warna pada "sclera" ('putih' pada bahagian mata)
- Kemungkinan kehilangan pendengaran awal
Jenis III dibezakan antara pengelasan yang lain dari segi ia merupakan jenis "Kecacatan Berkembang", di mana kehadiran neonate dengan simptom kurang semasa lahir dan berkembang dengan simptom disebut sepanjang hayat. Jangka hayat mungkin normal, sungguhpun dengan kekurangan fizikal serius.
Jenis IV[sunting | sunting sumber]
Kuantiti kolagen mencukupi tetapi dalam kualiti yang tidak mencukupi
- Tulang mudah patah, terutama sebelum baligh
- Kerdil, tulang belakang bengkok dan kadang-kala tulang rusuk berbentuk tong
- Kecacatan tulang ringan hingga serdahana
- Kehilangan pendengaran awal
Sama seperti Jenis I, Jenis IV boleh dipecahkan lagi kepada Jenis IVA dan IVB berciri ketiadaan (IVA) atau kehadiran (IVB) bagi dentinogenesis imperfecta.
Jenis V[sunting | sunting sumber]

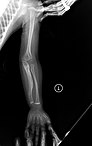
Berkongsi ciri-ciri klinikal dengan Jenis IV, tetapi memiliki jumpaan tulang ("seperti jaring") yang unik secara histologi. Dicirikan lebih lanjut oleh "V Triad" terdiri daripada a) radio-opaque band adjacent to growth plates, b) hypertrophic calluses at fracture sites, and c) calcification of the radio-ulnar interosseous membrane.[6]
OI Type V leads to calcification of the membrane between the two forearm bones, making it difficult to turn the wrist. Another symptom is abnormally large amounts of repair tissue (hyperplasic callus) at the site of fractures. At the present time, the cause for Type V is unknown, though doctors have determined that it is inherited.
Tolong bantu menterjemahkan sebahagian rencana ini. Rencana ini memerlukan kemaskini dalam Bahasa Melayu piawai Dewan Bahasa dan Pustaka. Sila membantu, bahan-bahan boleh didapati di Osteogenesis imperfecta (Inggeris). Jika anda ingin menilai rencana ini, anda mungkin mahu menyemak di terjemahan Google. Walau bagaimanapun, jangan menambah terjemahan automatik kepada rencana, kerana ini biasanya mempunyai kualiti yang sangat teruk. Sumber-sumber bantuan: Pusat Rujukan Persuratan Melayu. |
Jenis VI[sunting | sunting sumber]
Berkongsi ciri-ciri klinikal dengan Jenis IV, tetapi memiliki jumpaan tulang ("sisik ikan") yang unik secara histologi
Jenis VII[sunting | sunting sumber]
- In 2006 a recessive form called "Type VII" was discovered (Phenotype severe to lethal). Thus far it seems to be limited to a First Nations people in Quebec.[7] Mutations in the gene CRTAP causes this type.[8]
Type VIII[sunting | sunting sumber]
OI caused by mutation in the gene LEPRE1 is classified as type VIII.[8]
Treatment[sunting | sunting sumber]
At present there is no cure for OI. Treatment is aimed at increasing overall bone strength to prevent fracture and maintain mobility.
There have been many clinical trials performed with Fosamax (Alendronate), a drug used to treat those experiencing brittleness of bones due to osteoporosis. Higher levels of effectiveness apparently are to be seen in the pill form versus the IV form, but results seem inconclusive.[perlu rujukan] The U.S. Food and Drug Administration (FDA) will not approve Fosamax as a treatment for OI because long term effects of the drug have not been fully researched yet, although it is often used in preteens, instead of Pamidronate.[perlu rujukan]
Although there is no known cure for OI, regular weight-bearing exercise, a diet rich in calcium and vitamin D, a healthy lifestyle, and, in some cases, vitamin supplements will help off-set early development of osteoporosis, prevent future fractures, and delay other health concerns related to OI.
Bone infections are treated as and when they occur with the appropriate antibiotics and antiseptics.
Physiotherapy[sunting | sunting sumber]
Physiotherapy used to strengthen muscles and improve motility in a gentle manner, while minimizing the risk of fracture. This often involves hydrotherapy and the use of support cushions to improve posture. Individuals are encouraged to change positions regularly throughout the day in order to balance the muscles which are being used and the bones which are under pressure.
Children often develop a fear of trying new ways of moving due to movement being associated with pain. This can make physiotherapy difficult to administer to young children.
Physical aids[sunting | sunting sumber]
With adaptive equipment such as crutches, wheelchairs, splints, grabbing arms, and/or modifications to the home many individuals with OI can obtain a significant degree of autonomy.
Bisphosphonates[sunting | sunting sumber]
Bisphosphonates (BPs), particularly those containing nitrogen, are being increasingly administered to increase bone mass and reduce the incidence of fracture. BPs can be dosed orally (e.g. alendronate) or by intravenous injection/infusion (e.g. pamidronate,[9] zoledronic acid).
BP therapy is being used increasingly for the treatment of OI. It has proven efficiency in reducing fracture rates in children,[10] however only a trend towards decreased fracture was seen in a small randomized study in adults.[11] While decreasing fracture rates, there is some concern that prolonged BP treatment may delay the healing of OI fractures, although this has not been conclusively demonstrated.
Pamidronate is used in USA, UK and Canada. Some hospitals, such as most Shriners, provide it to children. Some children are under a study of pamidronate. Marketed under the brand name Aredia, Pamidronate is usually administered as an intravenous infusion, lasting about three hours. The therapy is repeated every three to six months, and lasts for the life of the patient. Common side effects include bone pain, low calcium levels, nausea, and dizziness. According to recent results, extended periods of pamidrinate, (i.e.;6 years) can actually weaken bones, so patients are recommended to get bone densities every 6 months-1 year, to monitor bone strength.
Surgery[sunting | sunting sumber]
Metal rods can be surgically inserted in the long bones to improve strength, a procedure developed by Harold A. Sofield, MD, at Shriners Hospitals for Children in Chicago. During the late 1940s, Sofield, Chief of Staff at Shriners Hospitals in Chicago, worked there with large numbers of children with OI and experimented with various methods to strengthen the bones in these children.[12] In 1959, with Edward A. Miller, MD, Sofield wrote a seminal article describing a solution that seemed radical at the time: the placement of stainless steel rods into the intramedullary canals of the long bones to stabilize and strengthen them. His treatment proved extremely useful in the rehabilitation and prevention of fractures; it was adopted throughout the world and still forms the basis for orthopedic treatment of OI.
Spinal fusion can be performed to correct scoliosis, although the inherent bone fragility makes this operation more complex in OI patients. Surgery for basilar impressions can be carried out if pressure being exerted on the spinal cord and brain stem is causing neurological problems.
Sejarah[sunting | sunting sumber]
Keadaan, atau jenisnya, telah memiliki pelbagai nama menurut masa dan di negara berlainan. Antara pilihan lain yang paling biasa adalah sindrom Ekman-Lobstein, sindrom Vrolik, dan nama tidak rasmi penyakit tulang kaca. Nama osteogenesis imperfecta bertarikh seawal 1895[13] dan telah menjadi istilah perubatan biasa pada abad ke-20 sehingga kini. Sistem empat jenis masa kini bermula dengan Sillence pada tahun 1979.[14] Sistem lebih lama menyifatkan jenis kurang teruk sebagai "osteogenesis imperfecta tarda" sementara bentuk lebih teruk dianggap "osteogenesis imperfecta congenita."[15] Oleh kerana ini tidak membezakan dengan baik, dan kesemua bentuk merupakan kongenital, ini tidak lagi digunakan.
Keadaan ini telah didapati pada mummi Mesir Purba sejak 1000 BC. Raja orang Norse "Ivar Tak Bertulang" mungkin juga memiliki keadaan ini. Kajian awal mengenainya bermula pada tahun 1788 dengan Olof Jakob Ekman dari Sweden. Dia menggambarkan keadaan ini dalam thesis kedoktorannya dan menyebut kes mengenainya sejak seawal 1678. Pada tahun 1831, Edmund Axmann menggambarkannya pada dirinya dan dua saudara lelakinya. Jean Lobstein menghadapainya semasa dewasa pada tahun 1833. Willem Vrolik mengkaji keadaan tersebut pada tahun 1850-an. Idea bahawa bentuk dewasa dan kanak-kanak adalah sama muncul pada tahun 1897 oleh Martin Benno Schmidt.[16]
Epidemiology[sunting | sunting sumber]
In the United States, the incidence of osteogenesis imperfecta is estimated to be 1 per 20,000 live births.[17][17]. An estimated 20,000 to 50,000 people are affected by OI in the United States.
Frequency is approximately the same across groups, but for unknown reasons the Shona and Ndebele of Zimbabwe seem to have a higher proportion of Type III to Type I than other groups.[18] However, a similar pattern was found in segments of the Nigerian and South African population. In these varied cases the total number of OIs of all four types was roughly the same as any other ethnicity.
Rujukan[sunting | sunting sumber]
- ^ James, William; Berger, Timothy; Elston, Dirk (2005). Andrews' Diseases of the Skin: Clinical Dermatology. (10th ed.). Saunders. Page 517. ISBN 0-7216-2921-0.
- ^ Rauch F, Glorieux FH (2004). "Osteogenesis imperfecta". Lancet. 363 (9418): 1377–85. doi:10.1016/S0140-6736(04)16051-0. PMID 15110498.
- ^ a b Gautieri A, Uzel S, Vesentini S, Redaelli A, Buehler MJ (2009). "Molecular and mesoscale disease mechanisms of Osteogenesis Imperfecta". Biophysical Journal. 97 (3): 857–865. doi:10.1016/j.bpj.2009.04.059. PMC 2718154. PMID 19651044.CS1 maint: multiple names: authors list (link)
- ^ "Osteogenesis Imperfecta Foundation: Fast Facts". Diarkibkan daripada yang asal pada 2007-06-28. Dicapai pada 2007-07-05.
- ^ Page 771 in: Chen, Harold (2006). Atlas of genetic diagnosis and counseling. Totowa, NJ: Humana Press. ISBN 1-58829-681-4.
- ^ Glorieux FH, Rauch F, Plotkin H; dll. (2000). "Type V osteogenesis imperfecta: a new form of brittle bone disease". J. Bone Miner. Res. 15 (9): 1650–8. doi:10.1359/jbmr.2000.15.9.1650. PMID 10976985. Explicit use of et al. in:
|author=(bantuan)CS1 maint: multiple names: authors list (link) - ^ "Recessive Form of OI Discovered by Foundation-funded Researcher" (PDF). Diarkibkan daripada yang asal (PDF) pada 2007-08-12. Dicapai pada 2012-03-04.
- ^ a b Genetics Home Reference: Genetic Conditions > Osteogenesis imperfecta (Reviewed November 2007)
- ^ Glorieux FH, Bishop NJ, Plotkin H, Chabot G, Lanoue G, Travers R (1998). "Cyclic administration of pamidronate in children with severe osteogenesis imperfecta". N. Engl. J. Med. 339 (14): 947–52. doi:10.1056/NEJM199810013391402. PMID 9753709.CS1 maint: multiple names: authors list (link)
- ^ DiMeglio LA, Peacock M (2006). "Two-year clinical trial of oral alendronate versus intravenous pamidronate in children with osteogenesis imperfecta". J. Bone Miner. Res. 21 (1): 132–40. doi:10.1359/JBMR.051006. PMID 16355282.
- ^ Chevrel G, Schott AM, Fontanges E; dll. (2006). "Effects of oral alendronate on BMD in adult patients with osteogenesis imperfecta: a 3-year randomized placebo-controlled trial". J. Bone Miner. Res. 21 (2): 300–6. doi:10.1359/JBMR.051015. PMID 16418786. Explicit use of et al. in:
|author=(bantuan)CS1 maint: multiple names: authors list (link) - ^ "Chicago Shriners Hospital - Osteogenesis imperfecta". Dicapai pada 2007-07-05.
- ^ K. Buday, Beiträge zur Lehre von der Osteogenesis imperfecta (1895)
- ^ Sillence DO, Senn A, Danks DM (1979). "Genetic heterogeneity in osteogenesis imperfecta". J. Med. Genet. 16 (2): 101–16. doi:10.1136/jmg.16.2.101. PMC 1012733. PMID 458828.CS1 maint: multiple names: authors list (link)
- ^ "Osteogenesis Imperfecta Foundation: Glossary". Dicapai pada 2007-07-05.
- ^ synd/1743 di Who Named It?
- ^ a b eMedicine > Osteogenesis Imperfecta Author: Horacio Plotkin. Updated: Mar 2, 2010
- ^ Viljoen D, Beighton P (1987). "Osteogenesis imperfecta type III: an ancient mutation in Africa?". Am. J. Med. Genet. 27 (4): 907–12. doi:10.1002/ajmg.1320270417. PMID 3425600.
Pautan luar[sunting | sunting sumber]
- GeneReview/NCBI/NIH/UW entry on Osteogenesis Imperfecta
- synd/1743 di Who Named It?
- Overview at NIAMS
- Pamidronate lines in OI (X-Ray) Diarkibkan 2012-03-26 di Wayback Machine
- Sillence Classification of OI Diarkibkan 2012-03-26 di Wayback Machine
- Type V Research, Osteogenesis Imperfecta association
