Organosulfat
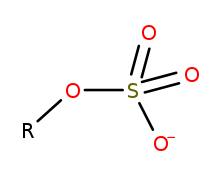
Dalam kimia organosulfur, organosulfat ialah sebuah kelas sebatian organik yang berkongsi kumpulan berfungsi yang sama dengan struktur R-O-SO-3 . Bahagian teras SO4 ialah kumpulan sulfat dan kumpulan R ialah sebarang sisa organik . Semua organosulfat secara formal adalah ester yang diperoleh daripada alkohol dan asid sulfurik (H2SO4) walaupun ramai yang tidak bersedia dengan cara ini. Banyak ester sulfat digunakan dalam produk detergen, dan sesetengahnya adalah reagen yang berguna. Alkil sulfat terdiri daripada rantai hidrokarbon hidrofobik, kumpulan sulfat polar (mengandungi anion) dan sama ada kation atau amina untuk meneutralkan kumpulan sulfat. Contohnya termasuk: natrium lauril sulfat (juga dikenali sebagai asid sulfurik mono dodecyl ester garam natrium) dan garam kalium dan ammonium yang berkaitan.
Aplikasi[sunting | sunting sumber]
Alkil sulfat biasanya digunakan sebagai surfaktan yang bersifat anionik dalam sabun cecair dan detergen yang digunakan untuk membersihkan bulu, sebagai pembersih permukaan, dan sebagai bahan aktif dalam detergen pakaian, syampu dan perapi. Ia juga boleh didapati dalam produk isi rumah seperti ubat gigi, antasid, kosmetik dan makanan. Secara amnya, bahan kimia ini terdapat dalam produk pengguna pada kepekatan antara 3-20%. Pada tahun 2003 kira-kira 118,000 t/a alkil sulfat digunakan di Amerika Syarikat. [1]
Organosulfat sintetik[sunting | sunting sumber]
Contoh biasa ialah natrium lauril sulfat, dengan formula CH3(CH2)11 OSO3Na. Bahan ini juga biasa didapati dalam produk pengguna ialah ester sulfat bagi alkohol berlemak etoksilasi seperti yang diperoleh daripada alkohol lauril. Contohnya ialah sodium laureth sulfate, bahan dalam sesetengah kosmetik.
Alkylsulfate boleh dihasilkan daripada alkohol, yang seterusnya diperoleh melalui penghidrogenan minyak dan lemak haiwan atau sayuran atau menggunakan proses Ziegler atau melalui sintesis oxo. Jika dihasilkan daripada bahan mentah oleokimia atau proses Ziegler, rantai hidrokarbon alkohol akan menjadi linear. Jika diperoleh menggunakan proses oxo, tahap percabangan yang rendah akan muncul biasanya dengan kumpulan metil atau etil pada kedudukan C-2, yang mengandungi jumlah rantai alkil genap dan ganjil. Alkohol ini bertindak balas dengan asid klorosulfurik:
- ClSO3H + ROH → ROSO3H + HCl
Sebagai alternatif, alkohol boleh ditukar kepada setengah ester sulfat dengan tindak balas bersama sulfur trioksida: [2]
- SO3 + ROH → ROSO3H
Sesetengah organosulfat boleh disediakan oleh pengoksidaan persulfat Elbs bagi fenol dan proses pengoksidaan Boyland-Sims bagi anilin.
Dialkilsulfat[sunting | sunting sumber]

Keluarga organosulfat yang kurang biasa mempunyai formula RO-SO2-OR'. Mereka disediakan daripada asid sulfurik dan alkohol. Contoh utama ialah dietil sulfat dan dimetil sulfat, cecair tidak berwarna yang digunakan sebagai reagen dalam sintesis organik. Sebatian ini adalah agen pengalkilasi yang berpotensi berbahaya. Dialkilsulfat tidak berlaku dalam alam semula jadi. [3]
Ester sulfat semulajadi[sunting | sunting sumber]

3adi.
Beberapa kelas ester sulfat wujud dalam alam semula jadi. Terutama biasa ialah derivatif gula seperti keratan sulfat, kondroitin sulfat, dan heparin antikoagulan.[4] Pengubahsuaian selepas terjemahan beberapa protein memerlukan sulfation, selalunya pada kumpulan fenol sisa tirosin.[5] Sulfat steroid ialah estradiol sulfat, prekursor terpendam kepada hormon estrogen.
Sebahagian besar sulfur tanah adalah dalam bentuk ester sulfat.[6]
Metabolisme[sunting | sunting sumber]
Sulfat ialah sebuah molekul bersifat anion lengai, jadi untuk mengaktifkannya ia boleh melalui pembentukan terbitan bersifat ester adenosin 5'-fosfosulfat (APS) dan 3'-fosfoadenosin-5'-fosfosulfat (PAPS). Banyak organisma menggunakan tindak balas ini untuk tujuan metabolik atau untuk biosintesis sebatian sulfur yang diperlukan untuk kehidupan.[7] Pembentukan dan hidrolisis ester sulfat semulajadi dimangkinkan oleh sulfatases (aka sulfohydrolases). [3]
Keselamatan[sunting | sunting sumber]
Oleh kerana ia digunakan secara meluas dalam produk komersial, aspek keselamatan organosulfat sudah pun dikenalpasti. [8]
Kesihatan manusia[sunting | sunting sumber]
Alkil sulfat jika tertelan diserap dengan baik dan dimetabolismekan menjadi C3, C4 atau C5 sulfat dan metabolit tambahan. Perengsa tertinggi alkil sulfat ialah natrium laurilsulfat, dengan ambang sebelum kerengsaan pada kepekatan 20%. Surfaktan dalam produk pengguna biasanya bercampur, mengurangkan kemungkinan kerengsaan. Menurut OECD TG 406, alkil sulfat dalam kajian haiwan tidak didapati sebagai pemeka kulit. [8] [9]
Kajian makmal tidak menemui alkil sulfat sebagai genotoksik, mutagenik atau karsinogenik. Tiada kesan pembiakan jangka panjang ditemui.[10]
Persekitaran[sunting | sunting sumber]
Pelupusan utama alkil sulfat daripada produk komersial terpakai ialah melalui penggunaan air sisa. Kepekatan alkilsulfat dalam efluen daripada loji rawatan air sisa (WWTP) telah diukur pada 10 mikrogram per liter (5.8×10−9 oz/in3) dan lebih rendah. Alkil sulfat terbiodegradasi dengan mudah, malah mungkin bermula sebelum sampai ke WWTP. Sebaik sahaja di loji rawatan, ia cepat dikeluarkan oleh biodegradasi. Invertebrata didapati sebagai kumpulan trofik yang paling sensitif kepada alkil sulfat. Sodium laurylsulfate yang diuji pada Uronema parduczi, protozoa, didapati mempunyai nilai kesan terendah dengan 20 h-EC5 ialah 0.75 miligram per liter (2.7×10−8 lb/in3). Ujian pendedahan kronik dengan C12 hingga C18 dengan invertebrata Ceriodaphnia dubia mendapati ketoksikan tertinggi adalah dengan C14 ( NOEC ialah 0.045 mg/L).
Dari segi kestabilan terma, alkil sulfat terurai dengan baik sebelum mencapai takat didihnya disebabkan oleh tekanan wap yang rendah (bagi bahan C8-18, ianya daripada 10-11 kepada 10-15 hPa). Penyerapan tanah adalah berkadar dengan panjang rantai karbon, dengan panjang 14 dan lebih mempunyai kadar serapan tertinggi. Kepekatan tanah didapati berbeza dari 0.0035 hingga 0.21 miligram per kilogram (5.6×10−8 hingga 3.4×10−6 oz/lb) dw.
Rujukan[sunting | sunting sumber]
- ^ CEH (October 2004). "Surfactants, household detergents and their raw materials". CEH Marketing Research Report. Missing or empty
|url=(bantuan) - ^ Kosswig, Kurt (2005), "Surfactants", Ullmann's Encyclopedia of Industrial Chemistry (dalam bahasa Inggeris), Weinheim: Wiley-VCH, doi:10.1002/14356007.a25_747
- ^ a b Cleland, W. Wallace; Hengge, Alvan C. (2006). "Enzymatic Mechanisms of Phosphate and Sulfate Transfer". Chemical Reviews. 106 (8): 3252–3278. doi:10.1021/cr050287o. PMID 16895327.
- ^ J. W. Fitzgerald (1976). "Sulfate ester formation and hydrolysis: a potentially important yet often ignored aspect of the sulfur cycle of aerobic soils". Bacteriological Reviews. 40 (3): 698–721. doi:10.1128/br.40.3.698-721.1976. PMC 413977. PMID 791238.
- ^ Moore, Kevin L. (2003). "The Biology and Enzymology of Protein Tyrosine O-Sulfation". Journal of Biological Chemistry. 278 (27): 24243–24246. doi:10.1074/jbc.R300008200. PMID 12730193.
- ^ Scherer, H.W. (2001). "Sulphur in crop production — invited paper". European Journal of Agronomy. 14 (2): 81–111. doi:10.1016/S1161-0301(00)00082-4.
- ^ M. T. Madigan, J. M. Martinko, J. Parker "Brock Biology of Microorganisms" Prentice Hall, 1997. ISBN 0-13-520875-0.
- ^ a b SDA/Alkylsulfate Consortium (2007). "SIDS Initial Assessment Profile. SIAM 25: Alkyl Sulfates, Alkane Sulfonates, and α-Olefin sulfonates" (PDF). OECD SIDS. Helsinki.
- ^ DE/ICCA (2009). "SIDS Initial Assessment Profile SIAM 25: Alkyl Sulfates, Alkane Sulfonates, and α-Olefin sulfonates". OECD.
- ^ Wibbertmann, A; Mangelsdorf, I.; Gamon, K.; Sedlak, R. (2011). "Toxicological properties and risk assessment of the anionic surfactants category: Alkyl sulfates, primary alkane sulfonates, and α-Olefin sulfonate". Ecotoxicology and Environmental Safety. 74 (5): 1089–1106. doi:10.1016/j.ecoenv.2011.02.007. PMID 21463896.
