Petala elektron: Perbezaan antara semakan
Tiada ringkasan suntingan |
Tiada ringkasan suntingan |
||
| Baris 2: | Baris 2: | ||
Dalam bidang [[kimia]] dan [[fizik atom]], '''petala elektron''' atau juga dikenali sebagai '''tahap tenaga utama''' merujuk kepada [[orbit]] yang mempunyai [[elektron]] yang mengelilingi sesuatu [[nukleus]] [[atom]]. Petala yang terdekat dengan nukleus ialah "petala 1" (juga dikenali sebagai "petala K"), diikuti dengan "petala 2" (atau "petala L"), "petala 3" (atau "petala M") dan berikutnya. Petala elektron bersamaan dengan nombor kuantum utama (''n'' = 1, 2, 3, 4 ...) atau dilabel mengikut huruf abjad dalam notasi sinaran X (K, L, M, …). |
Dalam bidang [[kimia]] dan [[fizik atom]], '''petala elektron''' atau juga dikenali sebagai '''tahap tenaga utama''' merujuk kepada [[orbit]] yang mempunyai [[elektron]] yang mengelilingi sesuatu [[nukleus]] [[atom]]. Petala yang terdekat dengan nukleus ialah "petala 1" (juga dikenali sebagai "petala K"), diikuti dengan "petala 2" (atau "petala L"), "petala 3" (atau "petala M") dan berikutnya. Petala elektron bersamaan dengan nombor kuantum utama (''n'' = 1, 2, 3, 4 ...) atau dilabel mengikut huruf abjad dalam notasi sinaran X (K, L, M, …). |
||
Setiap petala elektron hanya mampu mengandungi bilangan elektron yang tetap. Petala elektron yang pertama mampu menampung dua elektron, petala elektron kedua mampu menampung lapan elektron (2 + 6), manakala petala yang ketiga menampung sehingga 18 (2 + 6 + 10) elektron dan berikutnya. Formula umum ialah petala elektron yang ke-''n'' menampung sehingga 2([[kuasa dua|''n''<sup>2</sup>]]) elektron.<ref name="madsci">[http://www.madsci.org/posts/archives/1999-03/921736624.Ch.r.html Re: Why do electron shells have set limits ?] madsci.org, 17 March 1999, Dan Berger, Faculty Chemistry/Science, Bluffton College</ref> |
|||
==Rujukan== |
|||
<references/> |
|||
Semakan pada 16:32, 16 Jun 2015
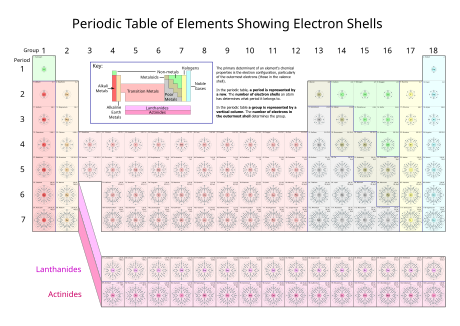
Dalam bidang kimia dan fizik atom, petala elektron atau juga dikenali sebagai tahap tenaga utama merujuk kepada orbit yang mempunyai elektron yang mengelilingi sesuatu nukleus atom. Petala yang terdekat dengan nukleus ialah "petala 1" (juga dikenali sebagai "petala K"), diikuti dengan "petala 2" (atau "petala L"), "petala 3" (atau "petala M") dan berikutnya. Petala elektron bersamaan dengan nombor kuantum utama (n = 1, 2, 3, 4 ...) atau dilabel mengikut huruf abjad dalam notasi sinaran X (K, L, M, …).
Setiap petala elektron hanya mampu mengandungi bilangan elektron yang tetap. Petala elektron yang pertama mampu menampung dua elektron, petala elektron kedua mampu menampung lapan elektron (2 + 6), manakala petala yang ketiga menampung sehingga 18 (2 + 6 + 10) elektron dan berikutnya. Formula umum ialah petala elektron yang ke-n menampung sehingga 2(n2) elektron.[1]
Rujukan
- ^ Re: Why do electron shells have set limits ? madsci.org, 17 March 1999, Dan Berger, Faculty Chemistry/Science, Bluffton College
