Atom
| Atom | ||||||
|---|---|---|---|---|---|---|
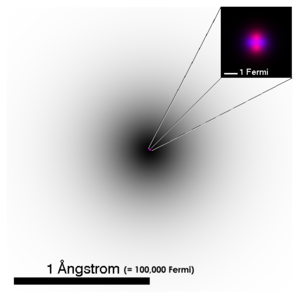 | ||||||
| Gambaran separa tepat berkenaan struktur atom helium. Kegelapan awan elektron adalah berpadanan dengan kamiran garis penglihatan pada fungsi kebarangkalian orbital elektron pertama. Nukleus atom yang telah diperbesarkan ini bercirikan skematik, dengan proton berwarna merah jambu dan neutron berwarna ungu. Secara nyata, nukleus (dan fungsi gelombang setiap nukleon) juga berbentuk sfera secara bersimetri. (Terdapat perbezaan bagi kes-kes nukleus kompleks.) | ||||||
| Pengelasan | ||||||
| ||||||
| Sifat | ||||||
|
Dalam bidang kimia dan fizik, atom (Bahasa Yunani άτομος atau átomos bermaksud "tak terbahagi") adalah zarah terkecil yang boleh didapati dalam unsur kimia tanpa mengubah sifat-sifat kimianya. Perkataan atom pada asalnya bermaksud zarah tak terbahagi terkecil yang boleh didapati, akan tetapi setelah istilah tersebut mendapat maksud yang khusus dalam sains, atom-atom dijumpai boleh dibahagikan lagi dan adalah terdiri daripada zarah subatom.
Kebanyakan atom mengandungi tiga jenis zarah subatom yang menentukan sifat-sifat luarannya:
- elektron, yang mempunyai cas negatif dan adalah yang terkecil antara ketiga-tiga zarah ini
- proton, yang mempunyai cas positif dan adalah kira-kira 1836 kali lebih besar daripada elektron; dan
- neutron, yang tidak bercas dan adalah kira-kira 1839 kali lebih besar daripada elektron.
Proton dan neutron bergabung membentuk nukleus atom yang padat dan besar, dan bersama-sama adalah dipanggil nukleon. Elektron-elektron membentuk awan elektron yang lebih besar di sekeliling nukleus.
Setiap atom mempunyai bilangan zarah-zarah subatom yang berlainan. Bilangan proton dalam atom (dipanggil nombor atom) menentukan unsur atom tersebut. Di antara unsur-unsur yang sama, bilangan neutron juga boleh berubah-ubah, dan ini menentukan isotop unsur tersebut. Bilangan proton dan neutron di dalam nukleus atom juga boleh berubah, melalui pembelahan nukleus, pelakuran nukleus dan reputan radioaktif. Bilangan elektron yang berkaitan dengan suatu atom paling mudah berubah, kerana tenaga yang rendah yang digunakan untuk mengikat elektron-elektron.
Atom adalah neutral secara elektik jika ia mempunyai bilangan proton dan elektron yang sama. Atom yang mengalami pengurangan atau penambahan elektron adalah dipanggil ion. Elektron yang terletak paling jauh daripada nukleus boleh dipindahkan ke atom yang berhampiran atau dikongsi bersama-sama atom lain. Melalui mekanisme ini atom dapat terikat menjadi molekul dan lain-lain jenis sebatian kimia seperti hablur berangkaian ionik atau kovalen. Bagi gas dan sesetengah cecair dan pepejal molekul (seperi air dan gula), molekul adalah pembahagian jirim terkecil yang masih mengekalkan sifat-sifat kimia; akan tetapi, terdapat juga banyak lagi pepejal dan cecair yang terdiri daripada atom-atom, dan tidak mengandungi molekul berasingan (contohnya garam, batuan, dan logam cecair dan pepejal). Kebanyakan molekul terdiri daripada berbilang atom; contohnya, molekul air merupakan gabungan dua atom hidrogen dan satu atom oksigen. Beberapa jenis molekul (contohnya unsur molekul gas yang tidak membentuk sebatian, seperti helium), terdiri daripada hanya satu jenis atom.
Atom adalah blok binaan asas dalam kimia, dan adalah terabadi dalam tindak balas kimia.
Sejarah Perkembangan Model Atom
[sunting | sunting sumber]Perkataan atom berasal dari bahasa Yunani yang bermaksud sesuatu yang tidak boleh dipecahkan lagi. Democritus(460 – 357 S.M) merupakan orang pertama yang memperkenalkan konsep atom.Ini sejajar dengan teori Dalton yang menyatakan atom merupakan zarah yang paling kecil dan tidak boleh dibahagikan lagi.
Antara ahli-ahli kimia yang telah menyumbang kepada perkembangan model atom ialah:
Keistimewaan Atom Karbon
[sunting | sunting sumber]Atom karbon dengan nombor atom 6 mempunyai susunan elektron K = 2, L = 4, maka ia mempunyai 4 elektron valensi dan dapat membentuk empat ikatan kovalen, serta dapat digambarkan dalam rumus Lewis sebagai berikut, umpamanya untuk CH4.
ikatan dalam molekul metana [gambar] atom karbon
[gambar] 4 atom hidrogen
[gambar] molekul metana ( CH4 ) [gambar] diagram sederhana dari molekul metana

H H \ / C / \ H H
empat ikatan kovalen dari molekul metana Selain itu atom karbon mempunyai kemampuan untuk membentuk ikatan dengan atom karbon lain membentuk rantai karbon yang terbuka atau tertutup/berlingkar. Contoh-contoh rantai karbon dapat digambarkan dengan rumus struktur :
| | | | |
- C - C - - C - C - C -
| | | | | C
rantai terbuka rantai terbuka dan bercabang
| |
- C - C -
| |
- C - C -
| |
rantai tertutup Sekarang terjawablah mengapa jumlah senyawa karbon demikian banyaknya walaupun jumlah jenis unsur pembentuknya sedikit.
Atoms dalam falsafah
[sunting | sunting sumber]Idea bahawa bahan adalah terdiri daripada unit tertentu merupakan idea yang sangat lama, yang terdapat dalam kebanyakan kebudayaan purba seperti Greece dan India. Perkataan "atom" dicipta oleh ahli-ahli falsafah Yunani purba. Walau bagaimanapun, idea-idea ini adalah berasaskan pada pemikiran falsafah dan teologi dan bukannya berdasarkan bukti dan kajian. Hasilnya, pandangan mereka mengenai bagai mana rupa atom dan kelakuannya ADALAH tidak tepat. Mereka juga tidak dapat meyakinkan semua orang, dengan itu pengikut atom hanyalah salah satu daripada beberapa teori mengenai sifat jirim yang bersaing. Hanya pada abad ke-19 barulah idea itu diterima dan diperhalusi oleh para saintis, apabila perkembangan sains kimia menghasilkan penemuan yang hanya boleh dijelaskan melalui konsep atom.
Teori pertama berasaskan bukti
[sunting | sunting sumber]
.
Pada awal tahun 1800-an, John Dalton menggunakan konsep atom untuk menjelaskan mengapa unsur sentiasa bertindak balas dalam nisbah nombor bulat kecil (hukum pelbagai perkadaran). Sebagai contoh, terdapat dua jenis oksida timah: satu adalah 88.1% timah dan 11.9% oksigen dan yang lain adalah 78.7% timah dan 21.3% oksigen (tinmah (II) oksida dan tin dioksida setiap satunya). Ini bermakna 100g tin akan bergabung sama ada dengan 13.5g atau 27g oksigen. 13.5 dan 27 membentuk nisbah 1: 2, satu nisbah nombor bulat kecil. Ini merupakan corak biasa dalam kimia yang mencadangkan pada Dalton bahawa unsur-unsur bertindak balas dalam gandaan nombor bulat unit diskret-atau dalam kata lain, atom. Dalam kes oksida timah, satu atom timah akan bergabung dengan salah satu atau dua atom oksigen. [1]
Dalton juga percaya bahawa teori atom boleh menjelaskan mengapa air menyerap gas-gas berbeza dalam perkadaran yang berbeza. Sebagai contoh, beliau mendapati bahawa air menyerap karbon dioksida jauh lebih baik daripada ia menyerap nitrogen.[2] Dalton membuat andaian hipotesis bahawa ini adalah disebabkan oleh perbezaan antara jisim dan tatarajah zarah setiap gas', dan molekul karbon dioksida (CO2) adalah lebih berat dan lebih besar berbanding molekul nitrogen (N2).
Pergerakan Brownian
[sunting | sunting sumber]Pada tahun 1827, seorang ahli botani, Robert Brown menggunakan mikroskop untuk melihat butiran debu terapung di dalam air dan mendapati bahawa ia bergerak secara liar, satu fenomena yang dikenali sebagai "gerakan Brownian". Ini dipercayai disebabkan oleh molekul air melanggar butiran merata. Pada tahun 1905, Albert Einstein membuktikan realiti molekul dan pergerakan mereka dengan menghasilkan analisa pertama fizik Statistik bagi gerakan Brownian. [3][4][5] Seorang ahli fizik Perancis Jean Perrin menggunakan kerja Einstein untuk membuat uji kaji bagi menentukan jisim dan dimensi atom, dengan itu secara muktamad mengesahkan teori atom Dalton.[6]
Jumpaan elektron
[sunting | sunting sumber]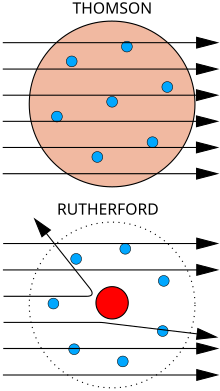
Atas: Hasil dijangka: Partikel alpha melalui menerusi model puding plum bagi atom dengan lencongan minima.
Bawah: Hasil dilihat: sebilangan kecil partikel dilencongkan oleh tumpuan caj positif bagi nukleus.
Seorang ahli fizik J. J. Thomson mengukur jisim pancaran katod, membuktikan ia terbentuk dari partikel, tetapi 1,800 kali ganda lebih ringan berbanding atom teringan, hidrogen. Dengan itu, ia bukan atom, tetapi partikel baru, partikel sub-atom pertama ditemui, yang dia pada asalnya gelar "corpuscle" tetapi kemudiannya dinamakan elektron, sempena partikel yang diramal oleh George Johnstone Stoney pada tahun 1874. Dia turut membuktikan bahawa ia adala sama dengan partikel yang dihasilkan oleh bahan fotoelektrik dan radioaktif.[7] Ia dengan cepat disedari bahawa ia merupakan partikel yang membawa arus eletrik dalam wayar logam, dan membawa caj negetif eletrik dalam atom. Thomson diberikan Hadiah Nobel bagi Fizik 1906 bagi penyelidikannya. Dengan itu dia membalikkan kepercayaan bahawa atom adalah jisim partikel ulung, yang tidak dapat dibahagi.[8] Thomson turut silap menjangkakan bahawa elektron bercaj negetif berjisim rendah tersebar dalam atom yang mempunyai caj positif secara sekata. Ini dikenali sebagai model model puding plum .
Jumpaan nukleus
[sunting | sunting sumber]Pada tahun 1909, Hans Geiger dan Ernest Marsden , di bawah penyeliaan Ernest Rutherford, menghujani kerajang logam dengan zarah alfa untuk melihat bagaimana ia bertaburan. Mereka menjangkakan semua zarah alpha akan melepasi lurus melalui dengan sedikit pesongan, kerana model Thomson berkata bahawa caj dalam atom amat bertaburan sehingga medan elektrik mereka tidak boleh menjejaskan zarah alfa dengan banyak. Walau bagaimanapun, Geiger dan Marsden mendapati zarah alfa yang dipesongkan oleh sudut yang lebih besar melebihi 90°, yang sepatutnya menjadi mustahil mengikut model Thomson. Untuk menjelaskan ini, Rutherford mencadangkan caj positif atom tertumpu di nukleus kecil di tengah-tengah atom.[9] Rutherford membanding penemuannya dengan satu tembakan peliru 15 inci dan ia datang balik untuk mengenai orang yang melepaskan tembakan itu.[10]
Jumpaan isotop
[sunting | sunting sumber]Ketika menguji dengan hasil pereputan radioaktif , pada tahun 1913 ahli radiokimia Frederick Soddy menjumpai bahawa ia kelihatannya lebih dari satu jenis atom pada setiap kedudukan pada jadual berkala.[11] Istilah isotop telah dicipta oleh Margaret Todd sebagai nama yang sesuai untuk atom yang berbeza yang tergolong pada unsur yang sama. J.J. Thomson mencipta teknik untuk memisahkan jenis atom melalui penyelidikannya berkenaan gas terion, yang kemudiannya membawa kepada penemuan Isotop stabil.[12]
Model Bohr
[sunting | sunting sumber]
Pada tahun 1913, seorang ahli fizik, Niels Bohr mencadangkan satu model di mana elektron atom itu dianggap mengelilingi nukleus tetapi hanya boleh berbuat demikian dalam satu set orbit terhad, dan boleh melompat antara orbit ini hanya melalui perubahan diskret tenaga sepadan dengan penyerapan atau sinaran foton.[13] Pengkuantuman ini telah digunakan untuk menjelaskan mengapa orbit elektron stabil (memandangkan biasanya, caj memecut, termasuk gerakan membulat, kehilangan tenaga kinetik yang dipancarkan sebagai radiasi elektromagnet, lihat radiasi sinkrotron ) dan mengapa unsur menyerap dan memancarkan sinaran elektromagnet dalam spektrum diskret.[14]
Kemudian pada tahun yang sama Henry Moseley memberikan eksperimen tambahan yang memihak kepada teori Niels Bohr. Keputusan ini diperhalusi oleh model Ernest Rutherford dan Antonius Van Den Broek, yang mencadangkan bahawa atom yang terkandung dalam nukleus sebilangan caj nuklear positif yang sama dengan nombor (atom) dalam jadual berkala. Sehingga ujikaji ini, nombor atom tidak diketahui sebagai kuantiti fizikal dan eksperimental. Bahawa ia menyamai dengan caj nuklear atomik merupakan model atom yang kekal diterima hari ini.[15]
Ikatan kimia dijelaskan
[sunting | sunting sumber]Ikatan kimia antara atom kini telah dijelaskan, oleh Gilbert Newton Lewis pada tahun 1916, sebagai interaksi antara elektron konstituen mereka.[16] Oleh kerana sifat-sifat kimia bagi unsur adalah diketahui sebahagian besarnya mengulangi diri mereka mengikut undang-undang berkala,[17] pada tahun 1919 seorang ahli kimia Amerika, Irving Langmuir mencadangkan bahawa ia boleh dijelaskan sekiranya elektron dalam atom telah disambungkan atau berkelompok bentuk tertentu. Kumpulan elektron dipercayai menduduki satu set kelonsong elektron mengelilingi nukleus itu.[18]
Perkembangan dalam fizik kuantum
[sunting | sunting sumber]Ujian Stern-Gerlach pada tahun 1922 memberikan satu lagi bukti mengenai sifat kuantum atom. Apabila pancaran atom perak telah melalui medan magnet berbentuk khas, pancaran tersebut telah berpecah berdasarkan arah pergerakan sudut zarah, atau putaran. Oleh kerana arah ini adalah rawak, pancaran boleh dijangka tersebar pada satu barisan. Sebaliknya, pancaran telah berpecah kepada dua bahagian, bergantung kepada sama ada putaran atom telah berorientasikan pada atas atau bawah.[19]
Pada tahun 1924, Louis de Broglie mencadangankan bahawa semua zarah sedikit sebanyak berkelakuan seperti gelombang. Pada tahun 1926, Erwin Schrödinger, menggunakan idea ini untuk mengembangkan model Matematik bagi atom yang menyifatkan elektron sebagai bentuk gelombang tiga dimensi, dan bukannya zarah titik. Hasil menggunakan satu bentuk gelombang untuk menggambarkan zarah adalah ia adalah mustahil secara matematik bagi mendapatkan nilai yang tepat bagi kedua-dua kedudukan dan momentum zarah pada titik tertentu pada masa tertentu; dikenali sebagai prinsip ketidakpastian , yang dirumuskan oleh Werner Heisenberg pada tahun 1926. Dalam konsep ini, untuk ketepatan yang diberikan bagi mengukur kedudukan seseorang hanya boleh mendapatkan julat nilai kemungkinan untuk momentum, dan sebaliknya.[20] Model ini dapat menjelaskan pemerhatian tingkah laku atom yang model sebelumnya tidak boleh lakukan, seperti struktur dan pola spektrum bagi atom yang lebih besar berbanding hidrogen. Dengan itu, model planet bagi atom disingkirkan dan diganti dengan yang menggambarkan zon orbital atom mengelilingi nukleus di mana elektron tertentu kemungkinan besar dapat dipantau.[21][22]
Penemuan neutron
[sunting | sunting sumber]Pembangunan spektrometri jisim membenarkan jisim Atom dapat diukur dengan semakin tepat. Peranti ini menggunakan magnet untuk melencong trajektori pancaran ion, dan jumlah pesongan ditentukan oleh nisbah jisim atom berbanding casnya. Seorang ahli kimia Francis William Aston menggunakan peralatan ini untuk membuktikan Isotop memiliki jisim yang berbeza. Jisim atom yang berbeza-beza untuk isotop ini menurut jumlah integer, dipanggil peraturan nombor bulat.[23] Penjelasan untuk isotop yang berbeza ini menantikan penemuan neutron, zarah bercas dengan jisim sama seperti proton, oleh ahli fizik James Chadwick pada tahun 1932. Isotop ketika itu dijelaskan sebagai unsur-unsur dengan nombor proton yang sama, tetapi nombor neutron berbeza dalam nukleus.[24]
Pembelahan, fizik bertenaga tinggi dan jisim padat
[sunting | sunting sumber]Pada tahun 1938, seorang ahli kimia Jerman Otto Hahn, seorang pelajar Rutherford, mensasar neutron pada atom uranium dan menjangkakan untuk mendapatkan unsur transuranium. Sebaliknya, eksperimen kimia beliau menunjukkan barium sebagai dengan hasilan.[25][26] Setahun kemudian, Lise Meitner dan anak saudaranya Otto Frisch mengesahkan bahawa hasil Hahn ini adalah eksperimen pembelahan nuklear pertama.[27][28] Pada tahun 1944, Hahn menerima hadiah Nobel dalam bidang kimia. Disebalik usaha Hahn ini, sumbangan Meitner dan Frisch tidak diiktiraf.[29]
Pada tahun 1950-an pembangunan pemecut zarah versi yang lebih baik yang dan pengesan zarah membenarkan ahli saint untuk mengkaji Kesan atom bergerak pada tenaga tinggi.[30] Neutron dan proton didapati sebagai hadron, atau komposit zarah lebih kecil yang dipanggil kuark. Model standard fizik zarah yang telah dibangunkan setakat ini telah berjaya menjelaskan sifat-sifat nukleus dari segi zarah sub-atom dan kuasa-kuasa yang mengawal interaksi mereka.[31]
Lihat Juga
[sunting | sunting sumber]Rujukan
[sunting | sunting sumber]- ^ Andrew G. van Melsen (1952). From Atomos to Atom. Mineola, N.Y.: Dover Publications. ISBN 0-486-49584-1.
- ^ Dalton, John. "On the Absorption of Gases by Water and Other Liquids", in Memoirs of the Literary and Philosophical Society of Manchester. 1803. Retrieved on August 29, 2007.
- ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamaadp322_8_549 - ^ Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. m/s. 1–7. ISBN 0-19-851567-7. OCLC 48753074.
- ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamalee_hoon1995 - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamae31_2_50 - ^ Thomson, J. J. (August 1901). "On bodies smaller than atoms". The Popular Science Monthly. Bonnier Corp.: 323–335. Dicapai pada 2009-06-21.
- ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamanobel1096 - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamapm21_669 - ^ "The Gold Foil Experiment". myweb.usf.edu. Diarkibkan daripada yang asal pada 2016-11-19. Dicapai pada 2017-07-02.
- ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamanpc1921 - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamaprsA_89_1_1913 - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamastern20050516 - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamabohr19221211 - ^ Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. m/s. 228–230. ISBN 0-19-851971-0.
- ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamajacs38_4_762 - ^ Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. m/s. 205–226. ISBN 0-19-530573-6.
- ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamajacs41_6_868 - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamafop17_6_575 - ^ TED-Ed (16 September 2014). "What is the Heisenberg Uncertainty Principle? - Chad Orzel" – melalui YouTube.
- ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamabrown2007 - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamaharrison2000 - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamapm39_6_449 - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamachadwick1935 - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamaBowden - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamaCHF - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamanature143_3615_239 - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamaschroeder - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamapt50_9_26 - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamakullander2001 - ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamanpp1990
