Fosfat

| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC sistematik
Phosphate[1] | |||
| Pengecam | |||
Imej model 3D Jmol
|
|||
| 3903772 | |||
| ChEBI | |||
| ChemSpider | |||
| 1997 | |||
| MeSH | Phosphates | ||
PubChem CID
|
|||
| UNII | |||
| |||
| |||
| Sifat | |||
| PO3− 4 | |||
| Jisim molar | 94.9714 g mol−1 | ||
| Asid konjugat | Monohydrogen phosphate | ||
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |||
| | |||
| Rujukan kotak info | |||

Dalam kimia tak organik, sesuatu fosfat merupakan sejenis garam asid fosforik. Dalam kimia organik, sesuatu fosfat, atau organofosfat, merupakan ester asid fosforik. Fosfat adalah penting dalam biokimia dan biogeokimia.
Ciri kimia[sunting | sunting sumber]
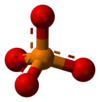
Ion fosfat merupakan sejenis ion poliatom dengan formula empirik PO43− dan mempunyai jisim molar 94.973 g mol-1. Ia terdiri daripada satu atom fosforus pusat dikelilingi oleh empat atom oksigen sama dalam susunan tetrahedron. Ion fosfat membawa cas formal tiga negatif dan merupakan bes konjugat ion hidrogen fosfat, HPO42-, yang merupakan bes konjugat ion dihidrogen fosfat, H2PO4-, yang merupakan bes konjugat asid fosforik, H3PO4. Fosfat merupakan molekul hipervalen (atom fosforus mempunyai sepuluh elektron dalam petala valensnya. Fosfat juga merupakan sebatian organofosforus dengan formula OP(OR)/*.
Garam fosfat dibentuk apabila sebuah ion bercas positif berhubung dengan atom oksigen bercas negatif ion fosfat, menghasilkan sejenis sebatian ion. Kebanyakan fosfat tidak larut dalam air pada suhu dan tekanan piawai.
Dalam larutan akueous cair, fosfat wujud dalam empat bentuk. Dalam keadaan berbes kuat, ion fosfat, PO43− adalah paling lazim, manakala dalam keadaan berbes lemah, ion hidrogen fosfat, HPO42− paling lazim. Dalam keadaan berasid lemah, ion dihidrogen fosfat, H2PO4- paling lazim, manakala dalam keadaan berasid kuat, bentuk utama ialah asid fosforik, H3PO4.
Rujukan[sunting | sunting sumber]
- ^ "Phosphates – PubChem Public Chemical Database". The PubChem Project. USA: National Center of Biotechnology Information.