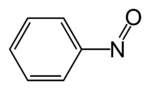
Nitrosobenzena
| |

| |
| Nama | |
|---|---|
| Nama IUPAC pilihan
Nitrosobenzena | |
| Pengecam | |
Imej model 3D Jmol
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.008.721 |
| KEGG | |
PubChem CID
|
|
| Nombor RTECS |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| Sifat | |
| C6H5NO | |
| Jisim molar | 107.11 g·mol−1 |
| Rupa bentuk | Pepejal hijau gelap (monomer pemejalwapan baru); pepejal kuning pucat (dimer); larutan hijau cerah (sensitif cahaya) |
| Takat lebur | 65 hingga 69 °C (149 hingga 156 °F; 338 hingga 342 K) |
| Takat didih | 59 °C (138 °F; 332 K) (at 18 mmHg) |
| Rendah | |
| Keterlarutan dalam pelarut lain | Laurt dalam pelarut organik |
| -59.1·10−6 cm3/mol | |
| Struktur | |
| Bentuk molekul | N ialah sp2 |
| Bahaya | |
| Bahaya-bahaya utama | Beracun |
| Piktogram GHS | 
|
| Perkataan isyarat GHS | Danger |
| H301, H312, H332 | |
| P261, P264, P270, P271, P280, P301+310, P302+352, P304+312, P304+340, P312, P321, P322, P330, P363, P405, P501 | |
| Sebatian berkaitan | |
Sebatian berkaitan
|
Nitrobenzena Anilina |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| | |
| Rujukan kotak info | |
Nitrosobenzena ialah sebatian organik dengan formula C6H5NO. Ia adalah salah satu sebatian nitroso organik prototaip. Ciri kumpulan fungsinya, ia berupakan spesies hijau gelap yang wujud dalam keseimbangan dengan dimer kuning pucatnya. Kedua-dua monomer dan dimer adalah diamagnet.
Keseimbangan monomer-dimer[sunting | sunting sumber]
Nitrosobenzena dan nitrosoarena lain biasanya mengambil bahagian dalam keseimbangan monomer-dimer. Dimer sering digemari dalam keadaan pepejal, manakala monomer berwarna dalam disukai dalam larutan cair atau pada suhu yang lebih tinggi. Dimer boleh dirumuskan sebagai Ar(O−)N+=N+(O−)Ar. Mereka wujud sebagai cis- dan trans-isomer kerana kehadiran ikatan rangkap N–N. Dimer kadangkala dipanggil azobenzenedioksida . Pengisomeran cis-trans berlaku melalui perantaraan monomer.[1]
Dalam kes nitrosobenzena, bentuk monomerik metastabil boleh disediakan dengan pemejalwapan dengan kondenser cold finger. Bahan monomerik dikenakan pemejalwapan secara selektif kerana berat molekulnya yang lebih rendah dan dikumpul dalam kondenser sebagai kristal hijau gelap yang berkilat. Lama kelamaan, bahan monomerik menjadi dimer untuk memberikan induk azobenzena-N,N ′-dioksida sebagai pepejal kuning pucat. Seperti yang ditentukan oleh prinsip le Chatelier, nitrosobenzena wujud dalam fasa larutan sebagai campuran monomer dan dimer dalam keseimbangan dinamik yang komposisinya bergantung kepada suhu (monomer digemari pada suhu yang lebih tinggi) dan kepekatan (monomer digemari pada kepekatan rendah), serta identiti medium (fasa gas atau pelarut).[2]

Penyediaan[sunting | sunting sumber]
Nitrosobenzena yang pertama telah dihasilkan oleh Adolf von Baeyer melalui tindak balas difenilmerkuri dan nitrosil bromida:[4]
- (C6H5)2Hg + BrNO → C6H5NO + C6H5HgBr
Sintesis moden memerlukan penurunan nitrobenzena kepada fenilhidroksilamina (C6H5NHOH) yang kemudiannya dioksidakan oleh natrium dikromat (Na2Cr2O7).[5]
Nitrosobenzena juga boleh disediakan melalui pengoksidaan anilina menggunakan asid peroksimonosulfurik (asid Caro)[6] atau kalium peroksimonosulfat di bawah keadaan dwifasa.[7] Ia biasanya disucikan melalui pemejalwapan atau penyulingan wap, di mana ia mempunyai sifat fizikal berbentuk cecair hijau yang menjadi pepejal tidak berwarna.
Pencirian tindak balas[sunting | sunting sumber]
Nitrosobenzena melalui proses tindak balas Diels-Alder dengan diena.[8] Pemeluwapan dengan anilina boleh menghasilkan terbitan azobenzena dalam tindak balas yang dikenali sebagai tindak balas Mills. Pengurangan nitrosobenzena menghasilkan anilina.
Salah satu ciri utamanya, nitrosobenzena akan terkondensasi dengan kumpulan metilena aktif, seperti ester malonik dan fenilasetonitril. Fenilasetonitril (PhCH2CN) memberikan kumpulan imina (PhC(CN)=NPh) dalam tindak balas yang dikenali sebagai tindak balas Ehrlich-Sachs.[9]
- Ph–CH2-CN + Ph–NO → Ph–CH(CN)–N(OH)–Ph (tambah oksiaminasi) → PhC(CN)=N–Ph
Kadangkala tindak balas pemeluwapan dengan sebatian metilena aktif menghasilkan produk tindak balas O-nitroso-aldol:[10]
- R–CH2-CHO + Ph–NO → R–CH(CHO)–O–NHPh (tambah aminoksilasi)
Rujukan[sunting | sunting sumber]
- ^ Beaudoin, D.; Wuest, J. D. (2016). "Dimerization of Aromatic C-Nitroso Compounds". Chemical Reviews. 116 (1): 258–286. doi:10.1021/cr500520s. PMID 26730505.
- ^ Varga, Katarina; Biljan, Ivana; Tomišić, Vladislav; Mihalić, Zlatko; Vančik, Hrvoj (2018-03-08). "Quantum Chemical Calculations of Monomer–Dimer Equilibria of Aromatic C -Nitroso Compounds". The Journal of Physical Chemistry A (dalam bahasa Inggeris). 122 (9): 2542–2549. Bibcode:2018JPCA..122.2542V. doi:10.1021/acs.jpca.7b12179. ISSN 1089-5639. PMID 29381362.
- ^ E.Bosch (2014). "Structural Analysis of Methyl-Substituted Nitrosobenzenes and Nitrosoanisoles". J. Chem. Cryst. 98 (2): 44. doi:10.1007/s10870-013-0489-8. S2CID 95291018.
- ^ Baeyer, A. (1874). "Nitrosobenzol und Nitrosonaphtalin". Chemische Berichte. 7 (2): 1638–1640. doi:10.1002/cber.187400702214.
- ^ G. H. Coleman, C. M. McCloskey, F. A. Stuart (1945). "Nitrosobenzene". Org. Synth. 25: 80. doi:10.15227/orgsyn.025.0080.CS1 maint: multiple names: authors list (link)
- ^ Caro, Heinrich (1898). "Hauptversammlung des Vereins deutscher Chemiker am 1. bis 4. Juni 1898 zu Darmstadt". Zeitschrift für Angewandte Chemie. 11 (36): 845ff. Bibcode:1898AngCh..11..815.. doi:10.1002/ange.18980113602.
- ^ Priewisch, Beate; Rück-Braun, Karola (March 2005). "Efficient Preparation of Nitrosoarenes for the Synthesis of Azobenzenes†". The Journal of Organic Chemistry (dalam bahasa Inggeris). 70 (6): 2350–2352. doi:10.1021/jo048544x. ISSN 0022-3263. PMID 15760229.
- ^ Yamamoto, Hisashi; Momiyama, Norie (2005). "Rich chemistry of nitroso compounds". Chemical Communications (28): 3514–3525. doi:10.1039/b503212c. PMID 16010311.
- ^ H. Feuer. S. Patai (penyunting). The Chemistry of the Nitro and Nitroso Groups Part 1. New York: Wiley. m/s. 278–283.
- ^ "Asymmetric O− and N− Nitroso Aldol Reaction – an efficient access to a-oxy and a-amino carbonyl compound" (PDF).
