Monooksigenase
| Monooksigenase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
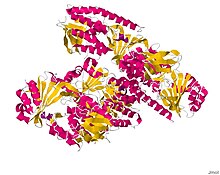 Struktur monooksigenase TetX sebagai kompleks dengan substrat, 7-iodotetrasiklina.[1] | |||||||||
| Pengenal pasti | |||||||||
| Simbol | FAD_binding_3 | ||||||||
| Pfam | PF01494 | ||||||||
| InterPro | IPR002938 | ||||||||
| SCOP | 2phh | ||||||||
| SUPERFAMILY | 2phh | ||||||||
| |||||||||
Monooksigenase ialah enzim yang memasukkan satu kumpulan hidroksi (−OH) terhadap substrat dalam laluan-laluan metabolisme. Dalam tindak balas ini, dua atom dioksigen diturunkan menjadi satu kumpulan hidroksil dan satu molekul H2O oleh pengoksidaan serentak NAD(P)H.[2][3] Mereka dikelaskan sebagai enzim oksidoreduktase yang memangkinkan pemindahan elektron.
Satu subset penting ialah sitokrom P450 omega hidroksilase yang digunakan sel untuk memetabolismekan asid arakidonik (asid eikosatetraenoik) menjadi molekul pengisyaratan sel, asid 20-hidroksieikosatetraenoik atkk menurunkan atau menyahaktifkan molekul pengisyaratan, seperti penghidroksilan leukotriena B4 menjadi 20-hidroksi-leukotriena B5, asid 5-hidroksieikosatetraenoik menjadi asid 5,20-dihidroksieikosatetraenoik, asid 5-okso-eikosatetraenoik menjadi asid 5-okso-20-hidroksieikosatetraenoik, asid 12-hidroksieikosatetraenoik menjadi asid 12,20-dihidroksieikosatetraenoik, dan asid epoksieikosatrienoik menjadi asid 20-hidroksi-epoksieikosatrienoik.
Struktur berkaitan[sunting | sunting sumber]
Dalam protein[sunting | sunting sumber]
Protein manusia dengan domain ini termasuk COQ6, CYP450, MICAL1, MICAL2, MICAL2PV1, MICAL2PV2 dan MICAL3.
Rujukan[sunting | sunting sumber]
- ^ PDB: 2Y6Q; Volkers G, Palm GJ, Weiss MS, Wright GD, Hinrichs W (April 2011). "Structural basis for a new tetracycline resistance mechanism relying on the TetX monooxygenase". FEBS Lett. 585 (7): 1061–6. doi:10.1016/j.febslet.2011.03.012. PMID 21402075. S2CID 26967337.
- ^ Harayama S, Kok M, Neidle EL (1992). "Functional and evolutionary relationships among diverse oxygenases". Annu. Rev. Microbiol. 46: 565–601. doi:10.1146/annurev.mi.46.100192.003025. PMID 1444267.
- ^ Schreuder HA, van Berkel WJ, Eppink MH, Bunthol C (1999). "Phe161 and Arg166 variants of p-hydroxybenzoate hydroxylase. Implications for NADPH recognition and structural stability". FEBS Lett. 443 (3): 251–255. doi:10.1016/S0014-5793(98)01726-8. PMID 10025942. S2CID 21305517.
Pautan luar[sunting | sunting sumber]
 Kategori berkenaan Monooksigenase di Wikimedia Commons
Kategori berkenaan Monooksigenase di Wikimedia Commons
