Kinetik kimia
| Sebahagian daripada siri |
| Kejuruteraan Kimia |
|---|
| Asas |
| Operasi unit |
| Aspek |
|
|
Kinetik kimia, juga dikenali sebagai kinetik tindak balas, ialah kajian kadar proses kimia. Kinetik kimia termasuk siasatan bagaimana keadaan kajian berbeza boleh mempengaruhi kelajuan tindak balas kimia dan menghasilkan maklumat mengenai mekanisme tindak balas dan keadaan peralihan, serta pembinaan model matematik yang dapat menggambarkan ciri-ciri tindak balas kimia.
Sejarah
[sunting | sunting sumber]Pada 1864, Peter Waage dan Cato Guldberg mempelopori pembangunan kinetik kimia dengan merumuskan hukum tindakan jisim, yang menyatakan bahawa kelajuan tindak balas kimia adalah berkadar dengan kuantiti bahan bertindak balas.[1][2][3]
Van 't Hoff mengkaji dinamik kimia dan menerbitkannya pada tahun 1884 sebagai "Etudes de dynamique chimique" yang terkenal.[4] Pada tahun 1901 beliau telah dianugerahkan dengan Hadiah Nobel pertama dalam Kimia "sebagai mengenang jasa luar biasa beliau dalam penemuan hukum-hukum dinamik kimia dan tekanan osmosis dalam larutan".[5] Selepas van 't Hoff, kinetik kimia berurusan dengan penentuan ujikaji bagi kadar tindak balas yang hukum kadar dan pemalar kadar dapat diperolehi. Hukum kadar yang agak mudah wujud untuk tindak balas tertib sifar (yang mana kadar tindak balas adalah bergantung kepada kepekatan), tindak balas tertib pertama, dan tindak balas tertib kedua, dan boleh diterbitkan untuk yang lain. Tindak balas asas mematuhi hukum tindakan jisim, tetapi hukum kadar tindak balas berperingkat harus diperolehi dengan menggabungkan hukum kadar daripada langkah-langkah yang asas, dan boleh menjadi agak rumit. Dalam tindak balas berturut-turut, langkah menentukan kadar sering menentukan kinetik. Dalam tindak balas tertib pertama berturut-turut, anggaran keadaan mantap boleh memudahkan hukum kadar. Tenaga pengaktifan untuk tindak balas adalah ditentukan secara uji kaji melalui persamaan Arrhenius dan persamaan Eyring. Faktor-faktor utama yang mempengaruhi kadar tindak balas termasuk: keadaan fizikal bahan tindak balas, kepekatan bahan tindak balas, suhu pada mana tindak balas berlaku, dan sama ada wujud atau tidak sebarang pemangkin di dalam tindak balas.
Gorban dan Yablonsky telah mencadangkan bahawa sejarah dinamik kimia boleh dibahagikan kepada tiga era.[6] Yang pertama ialah gelombang van 't Hoff mencari hukum am tindak balas kimia dan kinetik yang berkaitan untuk termodinamik. Yang kedua boleh dipanggil gelombang Semenov--Hinshelwood dengan penekanan kepada mekanisme tindak balas, terutama bagi tindak balas rantaian. Ketiga dikaitkan dengan Aris dan penerangan matematik terperinci bagi rangkaian tindak balas kimia.
Faktor yang mempengaruhi kadar tindak balas
[sunting | sunting sumber]Sifat tindak balas
[sunting | sunting sumber]Bergantung kepada apa bahan yang bertindak balas, kadar tindak balas berbeza. Tindak balas asid/bes, pembentukan garam dan pertukaran ion adalah tindak balas yang cepat. Apabila pembentukan ikatan kovalen berlaku antara molekul dan apabila molekul besar terbentuk, tindak balas cenderung untuk menjadi sangat perlahan. Sifat dan kekuatan ikatan dalam tindak balas molekul amat mempengaruhi kadar transformasinya menjadi produk.
Keadaan fizikal
[sunting | sunting sumber]Keadaan fizikal (pepejal, cecair atau gas) bahan tindak balas juga merupakan faktor penting dalam kadar perubahan. Apabila bahan tindak balas berada dalam fasa yang sama, seperti dalam larutan akueus, gerakan haba membawa mereka ke dalam sentuhan. Walau bagaimanapun, apabila mereka berada dalam fasa yang berbeza, tindak balas adalah terhad pada antara muka di antara bahan tindak balas. Tindak balas boleh berlaku hanya pada kawasan yang bersentuhan; dalam keadaan cecair dan gas, pada permukaan cecair. gegaran yang kuat dan kacauan mungkin diperlukan untuk menjadikan tindak balas selesai. Ini bermakna bahawa lebih kecil bahan tindak balas pepejal atau cecair yang lebih besar luas permukaan per unit isipadu dan lebih sentuhan di antara bahan tindak balas yang lain, dengan itu lebih cepat tindak balas. Untuk membuat analogi, sebagai contoh, apabila seseorang menghidupkan api, satu menggunakan serpihan kayu dan dahan kecil – sesiapa tidak segera bermula dengan balak besar. Dalam kimia organik, tindak balas ke atas air adalah pengecualian kepada peraturan bahawa tindak balas homogen berlaku lebih cepat daripada tindak balas heterogen.
Luas permukaan pepejal
[sunting | sunting sumber]Dalam pepejal, hanya zarah yang berada di permukaan sahaja yang boleh terlibat dalam tindak balas. Menghancurkan suatu pepejal kepada bahagian yang lebih kecil bermakna lebih banyak zarah hadir di permukaan, dan kekerapan perlanggaran antara zarah bahan tindak balas bertambah, dan tindak balas berlaku dengan lebih cepat. Sebagai contoh, serbat (serbuk) adalah campuran serbuk yang sangat halus antara asid malic (asid organik yang lemah) dan natrium hidrogen karbonat. Apabila berlaku interaksi dengan air liur di dalam mulut, bahan kimia ini dengan cepat larut dan bertindak balas, melepaskan karbon dioksida dan membekalkan untuk sensasi bergas. Juga, pembekal bunga api mengubah suai kawasan permukaan bahan tindak balas yang kukuh untuk mengawal kadar di mana bahan api dalam bunga api yang dioksidakan, menggunakan ini untuk membuat kesan yang berbeza. Sebagai contoh, aluminium halus ditahan di dalam cengkerang mampu meletup degan ganas. Jika kepingan yang lebih besar daripada aluminium digunakan, tindak balas adalah lebih perlahan dan bunga api dilihat apabila keping logam yang membakar dikeluarkan.
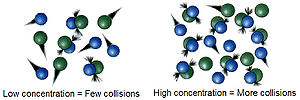
Kepekatan
[sunting | sunting sumber]Tindak balas adalah disebabkan oleh perlanggaran spesies bahan tindak balas. Kekerapan dengan mana molekul atau ion berlanggar bergantung kepada kepekatan mereka. Semakin sesak molekul, semakin besar kemungkinan mereka untuk berlanggar dan bertindak balas dengan satu sama lain. Oleh itu, peningkatan dalam kepekatan bahan tindak balas biasanya akan menyebabkan peningkatan yang sama dalam kadar tindak balas, manakala penurunan dalam kepekatan biasanya akan mempunyai kesan yang terbalik. Sebagai contoh, pembakaran akan berlaku lebih cepat dalam oksigen tulen daripada di udara (21% oksigen).
Persamaan kadar menunjukkan pergantungan terperinci kadar tindak balas pada kepekatan bahan tindak balas dan spesies lain yang hadir. Perbezaan bentuk matematik yang mungkin bergantung kepada tindak balas mekanisme. Persamaan kadar sebenar bagi tindak balas yang diberikan adalah ditentukan secara uji kaji dan menyediakan maklumat mengenai tindak balas mekanisme.
Suhu
[sunting | sunting sumber]kebiasanya suhu mempunyai kesan yang besar ke atas kadar tindak balas kimia. Molekul pada suhu yang lebih tinggi mempunyai lebih banyak tenaga haba. Walaupun kekerapan perlanggaran adalah lebih besar pada suhu yang lebih tinggi, ini hanya menyumbang sebahagian kecil sahaja kepada peningkatan dalam kadar tindak balas. Lebih penting adalah hakikat bahawa kadar molekul bahan tindak balas dengan tenaga yang mencukupi untuk bertindak balas (tenaga lebih besar daripada pengaktifan tenaga: E> Ea) adalah jauh lebih tinggi dan dijelaskan secara terperinci oleh taburan Maxwell-Boltzmann tenaga molekul.
'Peraturan praktikal' bahawa kadar tindak balas kimia dua kali ganda untuk setiap 10 °C kenaikan suhu merupakan salah faham umum. Ini mungkin telah umum dari kes khas sistem biologi, di mana α (pekali suhu) sering antara 1.5 dan 2.5.
Tindak balas kinitek juga boleh dikaji dengan pendekatan suhu melompat. Ini melibatkan menggunakan peningkatan mendadak dalam suhu dan memerhatikan masa kelonggaran penyata itu kembali kepada keseimbangan. Satu bentuk berguna radas suhu melompat adalah tiub kejutan, yang boleh cepat melompat suhu gas dengan lebih daripada 1000 darjah.

pemangkin adalah bahan yang mengubah kadar tindak balas kimia tetapi masih kimia tidak berubah selepas itu. pemangkin meningkatkan kadar tindak balas dengan menyediakan tindak balas mechanisme yang berbeza untuk berlaku dengan tenaga pengaktifan yang lebih rendah. Dalam autocatalysis hasil tindak balas itu adalah dengan sendirinya suatu pemangkin untuk tindak balas yang membawa kepada maklum balas positif. Protein yang bertindak sebagai pemangkin dalam tindak balas biokimia dipanggil enzim. Michaelis-Menten kinetik menggambarkan kadar tindak balas enzim pengantara. pemangkin tidak menjejaskan kedudukan keseimbangan, sebagai pemangkin ianya mempercepatkan tindak balas ke belakang dan ke hadapan sama rata.
Dalam molekul organik tertentu, gantian tertentu boleh mempunyai pengaruh ke atas kadar tindak balas di negara jiran penyertaan kumpulan. [petikan diperlukan]
Tekanan
[sunting | sunting sumber]Peningkatan tekanan dalam satu tindak balas gas akan meningkatkan bilangan perlanggaran antara bahan tindak balas, meningkatkan kadar tindak balas. Ini kerana aktiviti gas adalah berkadar terus dengan tekanan separa gas. Ini adalah sama dengan kesan meningkatkan kepekatan penyelesaian.
Selain kesan besar-tindakan mudah ini, kadar pekali boleh berubah disebabkan oleh tekanan. Pekali kadar dan produk banyak tindak balas fasa gas bersuhu yang tinggi akan berubah jika gas lengai ditambah kepada campuran; variasi pada kesan ini dipanggil jatuhan dan pengaktifan kimia. Fenomena ini adalah disebabkan tindak balas eksotermik atau endotermik berlaku lebih cepat daripada pemindahan haba, menyebabkan molekul bertindak balas untuk mempunyai taburan tenaga bukan haba (pengedaran bukan Boltzmann). Peningkatan tekanan meningkatkan kadar pemindahan haba antara molekul yang bertindak balas dan seluruh sistem, mengurangkan kesan ini.
pekali kadar pekat fasa juga boleh terjejas oleh tekanan (sangat tinggi); ini adalah kesan yang sama sekali berbeza berbanding jatuhan atau pengaktifan kimia. Ia sering dikaji dengan menggunakan andas berlian.
Tindak balas kinetik juga boleh dikaji dengan pendekatan lompatan tekanan. Ini membuatkan perubahan cepat dalam tekanan dan memerhatikan masa santaian kepada keseimbangan.
Rujukan
[sunting | sunting sumber]- ^ C.M. Guldberg and P. Waage,"Studies Concerning Affinity" C. M. Forhandlinger: Videnskabs-Selskabet i Christiana (1864), 35
- ^ P. Waage, "Experiments for Determining the Affinity Law" ,Forhandlinger i Videnskabs-Selskabet i Christiania, (1864) 92.
- ^ C.M. Guldberg, "Concerning the Laws of Chemical Affinity", C. M. Forhandlinger i Videnskabs-Selskabet i Christiania (1864) 111
- ^ Hoff, J. H. van't (Jacobus Henricus van't); Cohen, Ernst; Ewan, Thomas (1896-01-01). Studies in chemical dynamics. Amsterdam : F. Muller ; London : Williams & Norgate.
- ^ The Nobel Prize in Chemistry 1901, Nobel Prizes and Laureates, official website.
- ^ A.N. Gorban, G.S. Yablonsky Three Waves of Chemical Dynamics, Mathematical Modelling of Natural Phenomena 10(5) (2015), p. 1–5.
