Pengangkut ion
Dalam biologi, pengangkut ialah protein transmembran yang menggerakkan ion (atau molekul kecil lain) merentasi membran biologi untuk mencapai banyak fungsi biologi yang berbeza, termasuk komunikasi sel, mengekalkan homeostasis, pengeluaran tenaga, dll.[1] Terdapat pelbagai jenis pengangkut termasuk pam, uniporter, antiporter, dan simporter. Pengangkut aktif atau pam ion ialah pengangkut yang menukar tenaga daripada pelbagai sumber—termasuk adenosina trifosfat (ATP), cahaya matahari dan tindak balas redoks lain—kepada tenaga berpotensi dengan mengepam ion ke atas kecerunan kepekatannya.[2] Tenaga berpotensi ini kemudiannya boleh digunakan oleh pengangkut sekunder, termasuk pembawa ion dan saluran ion, untuk memacu proses sel yang penting seperti sintesis ATP.[3]
Halaman ini tertumpu terutamanya pada pengangkut ion yang bertindak sebagai pam, tetapi pengangkut juga boleh berfungsi untuk menggerakkan molekul melalui resapan berbantu. Resapan berbantu tidak memerlukan ATP dan membenarkan molekul yang tidak dapat meresap dengan cepat merentasi membran (resapan pasif) meresap ke bawah kecerunan kepekatannya melalui pengangkut protein ini.[4]
Pengangkut ion adalah penting untuk fungsi sel yang betul, dan oleh itu ia sangat dikawal oleh sel, dan dikaji oleh penyelidik menggunakan pelbagai kaedah. Beberapa contoh peraturan sel dan kaedah penyelidikan akan diberikan.
Pengelasan dan nyahkekaburan[sunting | sunting sumber]
Pengangkut ion dikelaskan sebagai superkeluarga pengangkut yang mengandungi 12 keluarga pengangkut.[5] Keluarga ini adalah sebahagian daripada sistem Klasifikasi Pengangkutan (TC) yang digunakan oleh Kesatuan Biokimia dan Biologi Molekul Antarabangsa (IUBMB), dan dikelaskan mengikut ciri-ciri seperti substrat yang diangkut, mekanisme pengangkutan, sumber tenaga yang digunakan, dan perbandingan jujukan DNA yang membentuk setiap protein. Faktor penyatuan yang paling penting ialah sifat bercas substrat yang menunjukkan pengangkutan ion dan bukan spesies neutral.[5] Pengangkut ion berbeza dengan ketara daripada saluran ion. Saluran ialah liang yang mengalir melalui membran, manakala pengangkut ialah protein yang mesti berubah bentuk untuk menukar sisi membran yang mana ia terbuka, kerana pengangkut ini jauh lebih perlahan dalam menggerakkan molekul daripada saluran.
Kecerunan elektrokimia atau kepekatan ialah perbezaan kepekatan molekul atau ion kimia dalam dua kawasan yang berasingan.[6] Dalam keadaan keseimbangan, kepekatan ion di kedua-dua kawasan akan sama, jadi jika terdapat perbezaan kepekatan, ion akan berusaha untuk mengalir "menuruni" kecerunan kepekatan atau dari kepekatan tinggi ke rendah. Saluran ion membenarkan ion khusus yang sesuai dengan saluran mengalir ke bawah kecerunan kepekatannya, menyamakan kepekatan pada kedua-dua belah membran sel. Saluran ion dan pengangkut ion mencapainya melalui resapan berbantu, sejenis pengangkutan pasif. Walau bagaimanapun, hanya pengangkut ion yang boleh melakukan pengangkutan aktif, yang melibatkan ion bergerak melawan kecerunan kepekatannya.[7] Dengan sumber tenaga seperti ATP, pengangkut ion dapat menggerakkan ion melawan kecerunan kepekatannya yang kemudiannya boleh digunakan oleh pengangkut sekunder atau protein lain sebagai sumber tenaga.[6]
Sumber tenaga[sunting | sunting sumber]
Pengangkut utama[sunting | sunting sumber]

Pengangkut utama menggunakan tenaga untuk mengangkut ion seperti Na+, K+, dan Ca2+ merentasi membran sel dan boleh mencipta kecerunan kepekatan.[6] Pengangkutan ini boleh menggunakan ATP sebagai sumber tenaga atau ia boleh digunakan untuk menjana ATP melalui kaedah seperti rantai pengangkutan elektron dalam tumbuhan.[7][6]
Pengangkut aktif[sunting | sunting sumber]
Pengangkut yang menggunakan ATP menukarkan tenaga dalam ATP kepada tenaga berpotensi dalam bentuk kecerunan kepekatan. Ia menggunakan ATP untuk mengangkut ion dari kepekatan rendah ke kepekatan yang lebih tinggi. Contoh protein yang menggunakan ATP ialah ATPase jenis P yang memindahkan ion Na+, K+, dan Ca2+ melalui pemfosforilan, ATPase jenis A yang memindahkan anion, dan pengangkut ABC (pengangkut kaset pengikat ATP) yang mengangkut aneka molekul yang meluas.[6] Contoh-contoh ATPase jenis-P termasuk Na+/K+-ATPase[7][8][9] yang dikawal oleh Janus Kinase-2[10] serta Ca2+ ATPase yang mempamerkan kepekaan terhadap kepekatan ADP dan ATP.[3] P-glikoprotein ialah contoh protein pengikat pengangkutan ABC dalam badan manusia.
Pengangkut penghasil ATP[sunting | sunting sumber]
Pengangkut penghasil ATP berfungsi dalam gaya bertentangan dengan pengguna ATP. Protein ini mengangkut ion dari kepekatan tinggi ke rendah dengan kecerunan, tetapi membentuk ATP dalam proses ini. Tenaga potensi dalam bentuk kecerunan kepekatan digunakan untuk menjana ATP.[6] Dalam haiwan, sintesis ATP ini wujud dalam mitokondrion sebagai ATPase jenis F atau dikenali sebagai ATP sintase. Proses ini menggunakan rantaian pengangkutan elektron dalam proses yang dipanggil fosforilasi oksidatif .[11][2] ATPase jenis V menjalankan fungsi yang bertentangan sebagai ATPase jenis F dan digunakan dalam tumbuhan untuk menghidrolisis ATP untuk mencipta kecerunan proton. Contohnya ialah lisosom yang menggunakan ATPase jenis V mengasidkan vesikel atau vakuol tumbuhan semasa proses fotosintesis dalam kloroplas.[7] Proses ini boleh dikawal melalui pelbagai kaedah seperti pH.[12]
Pengangkut sekunder[sunting | sunting sumber]

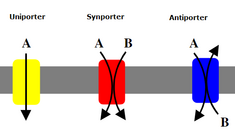
Pengangkut sekunder juga mengangkut ion (atau molekul kecil) melawan kecerunan kepekatan - dari kepekatan rendah ke kepekatan tinggi - tetapi tidak seperti pengangkut primer yang menggunakan ATP untuk mencipta kecerunan kepekatan, pengangkut sekunder menggunakan tenaga potensi daripada kecerunan kepekatan yang dicipta oleh pengangkut primer untuk mengangkut ion.[6] Sebagai contoh, pengangkut glukosa bergantungan natrium yang terdapat dalam usus kecil dan buah pinggang menggunakan kecerunan natrium yang dicipta dalam sel oleh pam natrium-kalium (seperti yang dinyatakan di atas) untuk membantu membawa glukosa ke dalam sel.[13] Ini berlaku apabila natrium mengalir ke bawah kecerunan kepekatannya yang menyediakan tenaga yang mencukupi untuk menolak glukosa ke atas kecerunan kepekatannya kembali ke dalam sel. Ini penting dalam usus kecil dan buah pinggang untuk mengelakkan mereka daripada kehilangan glukosa. Simporter seperti simporter natrium-glukosa mengangkut ion dengan kecerunan kepekatannya, dan mereka menggandingkan pengangkutan molekul kedua ke arah yang sama. Antiporter juga menggunakan kecerunan kepekatan satu molekul untuk menggerakkan satu lagi ke atas kecerunan kepekatannya tetapi molekul yang berganding diangkut ke arah yang bertentangan.[6]
Kawal atur[sunting | sunting sumber]
Pengangkut ion boleh dikawal dalam pelbagai cara yang berbeza seperti pemfosforilan, perencatan atau pengaktifan alosterik, dan kepekaan terhadap kepekatan ion. Pengunaan kinase protein untuk menambah kumpulan fosfat atau fosfatase untuk menyahfosforilasi protein boleh mengubah aktiviti pengangkut.[14] Sama ada protein diaktifkan atau dihalang dengan penambahan kumpulan fosfat bergantung kepada protein tertentu. Dengan perencatan alosterik, ligan kawal atur boleh mengikat ke dalam tapak kawal atur, dan sama ada menghalang atau mengaktifkan pengangkut. Pengangkut ion juga boleh dikawal oleh kepekatan ion (tidak semestinya ion yang dipindahkan) dalam larutan. Sebagai contoh, rantai pengangkutan elektron dikawal oleh kehadiran ion H+ (pH) dalam larutan.[6]
Teknik penyelidikan pengangkut ion[sunting | sunting sumber]
Pengapit tampalan[sunting | sunting sumber]
Pengapit tampalan ialah teknik elektrofisiologi yang digunakan untuk mengkaji saluran dan pengangkut dalam sel dengan menjejaki arus yang mengalir melaluinya. Teknik ini telah disempurnakan oleh Hodgkin dan Huxley sebelum kewujudan saluran dan pengangkut diketahui.[11][15] Selain daripada kerja-kerja terobosan awal, legasi pengapit tampalan berterusan, dan masih biasa digunakan oleh penyelidik untuk mengkaji pengangkut ion dan cara persekitaran dan ligan mempengaruhi fungsi pengangkut.[1][16]
Kristalografi sinar-X[sunting | sunting sumber]
Kristalografi sinar-X ialah alat yang membolehkan struktur protein divisualisasikan, namun, ia hanyalah gambaran satu konformasi protein. Struktur protein pengangkutan membolehkan penyelidik memahami lebih lanjut bagaimana dan apa yang dilakukan oleh pengangkut untuk menggerakkan molekul merentasi membran.[17][18]
Pemulihan pendarfluor selepas pelunturan foto[sunting | sunting sumber]
Pemulihan pendarfluor selepas pelunturan foto (FRAP) ialah teknik yang digunakan untuk mengesan resapan lipid atau protein dalam membran. Teknik ini digunakan untuk lebih memahami mobiliti pengangkut dalam sel dan interaksinya dengan domain lipid dan rakit lipid dalam membran sel.
Pemindahan tenaga resonans Förster[sunting | sunting sumber]
Pemindahan tenaga resonans Förster (FRET) ialah teknik yang menggunakan pendarfluor untuk mengesan jarak dua protein antara satu sama lain. Ini telah digunakan dalam mengkaji pengangkut untuk melihat bagaimana mereka berinteraksi dengan protein sel lain.[1]
Rujukan[sunting | sunting sumber]
- ^ a b c "Modeling and simulation of ion channels". Chemical Reviews. 112 (12): 6250–84. December 2012. doi:10.1021/cr3002609. PMC 3633640. PMID 23035940.
- ^ a b Purves D, Augustine GJ, Fitzpatrick D, Katz LC, LaMantia AS, McNamara JO, Williams SM, penyunting (2001). "Channels and Transporters". Neuroscience (ed. 2nd). Sunderland, Mass.: Sinauer Associates. ISBN 0-87893-742-0.
- ^ a b "Mitochondrial free [Ca2+] increases during ATP/ADP antiport and ADP phosphorylation: exploration of mechanisms". Biophysical Journal. 99 (4): 997–1006. August 2010. Bibcode:2010BpJ....99..997H. doi:10.1016/j.bpj.2010.04.069. PMC 2920628. PMID 20712982.
- ^ "Ion channels versus ion pumps: the principal difference, in principle". Nature Reviews. Molecular Cell Biology. 10 (5): 344–52. May 2009. doi:10.1038/nrm2668. PMC 2742554. PMID 19339978.
- ^ a b "The ion transporter superfamily". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1618 (1): 79–92. December 2003. doi:10.1016/j.bbamem.2003.10.010. PMID 14643936.
- ^ a b c d e f g h i Voet D, Voet VG, Pratt CW (2016-02-29). Fundamentals of biochemistry : life at the molecular level. ISBN 9781118918401. OCLC 910538334.
- ^ a b c d "Ion transport". AccessScience. 2014-01-01. doi:10.1036/1097-8542.352000.
- ^ "A structural overview of the plasma membrane Na+,K+-ATPase and H+-ATPase ion pumps". Nature Reviews. Molecular Cell Biology. 12 (1): 60–70. January 2011. doi:10.1038/nrm3031. PMID 21179061.
- ^ "Visualizing the mapped ion pathway through the Na,K-ATPase pump". Channels. 3 (6): 383–6. November 2009. doi:10.4161/chan.3.6.9775. PMC 2889157. PMID 19806033.
- ^ "Down-regulation of the epithelial Na⁺ channel ENaC by Janus kinase 2". The Journal of Membrane Biology. 247 (4): 331–8. April 2014. doi:10.1007/s00232-014-9636-1. PMID 24562791.
- ^ a b "The discovery of oxidative phosphorylation: a conceptual off-shoot from the study of glycolysis". Studies in History and Philosophy of Biological and Biomedical Sciences. 41 (3): 253–62. September 2010. doi:10.1016/j.shpsc.2010.07.014. PMID 20934646.
- ^ "pH-dependent regulation of electron transport and ATP synthesis in chloroplasts". Photosynthesis Research. 116 (2–3): 511–34. October 2013. doi:10.1007/s11120-013-9845-y. PMID 23695653.
- ^ "Studies on the mechanism of the intestinal absorption of sugars. X. An effect of Na+ concentration on the apparent Michaelis constants for intestinal sugar transport, in vitro". Biochimica et Biophysica Acta. 109 (2): 467–77. November 1965. doi:10.1016/0926-6585(65)90172-x. PMID 5867548.
- ^ "CFTR Cl- channel functional regulation by phosphorylation of focal adhesion kinase at tyrosine 407 in osmosensitive ion transporting mitochondria rich cells of euryhaline killifish". The Journal of Experimental Biology. 212 (Pt 15): 2365–77. August 2009. doi:10.1242/jeb.030015. PMC 2712415. PMID 19617429.
- ^ "Hodgkin and Huxley and the basis for electrical signalling: a remarkable legacy still going strong". The Journal of Physiology. 590 (11): 2569–70. June 2012. doi:10.1113/jphysiol.2012.233411. PMC 3424715. PMID 22787169.
- ^ "α-Synuclein stimulates a dopamine transporter-dependent chloride current and modulates the activity of the transporter". The Journal of Biological Chemistry. 286 (51): 43933–43. December 2011. doi:10.1074/jbc.M111.241232. PMC 3243541. PMID 21990355.
- ^ "Crystal structure of the sodium-potassium pump". Nature. 450 (7172): 1043–9. December 2007. Bibcode:2007Natur.450.1043M. doi:10.1038/nature06419. PMID 18075585. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Crystal structure of the sodium-potassium pump at 2.4 A resolution". Nature. 459 (7245): 446–50. May 2009. Bibcode:2009Natur.459..446S. doi:10.1038/nature07939. PMID 19458722.
Pautan luar[sunting | sunting sumber]
- Ion+pumps dalam Tajuk Subjek Perubatan (MeSH) di Perpustakaan Perubatan Negara AS D12.776.157.530.450; D12.776.543.585.450
- The Transporter substrate database (TSdb)
