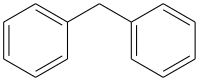
Difenilmetana
| |

| |
| Nama | |
|---|---|
| Nama IUPAC pilihan
1,1′-Metilenadibenzena[1] | |
| Nama lain
Difenilmetana
Benzilbenzena | |
| Pengecam | |
Imej model 3D Jmol
|
|
| Singkatan | BnPh, Ph2CH2 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.002.708 |
| MeSH | Diphenylmethane |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C13H12 | |
| Jisim molar | 168.234 |
| Rupa bentuk | Minyak tak berwarna |
| Ketumpatan | 1.006 g/mL |
| Takat lebur | 22 hingga 24 °C (72 hingga 75 °F; 295 hingga 297 K) |
| Takat didih | 264 °C (507 °F; 537 K) |
| 14 mg/L | |
| Keasidan (pKa) | 33 |
| -115.7·10−6 cm3/mol | |
| Bahaya | |
| Bahaya-bahaya utama | Mudah terbakar |
| Takat kilat | > 110 °C; 230 °F; 383 K |
| Sebatian berkaitan | |
Sebatian berkaitan
|
Difenilmetanol |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| | |
| Rujukan kotak info | |
Difenilmetana ialah sebuah sebatian organik dengan formula (C6H5)2CH2 (sering disingkat CH2Ph2). Sebatian ini terdiri daripada metana di mana dua atom hidrogen digantikan oleh dua kumpulan fenil. Ia adalah sifat sebagai sebuah pepejal bewarna putih.
Difenilmetana ialah rangka biasa dalam kimia organik. Kumpulan difenilmetil juga dikenali sebagai benzhidril.
Sintesis[sunting | sunting sumber]
Difenilmetana boleh disintesis melalui alkilasi Friedel–Crafts bagi benzil klorida dengan benzena dengan kehadiran asid Lewis seperti aluminium klorida:[2]
- C6H5CH2Cl + C6H6 → (C6H5)2CH2 + HCl
Kereaktifan ikatan CH[sunting | sunting sumber]
Kumpulan metilena dalam difenilmetana adalah sedikit berasid dengan nilai pKa pada 32.2, dan boleh dinyahprotonasi dengan natrium amida.[3]
- (C6H5)2CH2 + NH2− → (C6H5)2CH− + NH3
Karbanion yang terhasil boleh dialkilasi. Sebagai contoh, rawatan dengan n-bromobutana boleh menghasilkan 1,1-difenilpentana dengan hasil sebanyak 92% asli.[4]
- (C6H5)2CH− + CH3CH2CH2CH2Br → (C6H5)2CHCH2CH2CH2CH3 + Br−
Alkilasi pelbagai sebatian benzhydryl telah ditunjukkan menggunakan alkil halida yang sepadan, kedua-dua primer (benzil klorida, β-feniletil klorida, dan n-oktil bromida) dan sekunder (benzidril klorida, α-feniletil klorida, dan isopropil klorida di antara dalam) dengan hasil setinggi 86% dan 99% asli.[3][4]
Keasidan kumpulan metilena dalam difenilmetana adalah disebabkan oleh kelemahan ikatan (C6H5)2CH–H, yang mempunyai tenaga pemisahan ikatan 82 kcal mol− 1 (340 kJ mol− 1).[5] Ini jauh di bawah tenaga pemisahan ikatan yang diterbitkan untuk ikatan C–H yang setanding dalam propana, dengan BDE((CH3)2CH–H)=98.6 kcal mol− 1, dan toluena, dengan BDE(C6H5CH2–H)=89.7 kcal mol− 1.[6][7]
Lihat juga[sunting | sunting sumber]
- Toluena, juga metilbenzena atau fenilmetana
Rujukan[sunting | sunting sumber]
- ^ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. m/s. 452. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ W. W. Hartman and Ross Phillips (1934). "Diphenylmethane". Organic Syntheses. 14: 34. doi:10.15227/orgsyn.014.0034.
- ^ a b Hauser, Charles R.; Hamrick, Phillip J. (1957). "Alkylation of Diphenylmethane with Alkyl Halides by Sodium Amide. Substitution versus β-Elimination. Relative Acidities of Diphenylmethane and Ammonia". J. Am. Chem. Soc. 79 (12): 3142–3145. doi:10.1021/ja01569a041.
- ^ a b Murphy, William S.; Hamrick, Phillip J.; Hauser, Charles R. (1968). "1,1-Diphenylpentane". Organic Syntheses. 48: 80. doi:10.15227/orgsyn.048.0080.
- ^ Zhang, Xian-Man; Bordwell, Frederick G. (1992). "Homolytic bond dissociation energies of the benzylic carbon-hydrogen bonds in radical anions and radical cations derived from fluorenes, triphenylmethanes, and related compounds". J. Am. Chem. Soc. 114 (25): 9787–9792. doi:10.1021/ja00051a010.
- ^ Blanksby, S. J.; Ellison, G. B. (2003). "Bond Dissociation Energies of Organic Molecules". Accounts of Chemical Research. 36 (4): 255–263. doi:10.1021/ar020230d. PMID 12693923.
- ^ Streitwieser, Andrew; Bergman, Robert G. (2018). "Table of Bond Dissociation Energies". University of California, Berkeley. Dicapai pada December 30, 2021.
