Imida

Dalam kimia organik, imida ialah kumpulan berfungsi yang terdiri daripada dua kumpulan asil yang terikat kepada nitrogen.[1] Sebatian ini secara struktur berkaitan dengan anhidrida asid, walaupun imida mempunyai ketahanan yang lebih tinggi terhadap hidrolisis. Dari segi aplikasi komersial, imida paling dikenali sebagai komponen polimer berkekuatan tinggi, dipanggil polimida. Imida tak organik juga dikenali sebagai keadaan pepejal atau sebatian gas, dan kumpulan imido (=NH) juga boleh bertindak sebagai ligan.
Nomenklatur[sunting | sunting sumber]
Kebanyakan imida adalah sebatian kitaran yang berasal daripada asid dikarboksilik, dan nama mereka mencerminkan asid induk.[2] Contohnya ialah suksinimida, berasal daripada asid suksinik, dan ftalimida, berasal daripada asid ftalik. Untuk imida yang diperoleh daripada amina (berbanding dengan ammonia), bahagian N ditunjukkan dengan awalan. Sebagai contoh, N-etilsuksinimida berasal daripada asid suksinik dan etilamina. Isoimida adalah isomer dengan imida biasa dan mempunyai formula RC(O)OC(NR′)R″. Ia selalunya merupakan perantaraan yang bertukar kepada imida yang lebih simetri. Terdapat sebuah sebatian organik yang dipanggil karbodiimida yang mempunyai formula RN=C=NR. Walau bagaimanapun, jenis sebatian ini tidak berkaitan dengan imida.
Imida daripada asid dikarboksilik[sunting | sunting sumber]
Pautan PubChem memberikan akses kepada lebih banyak maklumat tentang sebatian, termasuk nama lain, id, ketoksikan dan keselamatan.
| n | Nama lazim | Nama sistematik | Struktur | PubChem | Asid induk | Struktur |
|---|---|---|---|---|---|---|
| 2 | Suksinimida | Pirolidina-2,5-diona | 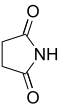
|
11439 | Asid suksinik | 
|
| 2, tak tepu, ikatan ganda dua cis karbon-karbon | Maleimida | Pirol-2,5-diona | 
|
10935 | Asid maleik | |
| 3 | Glutarimida | Piperidina-2,6-diona | 
|
70726 | Asid glutarik | |
| 6 | Ftalimide | Isoindol-1,3-diona | 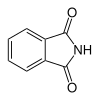
|
6809 | Asid ftalik | 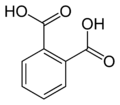
|
Pencirian[sunting | sunting sumber]
Imida bersifat sangat polar, maka ia mempunyai keterlarutan yang baik dalam media polar. Pusat N–H untuk imida yang diperoleh daripada ammonia adalah berasid dan boleh mengambil bahagian dalam ikatan hidrogen. Tidak seperti anhidrida asid yang berkaitan dengan struktur, ia menentang hidrolisis dan ada juga yang boleh dihablurkan semula daripada air mendidih.
Penemuan dan aplikasi[sunting | sunting sumber]
Banyak polimer berkekuatan tinggi atau konduktif elektrik mengandungi subunit imida, iaitu polimida. Satu contoh ialah Kapton, di mana unit ulangan terdiri daripada dua kumpulan imida yang diperoleh daripada asid tetrakarboksilik aromatik. Satu lagi contoh polimida ialah poliglutarimida yang biasanya dibuat daripada polimetilmetakrilat (PMMA) dan ammonia atau amina primer melalui aminolisis dan kitaran PMMA pada suhu dan tekanan tinggi, biasanya dalam penyemperit. Teknik ini dipanggil penyemperitan reaktif. Produk polyglutarimide komersial berasaskan derivatif metilamin PMMA, dipanggil Kamax, telah dihasilkan oleh syarikat Rohm dan Haas. Keliatan bahan ini mencerminkan betapa kuatnya kumpulan berfungsi imida.
Minat terhadap bioaktiviti sebatian yang mengandungi imida telah dicetuskan oleh penemuan awal bioaktiviti tinggi sikloheksimida sebagai perencat biosintesis protein dalam organisma tertentu. Talidomida, terkenal dengan kesan buruknya, adalah salah satu hasil penyelidikan ini. Sebilangan racun kulat dan racun herba mengandungi fungsi imida. Contohnya termasuk Captan, yang dianggap karsinogenik dalam beberapa keadaan, dan Procymidone.

Pada abad ke-21, minat baru telah timbul dalam kesan imunomodulator talidomida, membawa kepada penemuan dan pengkelasan kelas imunomodulator yang dikenali sebagai ubat imida imunomodulator (IMiDs).
Penyediaan[sunting | sunting sumber]
Kebanyakan imida biasa disediakan dengan memanaskan asid dikarboksilik atau anhidrida dan ammonia atau amina primernya. Hasilnya ialah tindak balas pemeluwapan seperti berikut:
- (RCO)2O + R′NH2 → (RCO)2NR′ + H2O
Tindak balas ini diteruskan melalui perantaraan amida. Tindak balas intramolekul asid karboksilik dengan amida jauh lebih cepat daripada tindak balas antara molekul, yang jarang diperhatikan.
Ia juga boleh dihasilkan melalui pengoksidaan amida, terutamanya apabila bermula daripada laktam.[3]
- R(CO)NHCH2R' + 2 [O] → R(CO)N(CO)R' + H2O
Imida tertentu juga boleh disediakan dalam penyusunan semula mumm dalam susunan isoimida-kepada-imida.
Tindak balas[sunting | sunting sumber]
Bagi imida yang diperoleh daripada ammonia, pusat N–H adalah asid yang lemah. Oleh itu, garam logam alkali imida boleh disediakan oleh bes konvensional seperti kalium hidroksida. Asas konjugat phthalimide ialah kalium phthalimide. Anion ini boleh melalui proses alkilasi untuk memberikan N-alkylimide, yang seterusnya boleh didegradasi untuk membebaskan amina primer. Nukleofil yang kuat, seperti kalium hidroksida atau hidrazin boleh digunakan dalam langkah pelepasan.
Rawatan imida dengan halogen dan bes memberikan terbitan N -halo. Contoh yang berguna dalam sintesis organik ialah N-klorosuksinimida dan N-bromosuksinimida, yang masing-masing berfungsi sebagai sumber klorida (Cl+) dan bromida (Br+) dalam sintesis organik.
Imida dalam kimia koordinasi[sunting | sunting sumber]
Dalam kimia koordinasi kompleks imido logam peralihan mempunyai ligan NR2-. Mereka serupa dengan ligan okso dalam beberapa aspek. Dalam sesetengah sudut MNC ialah 180º tetapi selalunya sudut itu dibengkokkan dengan jelas. Induk imida (NH2-) ialah perantaraan dalam penetapan nitrogen oleh pemangkin sintetik.[4]

Rujukan[sunting | sunting sumber]
- ^ "Imides". IUPAC Compendium of Chemical Terminology. 2009. doi:10.1351/goldbook.I02948. ISBN 978-0-9678550-9-7.
- ^ Martynov, A. V. (2005-12-06). "New Approach to the Synthesis of trans-Aconitic Acid Imides". ChemInform (dalam bahasa Inggeris). 36 (49): no. doi:10.1002/chin.200549068. ISSN 1522-2667.
- ^ Sperry, Jonathan (27 September 2011). "The Oxidation of Amides to Imides: A Powerful Synthetic Transformation". Synthesis. 2011 (22): 3569–3580. doi:10.1055/s-0030-1260237.
- ^ Nugent, W. A.; Mayer, J. M., "Metal-Ligand Multiple Bonds," J. Wiley: New York, 1988.
Pautan luar[sunting | sunting sumber]
Lihat juga[sunting | sunting sumber]
- imida bukan organik
