Asid amino: Perbezaan antara semakan
Teg-teg: Suntingan mudah alih Suntingan web mudah alih |
|||
| Baris 3: | Baris 3: | ||
==Sejarah== |
==Sejarah== |
||
Asid amino mula dikenal pasti sejak awal abad ke-19. Pada 1806, ahli kimia Perancis Louis-Nicolas Vauquelin dan Pierre Jean Robiquet berjaya mengasingkan sebatian |
Asid amino mula dikenal pasti sejak awal abad ke-19. Pada 1806, ahli kimia Perancis Louis-Nicolas Vauquelin dan Pierre Jean Robiquet berjaya mengasingkan sejenis sebatian bernama [[asparagina]] (dinamakan sedemikian kerana kaedah pemerolehannya daripada [[asparagus]]) yang merupakan asid amino pertama yang dikenal pasti.<ref>{{Cite journal|title=The discovery of a new plant principle in Asparagus sativus |author=Vauquelin LN, Robiquet PJ |journal=Annales de Chimie |year=1806 |volume=57 |pages=88–93}}</ref><ref name=Anfinsen>{{Cite book|title=Advances in Protein Chemistry |author=Anfinsen CB, Edsall JT, Richards FM |year=1972 |pages=99, 103 |publisher=Academic Press |location=New York |isbn=978-0-12-034226-6}}</ref> |
||
==Struktur umum== |
==Struktur umum== |
||
Semakan pada 09:54, 14 Oktober 2017
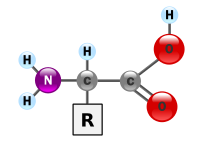
Asid amino merupakan sebatian organik biologi yang terdiri mempunyai kumpulan berfungsi amina (-NH2) dan asid karboksilik (-COOH), dengan rantai sisi yang khusus untuk setiap asid amino. Unsur-unsur utama asid amino ialah karbon, hidrogen, oksigen, dan nitrogen, walaupun unsur lain wujud dalam rantai sisinya. Terdapat lebih daripada 500 jenis amino asid yang telah dikenal pasti[1] yang boleh diklasifikasikan dalam pelbagai cara. Asid amino boleh dikategorikan mengikut teras kumpulan berfungsinya, sebagai contoh, asid amino alfa-(α), beta-(β), gamma-(γ) atau delta-(δ); kategori lain adalah berdasarkan kekutuban, tahap pH atau kumpulan rantai sisinya (alifatik, acyclic, aromatik yang mengandungi hidroksil atau sulfur dan lain-lain). Dalam bentuk protein, asid amino merupakan komponen yang kedua terbesar (air merupakan yang terbesar) dalam struktur otot manusia, sel dan tisu.[2] Selain protein, asid amino penting dalam proses pengangkutan neurotransmitter dan biosintesis.
Sejarah
Asid amino mula dikenal pasti sejak awal abad ke-19. Pada 1806, ahli kimia Perancis Louis-Nicolas Vauquelin dan Pierre Jean Robiquet berjaya mengasingkan sejenis sebatian bernama asparagina (dinamakan sedemikian kerana kaedah pemerolehannya daripada asparagus) yang merupakan asid amino pertama yang dikenal pasti.[3][4]
Struktur umum

Berdasarkan struktur generik asid amino, R merujuk kepada kumpulan berfungsi khusus untuk setiap asid amino. Zarah karbon bersebelahan dengan kumpulan karboksil dikenali sebagai karbon-α dan asid amino dengan rantai sisi terikat dengan karbon ini dirujuk sebagai asid amino alpha. Asid amino jenis ini merupakan bentuk yang paling umum dalan alam semula jadi. Dalam asid amino alpha, karbon-α merupakan zarah kiral, kecuali untuk glisina.[5] Manakala untuk asid amino yang mempunyai zarah karbon terikat dengan karbon-α (seperti lisina, rajah di sebelah kanan) zarah karbon dilabel dalam urutan α, β, γ, δ dan seterusnya.[6] Dalam sesetengah asid amino, kumpulan amina terikat dengan karbon-β atau γ, yang dikenali sebagai asid amino beta atau gamma.
Asid amino kebiasaannya diklasifikasikan mengikut ciri-ciri kimia kumpulan berfungsi yang dikategorikan dalam empat kumpulan. Kumpulan berfungsi tersebut mampu mengubah sifat amino asid untuk menjadi asid lemah, bes lemah, hidrofili (sekiranya kumpulan berfungsi tersebut polar) atau hidrofobia (sekiranya kumpulan berfungsi tersebut bukan polar). [5]
Isomerisme

Asid amino alfa kebiasannya dijumpai dalam alam semula jadi, tetapi hanya dalam L-isomer. Semua karbon alfa merupakan atom kiral karbon, kecuali gliserin yang mempunyai dua atom hidrogen pada karbon alfa.[5] Oleh itu, semua asid amino alfa kecuali gliserin wujud dalam bentuk dua enantiomer yang mempunyai imej cermin dan dikenali sebagai asid amino L atau D.
Rantai sisi
Asid amino kebiasaannya diklasifikasikan berdasarkan ciri-ciri fizikal rantai sisi yang dikategorikan dalam empat kumpulan.[5]
- tidak polar dan neutral
- polar dan neutral
- asid dan polar
- berbes dan polar
Rantai sisi asid amino menentukan sama ada asid amino tersebut bersifat hidrofil (rantai sisi polar) atau hidrofob (rantai sisi tidak polar).

Karbon dalam asid amino yang mempunyai rantai karbon terikat dengan karbon-α (seperti lisine) dilabelkan dalam urutan α, β, γ, δ dan selanjutnya. [7] Dalam sesetengah asid amino, kumpulan amina terikat dengan karbon β atau γ dan dikenali sebagain asid amino beta atau gamma.
Rujukan
- ^ Wagner, Ingrid; Musso, Hans (November 1983). "New Naturally Occurring Amino Acids". Angew. Chem. Int. Ed. Engl. 22 (22): 816–828. doi:10.1002/anie.198308161.
- ^ Human nutrition in the developing world – United Nations Food and Agriculture Organization, ch.8
- ^ Vauquelin LN, Robiquet PJ (1806). "The discovery of a new plant principle in Asparagus sativus". Annales de Chimie. 57: 88–93.
- ^ Anfinsen CB, Edsall JT, Richards FM (1972). Advances in Protein Chemistry. New York: Academic Press. m/s. 99, 103. ISBN 978-0-12-034226-6.CS1 maint: multiple names: authors list (link)
- ^ a b c d Creighton, Thomas H. (1993). "Chapter 1". Proteins: structures and molecular properties. San Francisco: W. H. Freeman. ISBN 978-0-7167-7030-5. Ralat petik: Tag
<ref>tidak sah, nama "Creighton" digunakan secara berulang dengan kandungan yang berbeza - ^ "Nomenclature and Symbolism for Amino Acids and Peptides". IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. Diarkibkan daripada yang asal pada 9 October 2008. Dicapai pada 17 November 2008. Unknown parameter
|deadurl=ignored (bantuan) - ^ "Nomenclature and Symbolism for Amino Acids and Peptides". IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. Diarkibkan daripada yang asal pada 9 October 2008. Dicapai pada 17 November 2008. Unknown parameter
|deadurl=ignored (bantuan)
