Kinase

Dalam biokimia, kinase ialah sejenis enzim yang memangkinkan pemindahan kumpulan fosfat daripada molekul fosfat bertenaga tinggi kepada substrat tertentu. Proses ini dikenali sebagai fosforilasi, di mana molekul ATP bertenaga tinggi mendermakan kumpulan fosfat kepada molekul substrat. Transesterifikasi ini menghasilkan substrat berfosforil dan ADP. Secara terbalik, ia dirujuk sebagai nyahfosforilasi, apabila substrat berfosforil mendermakan kumpulan fosfat dan ADP pula memperoleh kumpulan fosfat (menghasilkan substrat yang dinyahfosforilasi dan ATP). Kedua-dua proses ini, fosforilasi dan defosforilasi, berlaku empat kali dalam glikolisis (penguraian glukosa).[2][3][4]
Kinase ialah sebahagian daripada keluarga fosfotransferase yang lebih besar. Kinase tidak boleh dikelirukan dengan fosforilase, yang memangkinkan penambahan kumpulan fosfat tak organik kepada penerima, mahupun dengan fosfatase, yang mengeluarkan kumpulan fosfat (nyahfosforilasi). Keadaan fosforilasi molekul, sama ada protein, lipid atau karbohidrat, boleh mempengaruhi aktiviti, kereaktifan dan keupayaannya untuk mengikat molekul lain. Oleh itu, kinase adalah kritikal dalam metabolisme, pengisyaratan sel, kawal atur protein, pengangkutan sel, proses rembesan dan banyak aliran sel lain yang menjadikannya sangat penting kepada fisiologi manusia.
Biokimia dan kerelevanan fungsi
[sunting | sunting sumber]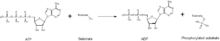
Kinase bertindak sebagai perantara dalam pemindahan bahagian fosfat daripada molekul bertenaga tinggi (seperti ATP) kepada molekul substrat, seperti dalam rajah di bawah. Kinase diperlukan untuk menstabilkan tindak balas ini kerana ikatan fosfoanhidrida mengandungi tahap tenaga tinggi. Kinase mengorientasikan substratnya dan kumpulan fosforil dalam tapak aktifnya lalu meningkatkan kadar tindak balas. Selain itu, mereka biasanya menggunakan sisa asid amino bercas positif yang menstabilkan keadaan peralihan secara elektrostatik dengan berinteraksi dengan kumpulan fosfat bercas negatif. Sebagai alternatif, sesetengah kinase menggunakan kofaktor logam yang terikat di tapak aktif mereka untuk menyelaraskan kumpulan fosfat. Kinase protein boleh dikelaskan sebagai pemangkin aktif (kanonikal) atau sebagai pseudokinase, mencerminkan kehilangan evolusi satu atau lebih asid amino pemangkin yang menyusun atau menghidrolisis ATP.[5] Walau bagaimanapun, dari segi output isyarat dan perkaitan penyakit, kedua-dua kinase dan pseudokinase ialah modulator isyarat penting dalam sel manusia, menjadikan kinase sebagai sasaran ubat yang sangat penting.[6]
Kinase digunakan secara meluas untuk menghantar isyarat fisiologi dan mengawal proses kompleks dalam sel. Pemfosforilan molekul boleh meningkatkan atau menghalang aktivitinya serta memodulasi keupayaannya untuk berinteraksi dengan molekul lain. Penambahan dan penyingkiran kumpulan fosforil memberikan sel satu cara kawal atur kerana pelbagai kinase boleh bertindak balas kepada keadaan atau isyarat yang berbeza. Mutasi terhadap kinase yang membawa kepada kehilangan fungsi atau peningkatan fungsi boleh menyebabkan kanser[7] dan penyakit pada manusia, termasuk beberapa jenis leukemia dan neuroblastoma, glioblastoma,[8] ataksia spinoserebelar (jenis 14), bentuk agamaglobulinemia dan banyak lagi.[9]
Kinase protein
[sunting | sunting sumber]Kinase protein bertindak ke atas protein dengan memfosforilasinya pada sisa asid amino serina, treonina, tirosina, atau histidina. Fosforilasi boleh mengubah suai fungsi protein dalam pelbagai cara. Ia boleh meningkatkan atau mengurangkan aktiviti protein, menstabilkannya atau menandakannya agar dimusnahkan, menyetempatkannya dalam petak sel tertentu, dan ia boleh memulakan atau mengekang interaksi dengan protein lain. Kinase protein membentuk majoriti semua kinase, dan dikaji secara meluas.[10] Kinase ini, bersama-sama dengan fosfatase, memainkan peranan utama dalam pengawalan protein dan enzim serta isyarat dalam sel.
Kinase lipid
[sunting | sunting sumber]Lipid kinase memfosforilasi lipid dalam sel, baik pada membran plasma dan juga pada membran organel. Penambahan kumpulan fosfat boleh mengubah kereaktifan dan penyetempatan lipid, dan boleh digunakan dalam penghantaran isyarat.
Kinase karbohidrat
[sunting | sunting sumber]Bagi kebanyakan mamalia, karbohidrat menyediakan sebahagian besar keperluan kalori harian. Untuk mengumpul tenaga daripada oligosakarida, ia mesti dipecahkan terlebih dahulu kepada monosakarida supaya boleh memasuki metabolisme. Kinase memainkan peranan penting dalam hampir semua laluan metabolik. Rajah di kiri menunjukkan fasa kedua glikolisis, yang mengandungi dua tindak balas penting yang dimangkin oleh kinase. Hubungan anhidrida dalam 1,3-bifosfogliserat tidak stabil dan bertenaga tinggi. Kinase 1,3-bisfosfogliserat memerlukan ADP untuk menjalankan tindak balasnya yang menghasilkan 3-fosfogliserat dan ATP. Dalam langkah terakhir glikolisis, piruvat kinase memindahkan kumpulan fosforil daripada fosfoenolpiruvat kepada ADP, menghasilkan ATP dan piruvat.
Kinase lain
[sunting | sunting sumber]Kinase bertindak ke atas banyak molekul lain selain protein, lipid, dan karbohidrat. Banyak kinase yang bertindak ke atas nukleotida (DNA dan RNA), termasuk yang terlibat dalam interkonversi nukleotida, seperti kinase nukleosida-fosfat dan kinase nukleosida-difosfat.[11] Molekul kecil lain yang menjadi substrat kinase termasuk kreatina, fosfogliserat, riboflavin, dihidroksiaseton, syikimat dan banyak lagi.
Rujukan
[sunting | sunting sumber]- ^ "Crystal structure of the Citrobacter freundii dihydroxyacetone kinase reveals an eight-stranded alpha-helical barrel ATP-binding domain". The Journal of Biological Chemistry. 278 (48): 48236–48244. November 2003. doi:10.1074/jbc.M305942200. PMID 12966101.
- ^ "The protein kinase complement of the human genome". Science. 298 (5600): 1912–1934. December 2002. Bibcode:2002Sci...298.1912M. doi:10.1126/science.1075762. PMID 12471243.
- ^ "Kinase". TheFreeDictionary.com
- ^ "History of ATP research milestones from an ATP-related chemistry". Nobelprize.org.
- ^ "Day of the dead: pseudokinases and pseudophosphatases in physiology and disease". Trends in Cell Biology. 24 (9): 489–505. September 2014. doi:10.1016/j.tcb.2014.03.008. PMID 24818526.
- ^ Foulkes DM, Byrne DP and Eyers PA (2017) Pseudokinases: update on their functions and evaluation as new drug targets. Future Med Chem. 9(2):245-265
- ^ "Hallmarks of Cancer 1". Scientific American.
- ^ "Mutational profiling of kinases in glioblastoma". BMC Cancer. 14: 718. September 2014. doi:10.1186/1471-2407-14-718. PMC 4192443. PMID 25256166. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Kinase mutations in human disease: interpreting genotype-phenotype relationships". Nature Reviews. Genetics. 11 (1): 60–74. January 2010. doi:10.1038/nrg2707. PMID 20019687.
- ^ "The protein kinase complement of the human genome". Science. 298 (5600): 1912–1934. December 2002. Bibcode:2002Sci...298.1912M. doi:10.1126/science.1075762. PMID 12471243.
- ^ Voet D, Voet JC, Pratt CW (2008). Fundamentals of biochemistry : life at the molecular level (ed. 3rd). Hoboken, NJ: Wiley. ISBN 9780470129302.

