Fosfofruktokinase 2
| Fosfofruktokinase 2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Dimer 6-fosfofrukto-2-kinase, jantung manusia | |||||||||
| Pengenal pasti | |||||||||
| Nombor EC | 2.7.1.105 | ||||||||
| Nombor CAS | 78689-77-7 | ||||||||
| Pangkalan data | |||||||||
| IntEnz | Lihat IntEnz | ||||||||
| BRENDA | Entri BRENDA | ||||||||
| ExPASy | Lihat NiceZyme | ||||||||
| KEGG | Entri KEGG | ||||||||
| MetaCyc | Laluan metabolik | ||||||||
| PRIAM | Profil | ||||||||
| Struktur PDB | RCSB PDB PDBj PDBe PDBsum | ||||||||
| Ontologi gen | AmiGO / EGO | ||||||||
| |||||||||
| 6PF2K | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktur hablur 6-fosfofrukto-2-kinase/fruktosa-2,6-bisfosfatase, hati manusia | |||||||||
| Pengenal pasti | |||||||||
| Simbol | 6PF2K | ||||||||
| Pfam | PF01591 | ||||||||
| Klan Pfam | CL0023 | ||||||||
| InterPro | IPR013079 | ||||||||
| PROSITE | PDOC00158 | ||||||||
| SCOP | 1bif | ||||||||
| SUPERFAMILY | 1bif | ||||||||
| |||||||||
| 6-fosfofrukto-2-kinase/fruktosa-bisfosfotase-2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktur PFK2: domain kinase (sian) dan domain fosfatase (hijau). | |||||||||
| Pengenal pasti | |||||||||
| Simbol | 6PF2K | ||||||||
| Pfam | PF01591 | ||||||||
| InterPro | IPR013079 | ||||||||
| PROSITE | PDOC00158 | ||||||||
| SCOP | 1bif | ||||||||
| SUPERFAMILY | 1bif | ||||||||
| |||||||||
| fruktosa-bisfosfatase-2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Pengenal pasti | |||||||||
| Simbol | FBPase-2 | ||||||||
| Pfam | PF00316 | ||||||||
| InterPro | IPR028343 | ||||||||
| PROSITE | PDOC00114 | ||||||||
| |||||||||
Fosfofruktokinase-2 (6-fosphofrukto-2-kinase, PFK-2) atau fruktosa bifosfatase-2 (FBPase-2), ialah enzim yang bertanggungjawab secara tidak langsung untuk mengawal kadar glikolisis dan glukoneogenesis dalam sel. Ia memangkinkan pembentukan dan degradasi pengawal atur alosterik ketara, fruktosa-2,6-bifosfat (Fru-2,6-P2) daripada substrat fruktosa-6-fosfat. Fru-2,6-P2 menyumbang kepada langkah penentu kadar glikolisis kerana ia mengaktifkan enzim fosfofruktokinase 1 dalam laluan glikolisis, dan menghalang fruktosa-1,6-bisfosfatase 1 dalam glukoneogenesis.[1] Oleh kerana Fru-2,6-P2 secara berbeza mengawal glikolisis dan glukoneogenesis, ia boleh bertindak sebagai isyarat utama untuk bertukar antara laluan yang bertentangan.[1] Oleh kerana PFK-2 menghasilkan Fru-2,6-P2 sebagai tindak balas kepada isyarat hormon, metabolisme boleh dikawal dengan lebih sensitif dan cekap untuk sejajar dengan keperluan glikolisis organisma.[2] Enzim ini mengambil bahagian dalam metabolisme fruktosa dan manosa. Enzim ini penting dalam kawal atur metabolisme karbohidrat hepatik, dan didapati dalam kuantiti yang paling banyak dalam hati, buah pinggang dan jantung. Dalam mamalia, beberapa gen sering menyandikan isoform yang berbeza, setiap satunya berbeza dalam pengedaran tisu dan aktiviti enzimatiknya.[3] Keluarga yang diterangkan di sini mempunyai persamaan dengan fosfofruktokinase yang dipacu ATP, walau bagaimanapun, mereka berkongsi sedikit persamaan urutan, walaupun beberapa sisa kelihatan penting untuk interaksi mereka dengan fruktosa 6-fosfat.[4]
PFK-2 dikenali sebagai "enzim dwifungsi" kerana strukturnya yang ketara: walaupun kedua-duanya terletak pada satu homodimer protein, dua domainnya bertindak sebagai satu enzim yang berfungsi secara bebas.[5] Satu terminal berfungsi sebagai domain kinase (PFK-2) manakala terminal lain bertindak sebagai domain fosfatase (FBPase-2).[6]
Dalam mamalia, mekanisme genetik menyandikan isoform PFK-2 yang berbeza untuk menampung keperluan khusus tisu. Walaupun fungsi umum kekal sama, isoform mempunyai sedikit perbezaan dalam sifat enzimatik dan dikawal oleh kaedah peraturan yang berbeza; perbezaan ini dibincangkan di bawah.[7]
Struktur[sunting | sunting sumber]
Monomer protein dwifungsi dibahagikan dengan jelas kepada dua domain berfungsi. Domain kinase terletak di terminal-N.[8] Ia terdiri daripada helaian enam lembar-β tengah, dengan lima helai selari dan helai tepi antiselari, dikelilingi oleh tujuh heliks-α.[6] Domain tersebut mengandungi lipatan pengikat nukleotida (nbf) pada hujung terminal-C bagi untaian β pertama.[9] Domain PFK-2 nampaknya berkait rapat dengan superkeluarga protein pengikat mononukleotida, termasuk adenilat siklase.[10]
Sebaliknya, domain fosfatase terletak di terminal C.[11] Ia menyerupai keluarga protein yang termasuk mutasi fosfogliserat dan fosfatase asid.[10][12] Domain ini mempunyai struktur α/β bercampur, dengan enam helaian-β pusat, ditambah subdomain α-heliks tambahan yang meliputi tapak aktif molekul yang disangka.[6] Akhirnya, rantau terminal N memodulasi aktiviti PFK-2 dan FBPase2, dan menstabilkan bentuk dimer enzim.[12][13]
Fungsi[sunting | sunting sumber]
Fungsi utama enzim ini adalah untuk mensintesis atau merendahkan pengawal selia alosterik Fru-2,6-P 2 sebagai tindak balas kepada keperluan glikolisis sel atau organisma, seperti yang digambarkan dalam rajah yang disertakan.
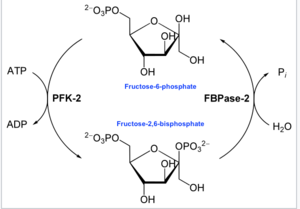
Dalam enzimologi, 6-fosfofrukto-2-kinase (EC 2.7.1.105) ialah enzim yang memangkinkan tindak balas kimia:
- ATP + beta-D-fruktosa 6-fosfat ADP + beta-D-fruktosa 2,6-bisfosfat[14]
Oleh itu, domain kinase menghidrolisiskan ATP untuk memfosforilasi karbon-2 fruktosa-6-fosfat, menghasilkan Fru-2,6-P2 dan ADP . Perantaraan fosfohistidina terbentuk dalam tindak balas.[15]
Di terminal lain, domain fruktosa-2,6-bifosfat 2-fosfatase (EC 3.1.3.46) menyahfosforilasi Fru-2,6-P2 dengan penambahan air. Tindak balas kimia yang bertentangan ini ialah:
- beta-D-fruktosa 2,6-bifosfat + H2O D-fruktosa 6-fosfat + fosfat[16]
Oleh kerana sifat dwifungsi enzim, ia boleh dikategorikan kepada beberapa keluarga. Melalui pengkategorian mengikut tindak balas kinase, enzim ini tergolong dalam keluarga transferase, khususnya yang memindahkan kumpulan yang mengandungi fosforus (fosfotransferase) dengan kumpulan alkohol sebagai penerima.[14] Sebaliknya, tindak balas fosfatase adalah ciri keluarga hidrolase, khususnya yang bertindak pada ikatan monoester fosfor.[16]
Kawal atur[sunting | sunting sumber]
Dalam hampir semua isoform, PFK-2 mengalami pengubahsuaian kovalen melalui fosforilasi/defosforilasi berdasarkan isyarat hormon sel. Fosforilasi sisa tertentu mungkin mendorong anjakan yang menstabilkan fungsi domain kinase atau fosfatase. Isyarat peraturan ini dengan itu mengawal sama ada F-2,6-P2 akan disintesis atau terdegradasi.[17]
Tambahan pula, kawal atur alosterik PFK2 sangat serupa dengan kawal atur PFK1.[18] Tahap AMP atau kumpulan fosfat yang tinggi menandakan keadaan cas tenaga yang rendah, dan dengan itu, merangsang PFK2. Sebaliknya, kepekatan fosfoenolpiruvat (PEP) dan sitrat yang tinggi menandakan bahawa terdapat tahap pelopor biosintetik yang tinggi, dan dengan itu, menghalang PFK2. Tidak seperti PFK1, PFK2 tidak terjejas oleh kepekatan ATP.[19]
Isozim[sunting | sunting sumber]
Isozim protein ialah enzim yang memangkinkan tindak balas yang sama tetapi dikodkan dengan jujukan asid amino yang berbeza dan oleh itu, memaparkan sedikit perbezaan dalam ciri protein. Pada manusia, empat gen yang mengekod protein fosfofruktokinase 2 termasuk PFKFB-1, PFKFB2, PFKFB3 dan PFKFB4.[5]
PFKB1: Hati, otot dan janin[sunting | sunting sumber]
| 6-fosfofrukto-2-kinase: PFKB1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktur hablur 6-fosfofrukto-2-kinase/fruktosa-2,6-bisfosfatase, hati manusia | |||||||||
| Pengenal pasti | |||||||||
| Nombor EC | 2.7.1.105 | ||||||||
| Nombor CAS | 78689-77-7 | ||||||||
| Pangkalan data | |||||||||
| IntEnz | Lihat IntEnz | ||||||||
| BRENDA | Entri BRENDA | ||||||||
| ExPASy | Lihat NiceZyme | ||||||||
| KEGG | Entri KEGG | ||||||||
| MetaCyc | Laluan metabolik | ||||||||
| PRIAM | Profil | ||||||||
| Struktur PDB | RCSB PDB PDBj PDBe PDBsum | ||||||||
| Ontologi gen | AmiGO / EGO | ||||||||
| |||||||||
Terletak pada kromosom X, gen ini adalah yang paling terkenal daripada empat gen terutamanya kerana ia mengekod enzim hati yang banyak dikaji.[20] Pemotongan mRNA pelbagai bagi PFKB1 menghasilkan tiga promoter berbeza (L, M dan F) dan oleh itu, tiga varian khusus tisu yang berbeza dalam kawal atur:[21]
- Jenis L (liver): tisu hati
- Insulin mengaktifkan fungsi PFK-2 hati untuk menanda kelimpahan glukosa darah yang tinggi tersedia untuk glikolisis. Insulin mengaktifkan fosfatase protein yang menyahfosforilasi kompleks PFK-2 dan menyebabkan kecenderungan pengaktifan PFK-2. PFK-2 kemudiannya meningkatkan pengeluaran F-2,6-P2. Oleh kerana produk ini secara alosterik mengaktifkan PFK-1, ia mengaktifkan glikolisis dan menghalang glukoneogenesis.[22]
- Sebaliknya, glukagon meningkatkan aktiviti FBPase-2. Pada kepekatan glukosa darah rendah, glukagon mencetuskan lata isyarat cAMP dan seterusnya, protein kinase A (PKA) memfosforilasi serina-32 berhampiran terminal N. Ini menyahaktifkan keupayaan enzim dwifungsi untuk bertindak sebagai kinase dan menstabilkan aktiviti fosfatase. Oleh itu, glukagon mengurangkan kepekatan F-2,6-P2, melambatkan kadar glikolisis, dan merangsang laluan glukoneogenesis.[23][24]
- Jenis M (muscle): tisu otot rangka; jenis F (fetus): fibroblas dan tisu janin[25]
- Berbeza dengan kebanyakan tisu PFK-2 yang lain, PFK-2 dalam kedua-dua otot rangka dan tisu janin dikawal sepenuhnya oleh kepekatan fruktosa-6-fosfat. Dalam ekson pertama mereka, tiada tapak kawal atur yang memerlukan fosforilasi/defosforilasi untuk mencetuskan perubahan dalam fungsi. Kepekatan F-6-P yang tinggi akan mengaktifkan fungsi kinase dan meningkatkan kadar glikolisis, manakala kepekatan F-6-P yang rendah akan menstabilkan tindakan fosfatase.[21]
Rujukan[sunting | sunting sumber]
- ^ a b "Covalent control of 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: insights into autoregulation of a bifunctional enzyme". Protein Science. 4 (6): 1023–37. June 1995. doi:10.1002/pro.5560040601. PMC 2143155. PMID 7549867.
- ^ "A fresh view of glycolysis and glucokinase regulation: history and current status". The Journal of Biological Chemistry. 289 (18): 12189–94. May 2014. doi:10.1074/jbc.R114.557314. PMC 4007419. PMID 24637025.
- ^ "Sequence and structure of the human 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase heart isoform gene (PFKFB2)". European Journal of Biochemistry. 254 (1): 103–10. May 1998. doi:10.1046/j.1432-1327.1998.2540103.x. PMID 9652401.
- ^ "An essential methionine residue involved in substrate binding by phosphofructokinases". Biochem. Biophys. Res. Commun. 250 (2): 466–8. September 1998. doi:10.1006/bbrc.1998.9311. PMID 9753654.
- ^ a b "6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: head-to-head with a bifunctional enzyme that controls glycolysis". The Biochemical Journal. 381 (Pt 3): 561–79. August 2004. doi:10.1042/BJ20040752. PMC 1133864. PMID 15170386.
- ^ a b c "The crystal structure of the bifunctional enzyme 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase reveals distinct domain homologies". Structure. 4 (9): 1017–29. September 1996. doi:10.1016/S0969-2126(96)00109-8. PMID 8805587.
- ^ "Expression of inducible 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase/PFKFB3 isoforms in adipocytes and their potential role in glycolytic regulation". Diabetes. 54 (12): 3349–57. December 2005. doi:10.2337/diabetes.54.12.3349. PMID 16306349.
- ^ "Evolutionary reengineering of the phosphofructokinase active site: ARG-104 does not stabilize the transition state in 6-phosphofructo-2-kinase". Biochemical and Biophysical Research Communications. 213 (2): 663–72. August 1995. doi:10.1006/bbrc.1995.2183. PMID 7646523.
- ^ "Distantly related sequences in the alpha- and beta-subunits of ATP synthase, myosin, kinases and other ATP-requiring enzymes and a common nucleotide binding fold". The EMBO Journal. 1 (8): 945–51. 1982. doi:10.1002/j.1460-2075.1982.tb01276.x. PMC 553140. PMID 6329717.
- ^ a b "Structure, function, and evolution of phosphoglycerate mutases: comparison with fructose-2,6-bisphosphatase, acid phosphatase, and alkaline phosphatase". Progress in Biophysics and Molecular Biology. 73 (2–4): 263–87. 2000. doi:10.1016/S0079-6107(00)00007-9. PMID 10958932.
- ^ "Hepatic 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase. The role of surface loop basic residues in substrate binding to the fructose-2,6-bisphosphatase domain". The Journal of Biological Chemistry. 267 (30): 21588–94. October 1992. doi:10.1016/S0021-9258(19)36651-7. PMID 1328239.
- ^ a b Stryer L, Berg JM, Tymoczko JL (2008). "The Balance Between Glycolysis and Gluconeogenesis in the Liver Is Sensitive to Blood-Glucose Concentration". Biochemistry (Looseleaf). San Francisco: W. H. Freeman. m/s. 466–467. ISBN 978-1-4292-3502-0.
- ^ "Significance of the amino terminus of rat testis fructose-6-phosphate, 2-kinase:fructose-2,6-bisphosphatase". The Journal of Biological Chemistry. 268 (21): 15951–7. July 1993. doi:10.1016/S0021-9258(18)82344-4. PMID 8393455.
- ^ a b "ENZYME entry 2.7.1.105". enzyme.expasy.org. Dicapai pada 2018-03-24.
- ^ "6-phosphofructo-2-kinase (IPR013079)". InterPro. EMBL-EBI. Dicapai pada 2018-03-25.
- ^ a b "ENZYME entry 3.1.3.46". enzyme.expasy.org. Dicapai pada 2018-03-25.
- ^ "PFK-2/FBPase-2: maker and breaker of the essential biofactor fructose-2,6-bisphosphate". Trends in Biochemical Sciences. 26 (1): 30–5. January 2001. doi:10.1016/S0968-0004(00)01699-6. PMID 11165514.
- ^ "Phosphofructokinase 2: the enzyme that forms fructose 2,6-bisphosphate from fructose 6-phosphate and ATP". Biochemical and Biophysical Research Communications. 101 (3): 1078–84. August 1981. doi:10.1016/0006-291X(81)91859-3. PMID 6458291.
- ^ "Balancing glycolytic flux: the role of 6-phosphofructo-2-kinase/fructose 2,6-bisphosphatases in cancer metabolism". Cancer & Metabolism. 1 (1): 8. February 2013. doi:10.1186/2049-3002-1-8. PMC 4178209. PMID 24280138.
- ^ "5' flanking sequence and structure of a gene encoding rat 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase". Proceedings of the National Academy of Sciences of the United States of America. 86 (17): 6543–7. September 1989. Bibcode:1989PNAS...86.6543D. doi:10.1073/pnas.86.17.6543. PMC 297880. PMID 2549541.
- ^ a b Salway JG (2017). Metabolism at a Glance. Wiley-Blackwell. ISBN 978-0-470-67471-0.
- ^ Hue L, Rider MH, Rousseau GG (1990). "Fructose-2,6-bisphosphate in extra hepatic tissues". Dalam Pilkis SJ (penyunting). Fructose-2,6-bisphosphate. Boca Raton, Fla.: CRC Press. m/s. 173–193. ISBN 978-0-8493-4795-5.
- ^ "Hormonal regulation of hepatic gluconeogenesis and glycolysis". Annual Review of Biochemistry. 57: 755–83. 1988. doi:10.1146/annurev.bi.57.070188.003543. PMID 3052289.
- ^ "Glucocorticoid regulation of hepatic 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase gene expression". The Journal of Biological Chemistry. 264 (12): 7000–4. April 1989. doi:10.1016/S0021-9258(18)83531-1. PMID 2540168.
- ^ "Identification of a novel Pfkfb1 mRNA variant in rat fetal liver". Biochemical and Biophysical Research Communications. 431 (1): 36–40. February 2013. doi:10.1016/j.bbrc.2012.12.109. PMID 23291237.
Pautan luar[sunting | sunting sumber]
- Fructose+2,6-bisphosphatase dalam Tajuk Subjek Perubatan (MeSH) di Perpustakaan Perubatan Negara AS

