Plumbum(II) sulfat

| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Plumbum(II) sulfat
| |
| Nama lain | |
| Pengecam | |
Imej model 3D Jmol
|
|
| ChemSpider | |
| ECHA InfoCard | 100.028.362 |
| Nombor EC |
|
PubChem CID
|
|
| UNII | |
| Nombor PBB | 1759 1794 |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| PbSO4 | |
| Jisim molar | 303.26 g/mol[1][2] |
| Rupa bentuk | Pepejal putih |
| Ketumpatan | 6.29 g/cm3[3] |
| Takat lebur | 1,087 °C (1,989 °F; 1,360 K) Terurai |
| 0.0032 g/100 mL (15 °C) 0.0404 g/100 mL (25 °C)[4] | |
Hasil keterlarutan (Ksp)
|
2.13 x 10−8 (20 °C) |
| Keterlarutan | Tak larut dalam alkohol Larut dalam ammonium asetat (≥ 6 mol/L) |
| −69.7·10−6 cm3/mol | |
Indeks biasan (nD)
|
1.877 |
| Struktur | |
| Struktur kristal | Ortorombus, barit |
| Termokimia | |
| Muatan haba tentu, C | 103 J/degree mol |
| Entropi molar piawai S |
149 J·mol−1·K−1[5] |
Entalpi pembentukan
piawai (ΔfH⦵298) |
−920 kJ·mol−1[5] |
| Bahaya | |
| Piktogram GHS |   
|
| Perkataan isyarat GHS | Danger |
| H302, H332, H360Df, H410 | |
| P201, P202, P260, P261, P264, P270, P271, P273, P281, P301+312, P304+312, P304+340, P308+313, P312, P314, P330, P391, P405, P501 | |
| NFPA 704 (berlian api) | |
| Takat kilat | Tidak mudah terbakar |
Nilai Had Ambang (TLV)
|
0.15 mg/m3 |
| Sebatian berkaitan | |
Anion lain
|
Plumbum(II) klorida, Plumbum(II) bromida, Plumbum(II) iodida, Plumbum(II) fluorida |
Kation lain
|
Tin(II) sulfat, Natrium sulfat, Kuprum(II) sulfat |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| | |
| Rujukan kotak info | |
Plumbum(II) sulfat (PbSO4) ialah pepejal putih, yang kelihatan putih dalam bentuk mikrohablur.
Ia sering dilihat pada plat/elektrod bateri kereta kerana ia terbentuk apabila bateri dinyahcas (apabila bateri dicas semula, maka sulfat plumbum ditukar kembali kepada plumbum logam dan asid sulfurik pada terminal negatif atau plumbum dioksida dan asid sulfurik pada terminal positif). Plumbum sulfat kurang larut dalam air.
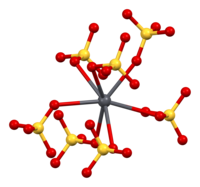
Struktur[sunting | sunting sumber]
Anglesit (plumbum(II) sulfat) menggunakan struktur kristal ortorombus yang sama seperti selestit (strontium sulfat) dan barit (barium sulfat). Ketiga-tiga struktur mineral berada dalam kumpulan ruang Pbnm (nombor 62).[6] Setiap ion plumbum(II) dikelilingi oleh 12 atom oksigen daripada 7 ion sulfat, membentuk polihedron PbO12.[7] Jarak plumbum-oksigen berkisar antara 2.612 Å hingga 3.267 Å dan jarak purata ialah 2.865 Å.[6]
| Koordinasi plumbum | Koordinasi sulfat |
|---|---|
|

|
Pembuatan[sunting | sunting sumber]
Plumbum(II) sulfat disediakan dengan merawat plumbum oksida, hidroksida atau karbonat dengan asid sulfurik hangat atau dengan merawat garam plumbum larut dengan asid sulfurik.
Sebagai alternatif, ia boleh dibuat dengan interaksi larutan plumbum nitrat dan natrium sulfat.
Toksikologi[sunting | sunting sumber]
Plumbum sulfat adalah toksik melalui penyedutan, pengambilan dan sentuhan kulit. Ia adalah racun terkumpul, dan pendedahan berulang boleh menyebabkan anemia, kerosakan buah pinggang, kerosakan penglihatan atau kerosakan pada sistem saraf pusat (terutamanya pada kanak-kanak). Ia juga menghakis; sentuhan dengan mata boleh menyebabkan kerengsaan teruk atau melecur. Nilai had ambang biasa ialah 0.15 mg/m3.
Mineral[sunting | sunting sumber]
Anglesit, mineral semula jadi PbSO4, terbit sebagai hasil pengoksidaan bijih sulfida plumbum primer.
Plumbum sulfat hidrogen dan bes[sunting | sunting sumber]
Sebilangan plumbum sulfat bes diketahui: PbSO4·PbO; PbSO4·2PbO; PbSO4·3PbO; PbSO4·4PbO. Ia digunakan dalam pembuatan pes aktif bateri asid plumbum. Mineral yang berkaitan ialah ledhilit, 2PbCO3·PbSO4·Pb(OH)2.
Pada kepekatan tinggi asid sulfurik (>80%), plumbum hidrogensulfat, Pb(HSO4)2, terbentuk.[8]
Sifat kimia[sunting | sunting sumber]
Plumbum(II) sulfat boleh dilarutkan dalam HNO3, HCl, H2SO4 pekat yang menghasilkan garam berasid atau sebatian kompleks, dan dalam alkali pekat memberikan kompleks tetrahidroksidoplumbat(II) [Pb(OH)4]2− larut.
- PbSO4 (p) + H2SO4 (c) ⇌ Pb(HSO4)2 (ak)
- PbSO4 (s) + 4NaOH (ak) → Na2[Pb(OH)4] (ak) + Na2SO4 (ak)
Plumbum(II) sulfat terurai apabila dipanaskan melebihi 1000 °C:
- PbSO4 (p) → PbO (p) + SO3 (g)
Rujukan[sunting | sunting sumber]
- ^ "Molar Mass of Lead Sulphate". webbook.nist.gov (dalam bahasa Inggeris). Diarkibkan daripada yang asal pada 13 December 2020. Dicapai pada 4 March 2022.
- ^ "NIST data review 1980" (PDF). National Institute of Standards and Technology (NIST). Diarkibkan daripada yang asal (PDF) pada 21 December 2016. Dicapai pada 4 March 2022.
- ^ Lide, David R. (14 September 2002). "CRC Handbook of Chemistry and Physics. 83rd Edition". Journal of the American Chemical Society. National Institute of Standards and Technology (NIST); CRC Press: Boca Raton. 124 (47): 14280. doi:10.1021/ja025295q. ISBN 9780849304835. ISSN 0002-7863. OCLC 956588069. Diarkibkan daripada yang asal pada 4 March 2022. Dicapai pada 4 March 2022.
- ^ PubChem. "Lead sulfate". pubchem.ncbi.nlm.nih.gov (dalam bahasa Inggeris). Diarkibkan daripada yang asal pada 29 November 2021. Dicapai pada 2022-03-04.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles (ed. 6th). Houghton Mifflin Company. m/s. A22. ISBN 978-0-618-94690-7. OCLC 1029017812.
- ^ a b c Antao, Sytle M. (2012). "Structural trends for celestite (SrSO4), anglesite (PbSO4), and barite (BaSO4): Confirmation of expected variations within the SO4 groups". Am. Mineral. 97 (4): 661–665. doi:10.2138/am.2012.3905.
- ^ Wells, A. F. (1984). Structural Inorganic Chemistry (ed. 5th). Oxford University Press. m/s. 1187. ISBN 978-0-19-965763-6.
- ^ "Министерство образования и науки РФ, Реферат "Свинец и его свойства"" [Abstract: Lead and its properties]. Ministry of Education and Science of the Russian Federation. 2007. Diarkibkan daripada yang asal pada 21 December 2007.

