Triflat
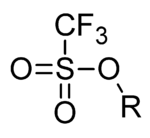

Dalam kimia organik, triflat (nama sistematik: trifluorometanasulfonat), ialah kumpulan berfungsi dengan formula R−OSO
2CF
3 dengan struktur R−O−S(=O)
2−CF
3. Kumpulan triflat sering diwakili oleh −OTf, berbanding −Tf, iaitu kumpulan triflil R−SO
2CF
3. Sebagai contoh, n-butil triflat boleh ditulis sebagai CH
3CH
2CH
2CH
2OTf.
Anion triflat yang sepadan, CF
3SO−
3, ialah ion poliatomik yang sangat stabil; ini datang daripada fakta bahawa asid triflik (CF
3SO
3H) ialah asid super; iaitu ia lebih berasid daripada asid sulfurik tulen, dan merupakan salah satu asid terkuat yang diketahui.
Aplikasi[sunting | sunting sumber]
Kumpulan triflat ialah kumpulan keluar yang sangat baik yang digunakan dalam tindak balas organik tertentu seperti penggantian nukleofilik, gandingan Suzuki dan tindak balas Heck. Oleh kerana triflat alkil sangat reaktif dalam tindak balas SN2, ia mesti disimpan dalam keadaan bebas nukleofil (seperti air). Anion berhutang kestabilannya kepada penstabilan resonans yang menyebabkan cas negatif tersebar secara simetri ke atas tiga atom oksigen. Penstabilan tambahan dicapai oleh kumpulan trifluoromethyl, yang bertindak sebagai kumpulan penarik elektron yang kuat menggunakan atom sulfur sebagai jambatan.
Triflate juga telah digunakan sebagai ligan untuk logam kumpulan 11 dan 13 bersama dengan elemen lantanida.
Triflat litium digunakan dalam beberapa bateri ion litium sebagai komponen elektrolit.
Reagen triflimida ringan ialah fenil triflimida atau N,N-bis(trifluorometanasulfonil)anilina, dengan hasil sampingan ialah kompleks [CF3SO2N−Ph]−.
Garam triflat[sunting | sunting sumber]
Garam triflat merupakan sebuah sebatian yang stabil pada suhu tinggi dengan takat lebur sehingga 350 °C bagi garam natrium, boron dan perak terutamanya dalam bentuk bebas air. Ia boleh didapati secara langsung daripada asid triflik dan logam hidroksida atau logam karbonat dalam air. Sebagai alternatif, ia boleh didapati daripada bertindak balas klorida logam dengan asid triflik kemas atau triflat perak, atau daripada bertindak balas triflat barium dengan sulfat logam dalam air:[1]
Triflat logam digunakan sebagai pemangkin asid Lewis dalam kimia organik. Terutamanya berguna ialah triflat lantanida jenis Ln(OTf)
3 (di mana Ln ialah lantanoid). Skandium triflat ialah pemangkin popular yang berkaitan digunakan dalam tindak balas seperti tindak balas aldol dan tindak balas Diels-Alder. Contohnya ialah tindak balas penambahan aldol Mukaiyama antara benzaldehid dan eter silil enol sikloheksanon dengan hasil kimia 81%.[2] Tindak balas yang sepadan dengan garam itrium gagal:


Rujukan[sunting | sunting sumber]
- ^ Dixon, N. E.; Lawrance, G. A.; Lay, P. A.; Sargeson, A. M.; Taube, H. (1990). "Trifluoromethanesulfonates and Trifluoromethanesulfonato-O Complexes". Inorganic Syntheses. 28: 70–76. doi:10.1002/9780470132593.ch16. ISBN 9780470132593.
- ^ Kobayashi, S. (1999). "Scandium Triflate in Organic Synthesis". European Journal of Organic Chemistry. 1999 (1): 15–27. doi:10.1002/(SICI)1099-0690(199901)1999:1<15::AID-EJOC15>3.0.CO;2-B.
- ^ Aihara, Yoshinori; Chatani, Naoto (2013-04-10). "Nickel-Catalyzed Direct Alkylation of C–H Bonds in Benzamides and Acrylamides with Functionalized Alkyl Halides via Bidentate-Chelation Assistance". Journal of the American Chemical Society. 135 (14): 5308–5311. doi:10.1021/ja401344e. PMID 23495861.



