Reseptor estrogen
| reseptor estrogen 1 (ER-alfa) | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Pengenal pasti | |||||||
| Simbol | ESR1 | ||||||
| Simbol alternatif | ER-α, NR3A1 | ||||||
| Gen NCBI | 2099 | ||||||
| HGNC | 3467 | ||||||
| OMIM | 133430 | ||||||
| PDB | 1ERE | ||||||
| RefSeq | NM_000125 | ||||||
| UniProt | P03372 | ||||||
| Other data | |||||||
| Lokus | Kromosom 6 q24-q27 | ||||||
| |||||||
| reseptor estrogen 2 (ER-beta) | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Pengenal pasti | |||||||
| Simbol | ESR2 | ||||||
| Simbol alternatif | ER-β, NR3A2 | ||||||
| Gen NCBI | 2100 | ||||||
| HGNC | 3468 | ||||||
| OMIM | 601663 | ||||||
| PDB | 1QKM | ||||||
| RefSeq | NM_001040275 | ||||||
| UniProt | Q92731 | ||||||
| Other data | |||||||
| Lokus | Kromosom 14 q21-q22 | ||||||
| |||||||
Reseptor estrogen (ER) ialah sekumpulan protein yang terdapat di dalam sel. Mereka adalah reseptor yang diaktifkan oleh hormon estrogen (17β-estradiol).[1] Dua kelas ER wujud: reseptor estrogen nukleus (ERα dan ERβ) yang merupakan ahli keluarga reseptor nukleus reseptor intraselul, dan reseptor estrogen membran (mER) (GPER (GPR30), ER-X dan Gq-mER), yang kebanyakannya adalah reseptor bergandingan protein G. Rencana ini merujuk kepada jenis nukleus (ER).
Sebaik diaktifkan oleh estrogen, ER dapat bertranslokasi ke dalam nukleus dan mengikat DNA untuk mengawal aktiviti gen yang berbeza (yakni, selaku faktor transkripsi pengikat DNA). Walau bagaimanapun, ia juga mempunyai fungsi tambahan yang selain pengikatan DNA.[2]
Sebagai reseptor hormon steroid seks (reseptor hormon steroid), ER, reseptor androgen (AR), dan reseptor progesteron (PR) adalah penting dalam kematangan seksual dan kehamilan.
Proteomik[sunting | sunting sumber]
Terdapat dua bentuk reseptor estrogen yang berbeza, biasanya dirujuk sebagai α dan β yang dikodkan oleh gen yang berasingan (ESR1 dan ESR2, masing-masing). Reseptor estrogen yang diaktifkan oleh hormon membentuk dimer, dan, oleh kerana kedua-dua bentuk diekspresikan bersama dalam banyak jenis sel, reseptor boleh membentuk homodimer ERα (αα) atau ERβ (ββ) atau heterodimer ERαβ (αβ).[3] Reseptor estrogen alfa dan beta menunjukkan homologi jujukan keseluruhan yang ketara, dan kedua-duanya terdiri daripada lima domain yang ditetapkan A/B hingga F (disenaraikan dari terminal N- hingga C; nombor jujukan asid amino merujuk kepada ER manusia).
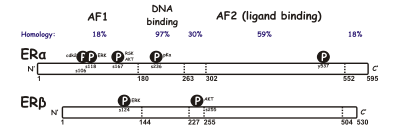
Domain terminal N A/B mampu mentransaktivasi transkripsi gen tanpa adanya ligan terikat (cth., hormon estrogen). Walaupun kawasan ini dapat mengaktifkan transkripsi gen tanpa ligan, pengaktifan ini lemah dan lebih berpilih berbanding dengan pengaktifan yang disediakan oleh domain E. Domain C, juga dikenali sebagai domain pengikat DNA, mengikat unsur tindak balas estrogen dalam DNA. Domain D ialah kawasan yang menghubungkan domain C dan E. Domain E mengandungi rongga pengikat ligan serta tapak pengikatan untuk protein kopengaktif dan korepresor. Domain E dengan kehadiran ligan terikat mampu mengaktifkan transkripsi gen. Fungsi domain terminal C F tidak jelas sepenuhnya, dan panjangnya berubah-ubah.[perlu rujukan]
Disebabkan penyambungan RNA alternatif, beberapa isoform ER diketahui wujud. Sekurang-kurangnya tiga isoform ERα dan lima ERβ telah dikenal pasti. Subjenis reseptor isoform ERβ boleh mentransaktivasi transkripsi hanya apabila heterodimer dengan reseptor ERß1 berfungsi sebanyak 59 kDa terbentuk. Reseptor ERß3 dikesan pada tahap tinggi dalam testis. Dua isoform ERα yang lain ialah 36 dan 46kDa.[4][5]
Hanya pada ikan, tetapi tidak pada manusia, reseptor ERγ telah ditemui.[6]
Genetik[sunting | sunting sumber]
Pada manusia, kedua-dua bentuk reseptor estrogen dikodkan oleh gen yang berbeza, ESR1 dan ESR2 pada kromosom 6 dan 14 (6q25.1 dan 14q23.2), masing-masing.
Pengagihan[sunting | sunting sumber]
Kedua-dua ER dinyatakan secara meluas dalam jenis tisu yang berbeza, namun terdapat beberapa perbezaan ketara dalam corak ekspresinya:[7]
- ERα terdapat dalam endometrium, sel kanser payudara, sel stroma ovari, dan hipotalamus.[8] Pada lelaki, protein ERα terdapat dalam epitelium saluran eferen.[9]
- Ekspresi protein ERβ telah didokumenkan dalam sel granulosa ovari, buah pinggang, otak, tulang, jantung,[10] paru-paru, mukosa usus, prostat, dan sel endotelium.
ERs dianggap sebagai reseptor sitoplasma dalam keadaan tidak terikatnya, tetapi penyelidikan visualisasi telah menunjukkan bahawa hanya sebahagian kecil daripada ER berada dalam sitoplasma, dengan kebanyakan ER secara berada dalam nukleus.[11] Transkrip utama "ERα" menimbulkan beberapa varian alternatif yang disambung dengan fungsi yang tidak diketahui.[12]
Ligan[sunting | sunting sumber]
Agonis[sunting | sunting sumber]
- Estrogen endogen (cth., estradiol, estron, estriol, estetrol)
- Estrogen semula jadi (cth., estrogen terkonjugasi)
- Estrogen sintetik (cth., etinilestradiol, dietilstilbestrol)
Campuran (mod tindakan agonis dan antagonis)[sunting | sunting sumber]
- Fitoestrogen (cth., koumestrol, daidzein, genistein, miroestrol)
- Pemodulat reseptor estrogen terpilih (cth, tamoksifen, klomifena, raloksifena)
Antagonis[sunting | sunting sumber]
- Antiestrogen (cth, fulvestran, ICI-164384, etamoksitrifetol)
Pemilihan ikatan dan kefungsian[sunting | sunting sumber]
Domain heliks 12 ER memainkan peranan penting dalam menentukan interaksi dengan kopengaktif dan korepresor dan, oleh itu, kesan agonis atau antagonis masing-masing ligan.[13][14]
Ligan yang berbeza mungkin berbeza dalam pengikatan mereka terhadap isoform alfa dan beta reseptor estrogen:
- estradiol mengikat sama baik kepada kedua-dua reseptor[15]
- estron dan raloksifena mengikat secara utamanya kepada reseptor alfa[15]
- estriol dan genistein kepada reseptor beta[15]
Subjenis pemodulat reseptor estrogen berpilih mengikat cenderung sama ada kepada subjenis α atau β reseptor. Di samping itu, kombinasi reseptor estrogen yang berbeza mungkin bertindak balas secara berbeza kepada pelbagai ligan, yang boleh diterjemahkan kepada kesan agonistik dan antagonis selektif tisu.[16] Nisbah kepekatan subjenis α kepada β telah dicadangkan untuk memainkan peranan dalam penyakit tertentu.[17]
Konsep pemodulat reseptor estrogen terpilih adalah berdasarkan keupayaan untuk menggalakkan interaksi ER dengan protein yang berbeza seperti kopengaktif atau korepresor transkripsi. Tambahan pula, nisbah kopengaktif kepada korepresor adalah berbeza-beza mengikut tisu.[18] Akibatnya, ligan yang sama mungkin merupakan agonis dalam sesetengah tisu (di mana kopengaktif mendominasi) tetapi menjadi antagonis dalam tisu lain di mana korepresor mendominasi. Tamoksifen sebagai contoh ialah antagonis dalam payudara dan, oleh itu, digunakan sebagai rawatan kanser payudara[19] tetapi menjadi agonis ER dalam tulang (dengan itu menghalang osteoporosis) dan agonis separa dalam endometrium (meningkatkan risiko kanser rahim).
Transduksi isyarat[sunting | sunting sumber]
Oleh kerana estrogen ialah hormon steroid, ia boleh melalui membran fosfolipid sel, dan oleh itu, reseptor tidak perlu mengikuat membran untuk mengikat dengan estrogen.
Genomik[sunting | sunting sumber]
Dengan ketiadaan hormon, reseptor estrogen sebahagian besarnya terletak di sitosol. Pengikatan hormon kepada reseptor mencetuskan beberapa peristiwa, bermula dengan penghijrahan reseptor daripada sitosol ke dalam nukleus, pendimeran reseptor, dan pengikatan seterusnya dimer reseptor kepada urutan spesifik DNA yang dikenali sebagai unsur tindak balas hormon. Kompleks DNA/reseptor kemudiannya merekrut protein lain yang bertanggungjawab dalamtranskripsi hiliran DNA menjadi mRNA, dan akhirnya protein yang mengakibatkan perubahan dalam fungsi sel. Reseptor estrogen juga berlaku dalam nukleus sel, dan kedua-dua subjenis reseptor estrogen mempunyai domain pengikat DNA dan boleh berfungsi sebagai faktor transkripsi untuk mengawal pengeluaran protein.
Reseptor juga berinteraksi dengan protein pengaktif 1 dan Sp-1 untuk mempromosikan transkripsi, melalui beberapa kopengaktif seperti PELP-1.[2]
Pengasetilan langsung reseptor alfa di residu lisina di kawasan engsel oleh p300 mengawal transaktivasi dan sensitiviti hormon.[20]
Bukan genomik[sunting | sunting sumber]
Sesetengah reseptor estrogen dikaitkan dengan membran permukaan sel, dan boleh diaktifkan dengan cepat dengan pendedahan sel kepada estrogen.[21][22]
Di samping itu, sesetengah ER boleh dikaitkan dengan membran sel dengan melekat pada kaveolin-1 dan membentuk kompleks dengan protein G, striatin, kinase tirosina reseptor (cth, EGFR dan IGF-1), dan kinase tirosina bukan reseptor (cth, Src).[2][21] Melalui striatin, sebahagian daripada ER terikat membran ini boleh menyebabkan peningkatan tahap Ca2+ dan nitrik oksida (NO).[23] Melalui kinase tirosina reseptor, isyarat dihantar ke nukleus melalui laluan kinase protein diaktifkan mitogen (MAPK/ERK) dan laluan fosfoinositida 3-kinase (Pl3K/AKT).[24] Kinase sintase glikogen 3 (GSK)-3β menghalang transkripsi oleh ER nuklear dengan menghalang pemfosforilan serina 118 nukleus ERα. Pemfosforilan GSK-3β menghilangkan kesan perencatannya, dan ini boleh dicapai dengan laluan PI3K/AKT dan laluan MAPK/ERK, melalui rsk.
17β-Estradiol telah ditunjukkan untuk mengaktifkan reseptor bergandingan protein G, GPR30.[25] Walau bagaimanapun, penyetempatan subselular dan peranan reseptor ini masih menjadi bahan perdebatan.[26]
Perbezaan dan kerosakan[sunting | sunting sumber]


Barah[sunting | sunting sumber]
Reseptor estrogen diekspresikan secara berlebihan dalam sekitar 70% kes barah payudara, dirujuk sebagai "positif ER", dan boleh ditunjukkan dalam tisu tersebut menggunakan imunohistokimia. Dua hipotesis telah dicadangkan untuk menjelaskan mengapa ini menyebabkan tumorigenesis, dan bukti yang ada menunjukkan bahawa kedua-dua mekanisme menyumbang:
- Pertama, pengikatan estrogen kepada ER merangsang percambahan sel mamari, dengan peningkatan yang terhasil dalam pembahagian sel dan replikasi DNA, yang membawa kepada mutasi.
- Kedua, metabolisme estrogen menghasilkan sisa genotoksik.
Hasil daripada kedua-dua proses adalah gangguan kitaran sel, apoptosis dan pembaikian DNA lalu meningkatkan peluang pembentukan tumor. ERα pastinya dikaitkan dengan tumor yang lebih berbeza, manakala bukti bahawa ERβ terlibat adalah dalam perdebatan. Versi gen ESR1 yang berbeza telah dikenal pasti (dengan polimorfisme nukleotida tunggal) dan dikaitkan dengan risiko yang berbeza untuk mendapat kanser payudara.[19]
Estrogen dan ER juga telah terlibat dalam barah payudara, ovari, kolon, prostat dan endometrium. Barah kolon lanjutan dikaitkan dengan kehilangan ERβ, ER utama dalam tisu kolon, dan kanser kolon dirawat dengan agonis khusus ERβ.[27]
Terapi endokrin untuk kanser payudara melibatkan pemodulat reseptor estrogen berpilih (SERM), seperti tamoksifen yang berkelakuan sebagai antagonis ER dalam tisu payudara, atau perencat aromatase, seperti anastrozola. Status ER digunakan untuk menentukan sensitiviti lesi kanser payudara kepada tamoksifen dan perencat aromatase.[28] Satu lagi SERM, raloksifena, telah digunakan sebagai kemoterapi pencegahan bagi wanita yang dinilai mempunyai risiko tinggi mendapat kanser payudara.[29] Satu lagi antiestrogen kemoterapi, ICI 182,780 (Faslodex), yang bertindak sebagai antagonis lengkap, juga menggalakkan penguaraian reseptor estrogen.
Walau bagaimanapun, rintangan de novo terhadap terapi endokrin menjejaskan keberkesanan penggunaan perencat berpersaingan seperti tamoksifen. Kekurangan hormon melalui penggunaan perencat aromatase juga menjadi sia-sia.[30] Penjujukan genom selari secara besar-besaran telah mendedahkan kehadiran biasa mutasi titik pada ESR1 yang merupakan pemacu untuk rintangan, dan menggalakkan konformasi agonis ERα tanpa ligan terikat. Aktiviti bebas estrogen konstitutif sedemikian didorong oleh mutasi tertentu seperti mutasi D538G atau Y537S/C/N dalam domain pengikat ligan ESR1, dan menggalakkan percambahan sel dan perkembangan tumor tanpa rangsangan hormon.[31]
Menopaus[sunting | sunting sumber]
Kesan metabolik estrogen dalam wanita menopaus telah dikaitkan dengan polimorfisme genetik ER-β.[32]
Penuaan[sunting | sunting sumber]
Kajian ke atas tikus betina telah menunjukkan bahawa reseptor alfa menurun dalam hipotalamus praoptik apabila mereka semakin tua. Tikus betina yang diberi diet kalori terhad semasa sebahagian besar hidup mereka mengekalkan tahap ERα yang lebih tinggi dalam hipotalamus praoptik berbanding tikus tanpa sekatan kalori.[8]
Obesiti[sunting | sunting sumber]
Demonstrasi dramatik tentang kepentingan estrogen dalam pengawalan pemendapan lemak datang daripada tikus transgenik yang direka bentuk secara genetik agar ketiadaan gen aromatase yang berfungsi. Tikus ini mempunyai tahap estrogen yang sangat rendah dan obes.[33] Obesiti juga diperhatikan pada tikus betina kekurangan estrogen yang tidak mempunyai reseptor hormon perangsang folikel.[34] Kesan estrogen rendah pada peningkatan obesiti telah dikaitkan dengan reseptor alfa.[35]
SERM untuk tujuan rawatan lain[sunting | sunting sumber]
SERM juga sedang dikaji dalam rawatan fibroid rahim[36] dan endometriosis.[37]
Sindrom ketidakpekaan estrogen[sunting | sunting sumber]
Sindrom ketidakpekaan estrogen (EIS) ialah keadaan interseks yang jarang berlaku dengan hanya lima kes yang dilaporkan, di mana reseptor estrogen tidak berfungsi. Fenotip menghasilkan maskulinisasi yang meluas. Tidak seperti sindrom ketidakpekaan androgen (AIS), EIS tidak menyebabkan pembalikan jantina fenotip. Ia sangat jarang berlaku dan merupakan analog kepada AIS, dan bentuk hiperplasia adrenal. Sebab mengapa AIS adalah perkara biasa dan EIS sangat jarang berlaku ialah XX AIS tidak mengakibatkan ketidaksuburan, dan oleh itu boleh diwarisi melalui ibu, manakala EIS sentiasa mengakibatkan ketidaksuburan tanpa mengira kariotip. Suap balas negatif antara sistem endokrin juga berlaku dalam EIS, di mana gonad menghasilkan tahap estrogen yang ketara lebih tinggi untuk individu dengan EIS (119–272 pg/mL XY dan 750-3,500 pg/mL XX, lihat tahap purata), tetapi tanpa kesan feminisasi.[38][39]
Penemuan[sunting | sunting sumber]
Reseptor estrogen pertama kali dikenal pasti oleh Elwood V. Jensen di Universiti Chicago pada tahun 1958,[40][41] yang mana Jensen telah dianugerahkan Anugerah Lasker.[42] Gen reseptor estrogen kedua (ERβ) telah dikenal pasti pada tahun 1996 oleh Kuiper et al. dalam prostat tikus dan ovari menggunakan primer ER alpha merosot.[43]
Rujukan[sunting | sunting sumber]
- ^ "International Union of Pharmacology. LXIV. Estrogen receptors". Pharmacological Reviews. 58 (4): 773–81. Dec 2006. doi:10.1124/pr.58.4.8. PMID 17132854.
- ^ a b c "Integration of the extranuclear and nuclear actions of estrogen". Molecular Endocrinology. 19 (8): 1951–9. Aug 2005. doi:10.1210/me.2004-0390. PMC 1249516. PMID 15705661.
- ^ "Single-chain estrogen receptors (ERs) reveal that the ERalpha/beta heterodimer emulates functions of the ERalpha dimer in genomic estrogen signaling pathways". Molecular and Cellular Biology. 24 (17): 7681–94. Sep 2004. doi:10.1128/MCB.24.17.7681-7694.2004. PMC 506997. PMID 15314175.
- ^ "Mechanisms of estrogen action". Physiological Reviews. 81 (4): 1535–65. Oct 2001. doi:10.1152/physrev.2001.81.4.1535. PMID 11581496.
- ^ "Estrogen receptor (ER)-beta isoforms: a key to understanding ER-beta signaling". Proceedings of the National Academy of Sciences of the United States of America. 103 (35): 13162–7. Aug 2006. Bibcode:2006PNAS..10313162L. doi:10.1073/pnas.0605676103. PMC 1552044. PMID 16938840.
- ^ "Identification of a third distinct estrogen receptor and reclassification of estrogen receptors in teleosts". Proceedings of the National Academy of Sciences of the United States of America. 97 (20): 10751–6. Sep 2000. Bibcode:2000PNAS...9710751H. doi:10.1073/pnas.97.20.10751. PMC 27095. PMID 11005855.
- ^ "Tissue distribution and quantitative analysis of estrogen receptor-alpha (ERalpha) and estrogen receptor-beta (ERbeta) messenger ribonucleic acid in the wild-type and ERalpha-knockout mouse". Endocrinology. 138 (11): 4613–21. Nov 1997. doi:10.1210/en.138.11.4613. PMID 9348186.
- ^ a b "Caloric restriction reduces cell loss and maintains estrogen receptor-alpha immunoreactivity in the pre-optic hypothalamus of female B6D2F1 mice" (PDF). Neuro Endocrinology Letters. 26 (3): 197–203. Jun 2005. PMID 15990721.
- ^ "Estrogen in the adult male reproductive tract: a review". Reproductive Biology and Endocrinology. 1 (52): 52. Jul 2003. doi:10.1186/1477-7827-1-52. PMC 179885. PMID 12904263.
- ^ "Estrogenic hormone action in the heart: regulatory network and function". Cardiovascular Research. 53 (3): 709–19. Feb 2002. doi:10.1016/S0008-6363(01)00526-0. PMID 11861041.
- ^ "Direct visualization of the human estrogen receptor alpha reveals a role for ligand in the nuclear distribution of the receptor". Molecular Biology of the Cell. 10 (2): 471–86. Feb 1999. doi:10.1091/mbc.10.2.471. PMC 25181. PMID 9950689.
- ^ "Coexpression of multiple estrogen receptor variant messenger RNAs in normal and neoplastic breast tissues and in MCF-7 cells". Cancer Research. 55 (10): 2158–65. May 1995. PMID 7743517.
- ^ "Structure-function relationship of estrogen receptor alpha and beta: impact on human health". Molecular Aspects of Medicine. 27 (4): 299–402. Aug 2006. doi:10.1016/j.mam.2006.07.001. PMID 16914190.
- ^ "Nuclear receptor ligand-binding domains: three-dimensional structures, molecular interactions and pharmacological implications". Trends in Pharmacological Sciences. 21 (10): 381–8. Oct 2000. doi:10.1016/S0165-6147(00)01548-0. PMID 11050318.
- ^ a b c "Quantitative structure-activity relationship of various endogenous estrogen metabolites for human estrogen receptor alpha and beta subtypes: Insights into the structural determinants favoring a differential subtype binding". Endocrinology. 147 (9): 4132–50. Sep 2006. doi:10.1210/en.2006-0113. PMID 16728493.
- ^ "Differential effects of estrogen receptor antagonists on pituitary lactotroph proliferation and prolactin release". Molecular and Cellular Endocrinology. 239 (1–2): 27–36. Jul 2005. doi:10.1016/j.mce.2005.04.008. PMID 15950373.
- ^ "Estrogen receptor alpha and beta in uterine fibroids: a basis for altered estrogen responsiveness". Fertility and Sterility. 90 (5): 1878–85. Nov 2008. doi:10.1016/j.fertnstert.2007.09.019. PMID 18166184.
|hdl-access=requires|hdl=(bantuan) - ^ "Molecular determinants for the tissue specificity of SERMs". Science. 295 (5564): 2465–8. Mar 2002. Bibcode:2002Sci...295.2465S. doi:10.1126/science.1068537. PMID 11923541.
- ^ a b "Estrogen receptors and human disease". The Journal of Clinical Investigation. 116 (3): 561–70. Mar 2006. doi:10.1172/JCI27987. PMC 2373424. PMID 16511588.
- ^ "Direct acetylation of the estrogen receptor alpha hinge region by p300 regulates transactivation and hormone sensitivity". The Journal of Biological Chemistry. 276 (21): 18375–83. May 2001. doi:10.1074/jbc.M100800200. PMID 11279135.
- ^ a b "Membrane estrogen receptor-alpha levels in MCF-7 breast cancer cells predict cAMP and proliferation responses". Breast Cancer Research. 7 (1): R101–12. 2005. doi:10.1186/bcr958. PMC 1064104. PMID 15642158.
- ^ "Estrogen receptor-dependent activation of AP-1 via non-genomic signalling". Nuclear Receptor. 2 (1): 3. Jun 2004. doi:10.1186/1478-1336-2-3. PMC 434532. PMID 15196329.
- ^ "Striatin assembles a membrane signaling complex necessary for rapid, nongenomic activation of endothelial NO synthase by estrogen receptor alpha". Proceedings of the National Academy of Sciences of the United States of America. 101 (49): 17126–31. Dec 2004. Bibcode:2004PNAS..10117126L. doi:10.1073/pnas.0407492101. PMC 534607. PMID 15569929.
- ^ "Activation of the estrogen receptor through phosphorylation by mitogen-activated protein kinase". Science. 270 (5241): 1491–4. Dec 1995. Bibcode:1995Sci...270.1491K. doi:10.1126/science.270.5241.1491. PMID 7491495.
- ^ "GPR30: A G protein-coupled receptor for estrogen". Molecular and Cellular Endocrinology. 265–266: 138–42. Feb 2007. doi:10.1016/j.mce.2006.12.010. PMC 1847610. PMID 17222505.
- ^ "G protein-coupled receptor 30 localizes to the endoplasmic reticulum and is not activated by estradiol". Endocrinology. 149 (10): 4846–56. Oct 2008. doi:10.1210/en.2008-0269. PMID 18566127.
- ^ "Evaluation of an estrogen receptor-beta agonist in animal models of human disease". Endocrinology. 144 (10): 4241–9. Oct 2003. doi:10.1210/en.2003-0550. PMID 14500559.
- ^ "Tamoxifen ("Nolvadex"): a review". Cancer Treatment Reviews. 28 (4): 165–80. Aug 2002. doi:10.1016/s0305-7372(02)00036-1. PMID 12363457.
- ^ "Selective estrogen-receptor modulators for primary prevention of breast cancer". Journal of Clinical Oncology. 23 (8): 1644–55. Mar 2005. doi:10.1200/JCO.2005.11.005. PMID 15755972.
- ^ "The search for ESR1 mutations in breast cancer". Nature Genetics. 45 (12): 1415–6. Dec 2013. doi:10.1038/ng.2831. PMC 4934882. PMID 24270445.
- ^ "Endocrine-therapy-resistant ESR1 variants revealed by genomic characterization of breast-cancer-derived xenografts". Cell Reports. 4 (6): 1116–30. Sep 2013. doi:10.1016/j.celrep.2013.08.022. PMC 3881975. PMID 24055055. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Effect of estrogen receptor β A1730G polymorphism on ABCA1 gene expression response to postmenopausal hormone replacement therapy". Genetic Testing and Molecular Biomarkers. 15 (1–2): 11–5. 2011. doi:10.1089/gtmb.2010.0106. PMID 21117950.
- ^ "The aromatase knockout mouse presents with a sexually dimorphic disruption to cholesterol homeostasis". Endocrinology. 144 (9): 3895–903. Sep 2003. doi:10.1210/en.2003-0244. PMID 12933663.
- ^ "Estrogen deficiency, obesity, and skeletal abnormalities in follicle-stimulating hormone receptor knockout (FORKO) female mice". Endocrinology. 141 (11): 4295–308. Nov 2000. doi:10.1210/endo.141.11.7765. PMID 11089565.
- ^ "Obesity and disturbed lipoprotein profile in estrogen receptor-alpha-deficient male mice". Biochemical and Biophysical Research Communications. 278 (3): 640–5. Nov 2000. doi:10.1006/bbrc.2000.3827. PMID 11095962.
- ^ Lingxia, X; Taixiang, W; Xiaoyan, C (2007). "Selective Estrogen Receptor Modulators (Serms) for Uterine Leiomyomas". Cochrane Database of Systematic Reviews (2): CD005287. doi:10.1002/14651858.cd005287.pub2. PMID 17443581.
- ^ van Hoesel, Maaike HT; Chen, Ya Li; Zheng, Ai; Wan, Qi; Mourad, Selma M (2021-05-11). Cochrane Gynaecology and Fertility Group (penyunting). "Selective oestrogen receptor modulators (SERMs) for endometriosis". Cochrane Database of Systematic Reviews (dalam bahasa Inggeris). 2021 (5): CD011169. doi:10.1002/14651858.CD011169.pub2. PMC 8130989. PMID 33973648.
- ^ Thomas L. Lemke; David A. Williams (24 January 2012). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. m/s. 1392–. ISBN 978-1-60913-345-0.
- ^ "Estrogen resistance caused by a mutation in the estrogen-receptor gene in a man". The New England Journal of Medicine. 331 (16): 1056–61. October 1994. doi:10.1056/NEJM199410203311604. PMID 8090165.
- ^ "The estrogen receptor: a model for molecular medicine" (abstract). Clinical Cancer Research. 9 (6): 1980–9. Jun 2003. PMID 12796359.
- ^ "A conversation with Elwood Jensen. Interview by David D. Moore". Annual Review of Physiology. 74: 1–11. 2011. doi:10.1146/annurev-physiol-020911-153327. PMID 21888507.
- ^ David Bracey, 2004 "UC Scientist Wins 'American Nobel' Research Award." University of Cincinnati press release.
- ^ "Cloning of a novel receptor expressed in rat prostate and ovary". Proceedings of the National Academy of Sciences of the United States of America. 93 (12): 5925–30. Jun 1996. doi:10.1073/pnas.93.12.5925. PMC 39164. PMID 8650195.
