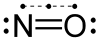Nitrik oksida

| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Nitrogen monoksida
| |||
| Nama IUPAC sistematik
Oksidonitrogen(•)[1] | |||
| Nama lain
Nitrogen(II) oksida
| |||
| Pengecam | |||
Imej model 3D Jmol
|
|||
| 3DMet | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.030.233 | ||
| Nombor EC |
| ||
| 451 | |||
| KEGG | |||
PubChem CID
|
|||
| Nombor RTECS |
| ||
| UNII | |||
| Nombor PBB | 1660 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| NO | |||
| Jisim molar | 30.01 g·mol−1 | ||
| Rupa bentuk | Gas tidak berwarna | ||
| Ketumpatan | 1.3402 g dm−3 | ||
| Takat lebur | −164 °C (−263 °F; 109 K) | ||
| Takat didih | −152 °C (−242 °F; 121 K) | ||
| 0.0098 g/100ml (0 °C) 0.0056 g/100ml (20 °C) | |||
Indeks biasan (nD)
|
1.0002697 | ||
| Struktur | |||
| Bentuk molekul | Linear (C∞v) | ||
| Termokimia | |||
| Entropi molar piawai S |
210.76 J K−1 mol−1 | ||
Entalpi pembentukan
piawai (ΔfH⦵298) |
91.29 kJ mol−1 | ||
| Bahaya | |||
| MSDS | External MSDS | ||
| Pengelasan EU | {{{value}}} | ||
| Frasa R | Templat:R8, Templat:R23, Templat:R34, R44 | ||
| Frasa S | Templat:S1, Templat:S17, Templat:S23, S36/37/39, S45 | ||
| NFPA 704 (berlian api) | |||
| Dos maut (LD) atau kepekatan dos maut (LC) | |||
LC50 (median kepekatan)
|
315 ppm (arnab, 15 min) 854 ppm (tikus, 4 hr)[2] | ||
LCLo (paling rendah diketahui)
|
320 ppm (tikus)[2] | ||
| Sebatian berkaitan | |||
Oksida nitrogen berkaitan
|
Dinitrogen pentoksida Dinitrogen tetroksida | ||
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |||
| | |||
| Rujukan kotak info | |||
Nitrik oksida (nitrogen oksida[3] atau nitrogen monoksida) merupakan sebatian kimia gas dengan formula kimia NO dan merupakan salah satu daripada oksida-oksida nitrogen. Sebatian ini juga merupakan radikal bebas dan boleh diwakili dengan formula kimia ·NO.
Nitrik oksida boleh terhasil melalui kilat dalam ribut petir dan dalam proses pembakaran. Selain itu, nitrik oksida merupakan molekul pengisyaratan dalam proses fisiologi dan patologi mamalia, termasuk manusia.[4]
Penghasilan
[sunting | sunting sumber]Dalam bidang komersial, nitrik oksida boleh dihasilkan melalui proses pengoksidaan ammonia dengan platinum sebagai mangkin pada suhu 750–900 °C (biasanya pada 850°C).
- 4 NH3 + 5 O2 → 4 NO + 6 H2O
Dalam makmal pula, nitrik oksida boleh dihasilkan dengan mudah melalui proses penurunan asid nitrik dengan kuprum.
- 8 HNO3 + 3 Cu → 3 Cu(NO3)2 + 4 H2O + 2 NO
Rujukan
[sunting | sunting sumber]- ^ "Nitric Oxide (CHEBI:16480)". Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute.
- ^ a b "Nitric oxide". Immediately Dangerous to Life or Health Concentrations (IDLH). Institut Kebangsaan untuk Keselamatan dan Kesihatan Pekerjaan (NIOSH).
- ^ Hou, YC; Janczuk, A; Wang, PG (1999). "Current trends in the development of nitric oxide donors". Current Pharmaceutical Design. 5 (6): 417–41. PMID 10390607.