Reseptor bergandingan protein G
| GPCR | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Pengenal pasti | |||||||||
| Simbol | 7tm_1 | ||||||||
| Pfam | PF00001 | ||||||||
| InterPro | IPR000276 | ||||||||
| PROSITE | PDOC00210 | ||||||||
| TCDB | 9.A.14 | ||||||||
| Superkeluarga OPM | 6 | ||||||||
| Protein OPM | 1gzm | ||||||||
| CDD | cd14964 | ||||||||
| |||||||||
Reseptor bergandingan protein G (GPCR), juga dikenali sebagai reseptor domain tujuh-(rentas)-transmembran, reseptor 7TM, reseptor heptaheliks, reseptor serpentin dan reseptor bersambungan protein G (GPLR), membentuk sekumpulan besar protein berkaitan evolusi, ialah reseptor permukaan sel yang mengesan molekul di luar sel dan mengaktifkan tindak balas selular. Ia digandingkan dengan protein G. Ia melalui membran sel tujuh kali dalam bentuk enam gelung[2] (tiga gelung ekstraselular yang berinteraksi dengan molekul ligan, tiga gelung intrasel yang berinteraksi dengan protein G, kawasan ekstraselular terminal N, dan kawasan intrasel terminal C[2]) sisa asid amino; inilah sebabnya ia kadangkala dirujuk sebagai reseptor tujuh transmembran.[3] Ligannya boleh mengikat sama ada pada terminal N luar sel dan gelung (cth., reseptor glutamat) atau pada tapak pengikatan dalam heliks transmembran (keluarga seperti rodopsin). Kesemuanya diaktifkan oleh agonis, walaupun pengaktifan autospontan reseptor kosong juga telah diperhatikan.[3]
Reseptor bergandingan protein G hanya terdapat dalam eukariot, termasuk yis, dan koanoflagellat.[4] Ligan yang mengikat dan mengaktifkan reseptor ini termasuk sebatian peka cahaya, bau, feromon, hormon dan neurotransmiter, dan berbeza dalam saiz daripada molekul kecil kepada peptida kepada protein besar. Reseptor bergandingan protein G terlibat dalam banyak penyakit.
Terdapat dua laluan transduksi isyarat utama yang melibatkan reseptor bergandingan protein G:
- laluan isyarat cAMP dan
- laluan isyarat fosfatidilinositol.[5]
Apabila ligan mengikat GPCR, ia menyebabkan perubahan konformasi dalam GPCR yang membolehkan ia bertindak sebagai faktor pertukaran nukleotida guanina (GEF). GPCR kemudiannya boleh mengaktifkan protein G yang berkaitan dengan menukar GDP yang terikat kepada protein G bagi sebuah GTP. Subunit α protein G, bersama-sama dengan GTP terikat, kemudiannya boleh berpisah daripada subunit β dan γ untuk terus memberi kesan terhadap protein isyarat intrasel atau menyasarkan protein berfungsi secara terus, bergantung kepada jenis subunit α (Gαs, Gαi/o, Gαq/11, Gα12/13).[6]:1160
GPCR ialah sasaran ubat yang penting dan kira-kira 34%[7] daripada semua ubat yang diluluskan Pentadbiran Makanan dan Ubat (FDA) menyasarkan 108 ahli keluarga ini. Jumlah jualan global untuk ubat-ubatan ini dianggarkan sebanyak 180 bilion dolar AS setakat 2018.[7] Dianggarkan bahawa GPCR adalah sasaran bagi kira-kira 50% ubat-ubatan yang sedang berada di pasaran, terutamanya disebabkan penglibatan mereka dalam laluan isyarat yang berkaitan dengan banyak penyakit iaitu mental, metabolik termasuk gangguan endokrinologi, imunologi termasuk jangkitan virus, kardiovaskular, keradangan, gangguan deria, dan kanser. Perkaitan yang telah lama ditemui antara GPCR dan banyak bahan endogen dan eksogen, yang mengakibatkan masalah seperti analgesia, ialah satu lagi bidang penyelidikan farmaseutikal yang sedang berkembang secara dinamik.
Sejarah dan kepentingan[sunting | sunting sumber]
Dengan penentuan struktur pertama kompleks antara reseptor berganding protein G (GPCR) dan trimer protein G (Gαβγ) pada 2011, satu bab baharu dalam penyelidikan GPCR dibuka bagi penyiasatan struktur suis global dengan lebih daripada satu protein sedang disiasat. Penemuan sebelumnya melibatkan penentuan struktur kristal GPCR pertama, rodopsin, pada 2000, dan struktur kristal GPCR pertama dengan ligan boleh resapan (β2AR) pada 2007. Cara tujuh heliks transmembran GPCR disusun menjadi satu berkas disyaki berdasarkan model resolusi rendah rodopsin katak daripada kajian mikroskop elektron kriogenik bagi kristal dua dimensi. Struktur kristal rodopsin yang muncul tiga tahun kemudian bukanlah sesuatu yang mengejutkan selain daripada kehadiran heliks sitoplasma tambahan H8 dan lokasi tepat gelung yang meliputi tapak pengikat retina. Walau bagaimanapun, ia menyediakan perancah yang diharapkan menjadi templat universal bagi pemodelan homologi dan reka bentuk ubat untuk GPCR lain - tanggapan yang terbukti terlalu optimistik.
Tujuh tahun kemudian, penghabluran reseptor β2-adrenergik (β2AR) dengan ligan boleh resap membawa hasil yang mengejutkan kerana ia mendedahkan bentuk yang agak berbeza dari sisi ekstrasel reseptor daripada rodopsin. Kawasan ini penting kerana ia bertanggungjawab bagi pengikatan ligan, dan disasarkan oleh banyak ubat. Selain itu, tapak pengikat ligan jauh lebih luas daripada dalam struktur rodopsin dan terbuka ke bahagian luar. Dalam reseptor lain terhablur tidak lama selepas itu bahagian pengikat lebih mudah diakses oleh ligan. Struktur baharu yang dilengkapi dengan penyiasatan biokimia menemui mekanisme tindakan suis molekul yang memodulasi struktur reseptor yang membawa kepada keadaan pengaktifan untuk agonis atau untuk melengkapkan atau keadaan penyahaktifan separa bagi agonis songsang.
Hadiah Nobel dalam Kimia 2012 telah dianugerahkan kepada Brian Kobilka dan Robert Lefkowitz bagi kerja mereka yang "penting untuk memahami cara reseptor bergandingan protein G berfungsi".[8] Terdapat sekurang-kurangnya tujuh Hadiah Nobel lain yang dianugerahkan untuk beberapa aspek isyarat pengantara protein G. Sehingga 2012, dua daripada sepuluh ubat terlaris global (Advair Diskus dan Abilify) bertindak dengan menyasarkan reseptor yang digabungkan dengan protein G.[9]
Pengelasan[sunting | sunting sumber]
Saiz sebenar superfamili GPCR tidak diketahui, tetapi sekurang-kurangnya 831 gen manusia yang berbeza (atau kira-kira 4% daripada keseluruhan genom pengekodan) telah diramalkan untuk mengekodkannya daripada analisis jujukan genom.[10][11] Walaupun banyak skema klasifikasi telah dicadangkan, superkeluarga secara klasik dibahagikan kepada tiga kelas utama (A, B, dan C) tanpa homologi jujukan dikongsi antara kelas.
Kelas terbesar setakat ini ialah kelas A yang menyumbang hampir 85% daripada gen GPCR. Dari kelas A GPCR, lebih separuh daripada ini diramalkan mengekod reseptor bau, manakala reseptor selebihnya diikat oleh sebatian endogen yang diketahui atau dikelaskan sebagai reseptor yatim. Walaupun kekurangan homologi jujukan antara kelas, semua GPCR mempunyai struktur dan mekanisme transduksi isyarat yang sama. Kumpulan rodopsin A yang sangat besar telah dibahagikan lagi kepada 19 subkumpulan (A1-A19).[12]
Menurut sistem AF klasik, GPCR boleh dikumpulkan kepada enam kelas berdasarkan homologi jujukan dan persamaan fungsi:[13][14][15][16]
- Kelas A (atau 1) (seperti rodopsin)
- Kelas B (atau 2) (keluarga reseptor sekretin)
- Kelas C (atau 3) (glutamat metabotropik / feromon)
- Kelas D (atau 4) (Reseptor feromon mengawan kulat)
- Kelas E (atau 5) (Reseptor AMP siklik)
- Kelas F (atau 6) (Smoothened / Frizzled)
Baru-baru ini, sistem pengelasan alternatif yang dipanggil GRAFS (Glutamat, Rodopsin,<i id="mwsw">Adhesion</i>, Frizzled / Taste2, Secretin) telah dicadangkan buat GPCR vertebrata.[10] Mereka sepadan dengan kelas klasik C, A, B2, F, dan B.[17]
Kajian awal berdasarkan jujukan DNA yang tersedia mencadangkan bahawa genom manusia mengekodkan kira-kira 750 buah GPCR,[18] kira-kira 350 daripadanya mengesan hormon, faktor pertumbuhan, dan ligan endogen yang lain. Kira-kira 150 daripada GPCR yang terdapat dalam genom manusia mempunyai fungsi yang tidak diketahui.
Beberapa pelayan web[19] dan kaedah ramalan bioinformatik[20][21] telah digunakan untuk meramalkan klasifikasi GPCR mengikut urutan asid aminonya sahaja, melalui pendekatan komposisi asid amino pseudo.
Peranan fisiologi[sunting | sunting sumber]
GPCR terlibat dalam pelbagai proses fisiologi. Beberapa contoh peranan fisiologi mereka termasuk:
- Deria visual: Opsin menggunakan tindak balas fotoisomerisasi untuk menterjemah sinaran elektromagnet menjadi isyarat sel. Rodopsin sebagai contoh menggunakan penukaran 11-cis-retinal kepada all-trans-retinal untuk tujuan ini.
- Deria rasa: GPCR dalam sel rasa mengantara pembebasan gustdusin sebagai tindak balas kepada bahan rasa pahit, umami dan manis.
- Deria bau: Reseptor epitelium olfaktori mengikat bahan bau (reseptor olfaktori) dan feromon (reseptor vomeronasal)
- Peraturan tingkah laku dan mood: Reseptor dalam otak mamalia mengikat beberapa neurotransmiter yang berbeza, termasuk serotonin, dopamina, histamin, GABA dan glutamat
- Pengawalseliaan aktiviti sistem imun dan keradangan: reseptor kemokin mengikat ligan yang menjadi pengantara komunikasi antara sel-sel sistem imun; reseptor seperti reseptor histamin mengikat mediator inflamasi dan melibatkan jenis sel sasaran dalam tindak balas keradangan. GPCR juga terlibat dalam modulasi imun, contohnya mengawal induksi interleukin[22] atau menyekat tindak balas imun yang disebabkan oleh TLR daripada sel T.[23]
- Penghantaran sistem saraf autonomi: Kedua-dua sistem saraf simpatetik dan parasimpatetik dikawal oleh laluan GPCR, bertanggungjawab untuk mengawal banyak fungsi automatik badan seperti tekanan darah, denyutan jantung dan proses pencernaan
- Penderiaan ketumpatan sel: Peranan GPCR baru dalam mengawal penderiaan ketumpatan sel.
- Modulasi homeostasis (cth, keseimbangan air).[24]
- Terlibat dalam pertumbuhan dan metastasis beberapa jenis tumor.[25]
- Digunakan dalam sistem endokrin untuk hormon derivatif peptida dan asid amino yang mengikat GCPR pada membran sel sel sasaran. Ini mengaktifkan cAMP, yang seterusnya mengaktifkan beberapa kinase, membolehkan tindak balas selular, seperti transkripsi.
Struktur reseptor[sunting | sunting sumber]
GPCR ialah protein membran integral yang mempunyai tujuh domain yang merentasi membran atau heliks transmembran.[26][27] Bahagian ekstrasel pada reseptor boleh diglikosilasi. Gelung ekstraselular ini juga mengandungi dua sisa sisteina yang sangat terpelihara yang membentuk ikatan disulfida untuk menstabilkan struktur reseptor. Beberapa protein heliks tujuh transmembran (rodopsin saluran) yang menyerupai GPCR mungkin mengandungi saluran ion dalam proteinnya.
Pada tahun 2000, struktur kristal pertama GPCR mamalia, iaitu rodopsin lembu (1F88) telah ditemui dan diselesaikan.[28] Pada tahun 2007, struktur pertama GPCR manusia telah diselesaikan.[29][1][30] Struktur GPCR reseptor β2-adrenergik manusia ini terbukti sangat serupa dengan rodopsin lembu. Struktur GPCR yang diaktifkan atau terikat agonis juga telah ditentukan.[31][32][33][34] Struktur ini menunjukkan bagaimana ligan mengikat pada bahagian ekstraselular reseptor membawa kepada perubahan konformasi di bahagian sitoplasma reseptor. Perubahan terbesar ialah pergerakan keluar bahagian sitoplasma heliks transmembran ke-5 dan ke-6 (TM5 dan TM6). Struktur reseptor adrenergik beta-2 yang diaktifkan dalam kompleks dengan Gs mengesahkan bahawa Gα mengikat kepada rongga yang dicipta oleh pergerakan ini.[35]
GPCR mempamerkan struktur yang serupa dengan beberapa protein lain dengan tujuh domain transmembran, seperti rodopsin mikrob dan reseptor adiponektin 1 dan 2 (ADIPOR1 dan ADIPOR2). Walau bagaimanapun, reseptor dan saluran 7TMH (7 heliks transmembran) ini tidak dikaitkan dengan protein G. Selain itu, ADIPOR1 dan ADIPOR2 berorientasikan bertentangan dengan GPCR dalam membran (iaitu GPCR biasanya mempunyai terminal N ekstraselular, terminal C sitoplasma, manakala ADIPOR pula terbalik).[36]
Hubungan struktur-fungsi[sunting | sunting sumber]

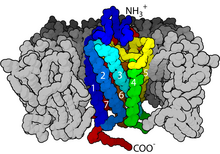
Dari segi struktur, GPCR dicirikan oleh terminal N ekstrasel, diikuti oleh tujuh transmembran (7-TM) α-heliks (TM-1 hingga TM-7) yang disambungkan oleh tiga gelungan intrasel (IL-1 hingga IL-3) serta tiga gelungan ekstrasel (EL-1 hingga EL-3), dan akhirnya terminal C intrasel. GPCR menyusun dirinya menjadi struktur tertier yang menyerupai tong dengan tujuh heliks transmembran membentuk rongga dalam membran plasma yang berfungsi sebagai domain pengikat ligan yang sering diliputi oleh EL-2. Ligan juga boleh mengikat di tempat lain, walau bagaimanapun, seperti ligan yang lebih besar (cth., protein atau peptida besar) yang sebaliknya berinteraksi dengan gelung ekstraselular, atau, seperti yang digambarkan oleh reseptor glutamat metabotropik kelas C (mGluR), ekor terminal N. GPCR kelas C dibezakan oleh ekor terminal N yang besar yang juga mengandungi domain pengikat ligan. Apabila glutamat mengikat di mGluR, ekor terminal N mengalami perubahan konformasi yang membawa kepada interaksinya dengan sisa gelung ekstrasel dan domain TM. Kesan akhirnya bagi ketiga-tiga jenis pengaktifan yang disebabkan oleh agonis ialah perubahan dalam orientasi relatif heliks TM (diumpamakan sebagai gerakan berpusing) yang membawa kepada permukaan intrasel yang lebih luas dan "pendedahan" sisa heliks intraselular dan domain TM yang penting dalam transduksi isyarat (yakni pergandingan protein G). Agonis songsang dan antagonis juga mungkin terikat pada beberapa tapak yang berbeza, tetapi kesan akhirnya ialah pencegahan orientasi semula heliks TM ini.
Struktur ekor terminal N dan C GPCR juga boleh berfungsi dengan fungsi penting di luar pengikatan ligan. Sebagai contoh, terminal C reseptor muskarinik M3 adalah mencukupi, dan domain enam asid amino polibes (KKKRRK) di terminal C diperlukan bagi prapemasangannya dengan protein Gq.[37] Khususnya, terminal C selalunya mengandungi sisa serina (Ser) atau treonina (Thr) yang meningkatkan pertalian permukaan intrasel bagi pengikatan protein perancah yang dipanggil β-arestin (β-arr) apabila difosforilasi.[38] Setelah terikat, β-arestin kedua-duanya menghalang gandingan G-protein secara sterik dan boleh merekrut protein lain yang membawa kepada penciptaan kompleks isyarat yang terlibat dalam pengaktifan laluan kinase terkawal isyarat ekstraselular (ERK) atau endositosis reseptor (internalisasi). Oleh kerana pemfosforilan Ser dan Thr ini sering berlaku akibat pengaktifan GPCR, penyahgandingan protein G berbantu β-arr dan internalisasi GPCR menjadi mekanisme penting penyahpekaan.[39] Di samping itu, "megakompleks" dalaman yang terdiri daripada GPCR tunggal, β-arr (dalam konformasi ekor),[40][41] dan protein G heterotrimerik wujud, dan boleh menyumbang kepada isyarat protein daripada endosom.[42][43]
Tema struktur umum terakhir di kalangan GPCR ialah palmitoilasi satu atau lebih tapak ekor terminal-C atau gelung intrasel. Palmitoilasi ialah pengubahsuaian kovalen sisa sisteina (Cys) melalui penambahan kumpulan asil hidrofobik, dan mempunyai kesan menyasarkan reseptor kepada mikrodomain yang kaya dengan kolesterol dan sfingolipid pada membran plasma yang dipanggil rakit lipid. Oleh kerana kebanyakan molekul pentransduksi dan efektor hiliran GPCR (termasuk yang terlibat dalam laluan maklum balas negatif) juga disasarkan kepada rakit lipid, ini mempunyai kesan memudahkan isyarat reseptor pantas.
GPCR bertindak balas kepada isyarat ekstraselular yang dimediasi oleh macam-macam aneka agonis, daripada protein kepada amina biogenik kepada proton, tetapi semuanya memindahkan isyarat ini melalui mekanisme gandingan protein G. Ini dimungkinkan oleh domain faktor pertukaran nukleotida guanina (GEF) yang dibentuk terutamanya oleh gabungan IL-2 dan IL-3 bersama dengan sisa bersebelahan heliks TM terkait.
Mekanisme[sunting | sunting sumber]
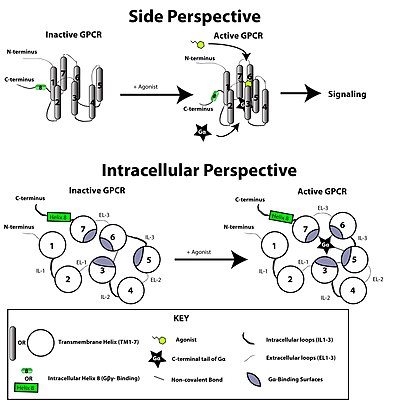
Reseptor bergandingan protein G diaktifkan oleh isyarat luaran dalam bentuk ligan atau pengantara isyarat lain. Ini mewujudkan perubahan konformasi pada reseptor, menyebabkan pengaktifan protein G. Kesan selanjutnya bergantung kepada jenis protein G. Protein G kemudiannya dinyahaktifkan oleh protein pengaktifan GTPase yang dikenali sebagai protein RGS.
Pengikatan ligan[sunting | sunting sumber]
GPCR termasuk satu atau lebih reseptor untuk ligan berikut: perantara isyarat deria (cth., molekul rangsangan cahaya dan bau); adenosina, bombesin, bradikinin, endotelin, asid γ-aminobutirik (GABA), faktor pertumbuhan hepatosit (HGF), melanokortin, neuropeptida Y, peptida opioid, opsin, somatostatin, GH, takikinin, ahli-ahli peptida usus vasoaktif; amina biogenik (cth., dopamina, epinefrina, norepinefrina, histamin, serotonin dan melatonin); glutamat (kesan metabotropik); glukagon; asetilkolina (kesan muskarinik); kemokin; perantara keradangan lipid (cth., prostaglandin, prostanoid, faktor pengaktif platelet dan leukotriena); hormon peptida (cth., kalsitonin, anafilatoksin C5a, hormon perangsang folikel [FSH], hormon pelepas gonadotropin [GnRH], neurokinin, hormon pelepas tirotropin [TRH] dan oksitosin); dan endokanabinoid.
GPCR yang bertindak sebagai reseptor bagi rangsangan yang belum dikenal pasti dikenali sebagai reseptor yatim.
Walau bagaimanapun, berbeza dengan jenis reseptor lain yang telah dikaji, di mana ligan mengikat secara luaran ke membran, ligan GPCR biasanya mengikat dalam domain transmembran. Walau bagaimanapun, reseptor diaktifkan protease diaktifkan oleh pembelahan sebahagian daripada domain ekstrasel mereka.[45]
Perubahan konformasi[sunting | sunting sumber]

Transduksi isyarat melalui membran oleh reseptor tidak difahami sepenuhnya. Adalah diketahui bahawa dalam keadaan tidak aktif, GPCR terikat kepada kompleks protein G heterotrimer. Pengikatan agonis kepada GPCR menghasilkan perubahan konformasi dalam reseptor yang dihantar ke subunit Gα terikat protein G heterotrimer melalui dinamik domain protein. Subunit Gα yang diaktifkan menukar GTP menggantikan GDP yang seterusnya mencetuskan pemisahan subunit Gα daripada dimer Gβγ dan dari reseptor. Subunit Gα dan Gβγ yang dipisahkan berinteraksi dengan protein intrasel yang lain untuk meneruskan lata transduksi isyarat manakala GPCR yang dibebaskan dapat mengikat semula kepada protein G heterotrimerik lain untuk membentuk kompleks baharu yang bersedia untuk memulakan satu lagi pusingan transduksi isyarat.[46]
Adalah dipercayai bahawa molekul reseptor wujud dalam keseimbangan konformasi antara keadaan biofizikal aktif dan tidak aktif.[47] Pengikatan ligan kepada reseptor boleh mengalihkan keseimbangan ke arah keadaan reseptor aktif. Tiga jenis ligan wujud: agonis ialah ligan yang mengalihkan keseimbangan memihak kepada keadaan aktif; agonis songsang ialah ligan yang mengalihkan keseimbangan memihak kepada keadaan tidak aktif; dan antagonis neutral ialah ligan yang tidak menjejaskan keseimbangan. Ia masih belum diketahui bagaimana sebenarnya keadaan aktif dan tidak aktif berbeza antara satu sama lain.
Kitaran pengaktifan/penyahaktifan protein G[sunting | sunting sumber]

Apabila reseptor tidak aktif, domain GEF mungkin terikat kepada subunit α yang juga tidak aktif bagi protein G heterotrimerik. "Protein G" di sini ialah trimer subunit α, β dan γ (masing-masing dikenali sebagai Gα, Gβ dan Gγ) yang dibuat tidak aktif apabila terikat secara balik kepada guanosine difosfat (GDP) (atau, sebagai alternatif, tanpa nukleotida guanina), tetapi aktif apabila terikat kepada guanosina trifosfat (GTP). Selepas pengaktifan reseptor, domain GEF seterusnya, mengaktifkan protein G secara alosterik dengan memudahkan pertukaran molekul GDP bagi GTP di subunit α protein G. Sel mengekalkan nisbah 10:1 GTP:GDP dalam sitosil, menjadikan pertukaran untuk GTP sesuatu yang pasti. Pada ketika ini, subunit protein G berpisah daripada reseptor, serta satu sama lain, untuk menghasilkan monomer Gα-GTP dan dimer Gβγ yang berinteraksi rapat, yang kini bebas untuk memodulasi aktiviti protein intrasel yang lain. Sejauh mana ia boleh meresap, bagaimanapun, adalah terhad disebabkan oleh palmitoilasi Gα dan kehadiran bahagian isoprenoid yang telah ditambah secara kovalen di terminal C Gγ.
Oleh kerana Gα juga mempunyai keupayaan hidrolisis GTP→KDNK yang perlahan, bentuk subunit α tidak aktif (Gα-GDP) akhirnya dijana semula, dengan itu membenarkan sambungan semula dengan dimer Gβγ untuk membentuk protein G "rehat" yang boleh mengikat semula kepada GPCR dan menunggu pengaktifan. Kadar hidrolisis GTP selalunya dipercepatkan disebabkan oleh tindakan satu lagi keluarga protein pemodulat allosterik yang dipanggil pengawal atur isyarat protein G atau protein RGS, sejenis protein pengaktif GTPase atau GAP. Malah, kebanyakan protein efektor utama (cth., adenilat siklase) yang dibuat aktif/tidak aktif apabila berinteraksi dengan Gα-GTP juga mempunyai aktiviti GAP. Oleh itu, walaupun pada peringkat awal proses ini, isyarat yang dimulakan GPCR mempunyai kebolehan penamatan sendiri.
Crosstalk[sunting | sunting sumber]

Isyarat hiliran GPCR telah ditunjukkan berkemungkinan berinteraksi dengan isyarat integrin seperti FAK.[48] Isyarat integrin akan memfosforilkan FAK, dan kemudiannya boleh mengurangkan aktiviti Gαs GPCR.
Pengisyaratan[sunting | sunting sumber]

Jika reseptor dalam keadaan aktif menemui protein G, ia mungkin mengaktifkannya. Sesetengah bukti menunjukkan bahawa reseptor dan protein G sebenarnya telah digandingkan siap-siap.[37] Sebagai contoh, pengikatan protein G kepada reseptor menjejaskan pertalian reseptor terhadap ligan. Protein G yang diaktifkan terikat kepada GTP.
Transduksi isyarat selanjutnya bergantung pada jenis protein G. Enzim adenilat siklase ialah contoh protein selular yang boleh dikawal oleh protein G, secara khususnya dalam kes ini, protein Gs. Aktiviti adenilat siklase diaktifkan apabila ia mengikat kepada subunit protein G yang diaktifkan. Pengaktifan adenilat siklase tamat apabila protein G kembali kepada keadaan ikatan GDP.
Adenilat siklase (dengan 9 jenis terikat membran dan satu bentuk sitosol diketahui pada manusia) juga boleh diaktifkan atau dihalang dengan cara lain (cth, pengikatan Ca2+/kalmodulin) yang boleh mengubah suai aktiviti enzim ini dengan cara penambahan atau sinergistik bersama dengan protein G.
Laluan isyarat yang diaktifkan melalui GPCR dihadkan oleh struktur primer dan struktur tertier GPCR itu sendiri tetapi, akhirnya ditentukan oleh konformasi tertentu yang distabilkan oleh ligan tertentu, serta ketersediaan molekul pemindah. Pada masa ini, GPCR dianggap menggunakan dua jenis pemindah utama: protein G dan β-arestin. Oleh kerana β-arr mempunyai pertalian tinggi hanya kepada bentuk terfosforilasi bagi kebanyakan GPCR (lihat di atas atau di bawah), majoriti isyarat akhirnya bergantung kepada pengaktifan protein G. Walau bagaimanapun, kemungkinan interaksi ada membenarkan isyarat bebas protein G berlaku.
Pengisyaratan bergantungan protein G[sunting | sunting sumber]
Terdapat tiga laluan isyarat pengantara protein G utama yang dibantu oleh empat subkelas protein G yang berbeza mengikut homologi jujukan (Gαs, Gαi/o, Gαq/11 dan Gα12/13). Setiap subkelas protein G terdiri daripada berbilang protein, setiap satu produk daripada pelbagai gen atau variasi sambatan yang mungkin memberikan perbezaan antara yang halus hingga berbeza berkenaan sifat isyarat, tetapi secara amnya ia kelihatan secara munasabah dikumpulkan ke dalam empat kelas. Oleh kerana sifat transduksi isyarat pelbagai gabungan βγ tidak kelihatan berbeza secara radikal antara satu sama lain, kelas ini ditakrifkan mengikut isoform subunit α mereka.[6]:1163
Walaupun kebanyakan GPCR mampu mengaktifkan lebih daripada satu subjenis Gα, mereka juga menunjukkan keutamaan terhadap satu subjenis berbanding yang lain. Apabila subjenis diaktifkan bergantung pada ligan yang terikat pada GPCR, ini dipanggil selektiviti berfungsi (juga dikenali sebagai perdagangan terarah agonis atau agonisme khusus konformasi). Walau bagaimanapun, pengikatan mana-mana agonis tertentu juga boleh memulakan pengaktifan berbilang protein G yang berbeza kerana ia mungkin mampu menstabilkan lebih daripada satu konformasi domain GEF bagi GPCR, walaupun sepanjang satu interaksi. Di samping itu, konformasi yang lebih baik mengaktifkan satu isoform Gα boleh mengaktifkan yang lain jika pilihan kurang tersedia. Tambahan pula, laluan maklum balas boleh mengakibatkan pengubahsuaian reseptor (cth., pemfosforilan) yang mengubah keutamaan protein G. Terlepas dari pelbagai nuansa ini, pasangan gandingan pilihan GPCR biasanya ditakrifkan mengikut protein G yang paling jelas diaktifkan oleh ligan endogen di bawah kebanyakan keadaan fisiologi atau eksperimen.
Pengisyaratan Gα[sunting | sunting sumber]
- Efektor kedua-dua laluan Gαs dan Gαi/o ialah enzim adenilat siklase penjana adenosina monofosfat siklik (cAMP) atau AC. Walaupun terdapat 10 produk gen AC yang berbeza dalam mamalia, masing-masing dengan perbezaan halus dalam pengedaran atau fungsi tisu, semuanya memangkinkan penukaran adenosine triphosphate (ATP) kepada cAMP di sitosol, dan semuanya dirangsang secara langsung oleh protein G kelas Gαs. Sebaliknya, interaksi dengan subunit Gα daripada jenis Gαi/o menghalang AC daripada menjana cAMP. Oleh itu, GPCR yang digandingkan dengan Gαs menentang tindakan GPCR yang digabungkan dengan Gαi/o, dan begitu juga sebaliknya. Tahap cAMP sitosol kemudiannya boleh menentukan aktiviti pelbagai saluran ion serta ahli kinase protein khusus ser/thr (PKA). Oleh itu, cAMP dianggap sebagai pengutus kedua dan PKA sebagai efektor sekunder.
- Efektor laluan Gαq/11 ialah fosfolipase C-β (PLCβ), yang memangkinkan pembelahan fosfatidillinositol 4,5-bisfosfat (PIP2) terikat membran menjadi pengutus kedua inositol (1,4,5) trisfosfat (IP3) dan diasilgliserol (DAG). IP3 bertindak pada reseptor IP3 yang terdapat dalam membran retikulum endoplasma (ER) untuk mendapatkan pelepasan Ca2+ daripada ER, manakala DAG meresap di sepanjang membran plasma di mana ia boleh mengaktifkan sebarang bentuk membran setempat dari ser/thr kinase kedua yang dipanggil protein kinase C (PKC). Oleh kerana banyak isoform PKC juga diaktifkan oleh peningkatan dalam Ca2+ intrasel, kedua-dua laluan ini juga boleh menumpu antara satu sama lain untuk memberi isyarat melalui efektor sekunder yang sama. Ca2+ intrasel yang tinggi juga mengikat dan mengaktifkan secara alosterik protein yang dipanggil kalmodulin, yang kemudiannya mengaktifkan GTPase kecil, Rho. Setelah terikat kepada GTP, Rho kemudiannya boleh terus mengaktifkan pelbagai protein yang bertanggungjawab dalam kawal atur sitoskeleton seperti Rho-kinase (ROCK). Kebanyakan GPCR yang digandingkan dengan Gα12/13 juga digandingkan dengan subkelas lain, selalunya Gαq/11.
Isyarat Gβγ[sunting | sunting sumber]
Perihalan di atas mengabaikan kesan isyarat Gβγ yang juga boleh menjadi penting, khususnya dalam kes GPCR bergandingan Gαi/o yang diaktifkan. Pengesan utama Gβγ ialah pelbagai saluran ion seperti saluran K+ pembetulan dalaman kawal atur protein G, saluran Ca2+ berpagaran voltan jenis N dan P/Q, serta beberapa isoform AC dan PLC, bersama-sama beberapa isoform fosfoinositida-3-kinase (PI3K).
Pengisyaratan bebas protein G[sunting | sunting sumber]
Walaupun mereka secara klasiknya dianggap berfungsi hanya secara bersama, GPCR mungkin memberi isyarat dalam mekanisme bebas protein G, dan protein G heterotrimerik mungkin memainkan peranan kefungsian yang bebas daripada GPCR. GPCR boleh memberi isyarat secara bebas melalui banyak protein yang telah disebutkan bagi peranannya dalam isyarat yang bergantung kepada protein G seperti β-arr, GRK dan Src. Isyarat sedemikian telah terbukti relevan dari segi fisiologi. Contohnya, isyarat β-arestin yang dibantu reseptor kemokin CXCR3 adalah perlu dalam kemotaksis sel T diaktifkan dengan keberkesanan penuh.[49] Di samping itu, protein perancah selanjutnya yang terlibat dalam penyetempatan subsel GPCR (cth., protein yang mengandungi domain PDZ) juga boleh bertindak sebagai pemberi isyarat. Selalunya, efektor ialah ahli keluarga MAPK.
Contoh[sunting | sunting sumber]
Pada akhir 1990-an, bukti mula terkumpul untuk mencadangkan bahawa sesetengah GPCR dapat memberi isyarat tanpa protein G. Kinase protein diaktifkan mitogen ERK2, pengantara transduksi isyarat utama hiliran pengaktifan reseptor dalam banyak laluan, telah ditunjukkan diaktifkan sebagai tindak balas kepada pengaktifan reseptor pengantara cAMP dalam acuan lendir D. discoideum meskipun tanpa α- dan β-subunit protein G.[50]
Dalam sel-sel mamalia, β2-adrenoseptor yang banyak dikaji telah ditunjukkan untuk mengaktifkan laluan ERK2 selepas penyahgandingan isyarat protein G oleh arestin. Oleh itu, nampaknya beberapa mekanisme yang sebelum ini dipercayai berkaitan semata-mata dengan penyahpekaan reseptor sebenarnya adalah contoh reseptor yang menukar laluan isyaratnya, bukannya sekadar dimatikan.
Dalam sel buah pinggang, reseptor bradikinin B2 telah ditunjukkan untuk berinteraksi secara langsung dengan protein tirosina fosfatase. Kehadiran jujukan ITIM berfosforilasi tirosina (motif perencatan berasaskan tirosina imunoreseptor) dalam reseptor B2 adalah perlu untuk mengantara interaksi ini, dan seterusnya, kesan antiproliferatif bradikinin.[51]
Isyarat bebas GPCR oleh protein G heterotrimer[sunting | sunting sumber]
Walaupun penyelidikan perihal ini agak belum matang, nampaknya protein G heterotrimer juga mungkin mengambil bahagian dalam pengisyaratan bukan GPCR. Terdapat bukti peranan sebagai pentransduksi isyarat dalam hampir semua jenis isyarat pengantara reseptor lain, termasuk integrin, kinase tirosina reseptor (RTK), reseptor sitokin (JAK/STAT), serta modulasi pelbagai protein "aksesori" lain seperti GEF, perencat disosiasi guanina-nukleotida (GDI) dan fosfatase protein. Malah, mungkin terdapat protein khusus bagi kelas ini dengan fungsi utamanya adalah sebagai sebahagian daripada laluan bebas GPCR, yang dipanggil sebagai pengaktif isyarat protein G (AGS). Kedua-dua kekerapan interaksi ini dan kepentingan subunit Gα lawan Gβγ dalam proses ini masih tidak jelas.
Butiran laluan cAMP dan PIP2[sunting | sunting sumber]



Terdapat dua laluan transduksi isyarat utama yang melibatkan reseptor berkaitan protein G: laluan isyarat cAMP dan laluan isyarat fosfatidillinositol.[5]
Laluan isyarat cAMP[sunting | sunting sumber]
Transduksi isyarat cAMP mengandungi lima watak utama: reseptor hormon perangsang (Rs) atau reseptor hormon perencatan (Ri); protein G pengawal atur berangsang (Gs) atau protein G pengawal atur perencat (Gi); adenilil siklase; protein kinase A (PKA); dan cAMP fosfodiesterase.
Reseptor hormon stimulasi (Rs) ialah reseptor yang boleh mengikat dengan molekul isyarat rangsangan manakala reseptor hormon perencatan (Ri) ialah reseptor yang boleh mengikat dengan molekul isyarat perencatan.
Protein G kawal atur rangsangan ialah protein G yang dikaitkan dengan reseptor hormon perangsang (Rs), dan subunit α-nya yang aktif boleh merangsang aktiviti enzim atau metabolisme intrasel yang lain. Sebaliknya, protein G kawal selia perencatan dikaitkan dengan reseptor hormon perencatan, dan subunit α aktifnya boleh menghalang aktiviti enzim atau metabolisme intrasel lain.
Adenylyl cyclase ialah glikoprotein 12-transmembran yang memangkinkan penukaran ATP kepada cAMP dengan bantuan kofaktor Mg2+ atau Mn2+. cAMP yang dihasilkan ialah pengutus kedua dalam metabolisme selular, dan merupakan pengaktif alosterik protein kinase A.
Protein kinase A ialah enzim penting dalam metabolisme sel kerana keupayaannya untuk mengawal metabolisme sel dengan memfosforilkan enzim komited khusus dalam laluan metabolisme. Ia juga boleh mengawal ekspresi gen tertentu, rembesan sel dan kebolehtelapan membran. Enzim protein mengandungi dua subunit pemangkin dan dua subunit pengawalseliaan. Tanpa cAMP, kompleks tidak aktif. Apabila cAMP mengikat kepada subunit kawal atur, konformasinya diubah, menyebabkan pemisahan subunit kawal atur lalu mengaktifkan kinase protein A dan membenarkan kesan biologi selanjutnya.
Isyarat ini kemudiannya boleh ditamatkan oleh cAMP fosfodiesterase, iaitu enzim yang menguraikan cAMP kepada 5'-AMP dan menyahaktifkan protein kinase A.
Laluan isyarat fosfatidilinositol[sunting | sunting sumber]
Dalam laluan isyarat fosfatidilinositol, molekul isyarat ekstraselular mengikat dengan reseptor protein G (Gq) pada permukaan sel dan mengaktifkan fosfolipase C, yang terletak di membran plasma. Lipase menghidrolisis fosfatidillinositol 4,5-bisfosfat (PIP2) kepada dua utusan kedua: inositol 1,4,5-trisphosphate (IP3) dan diasilgliserol (DAG). IP3 mengikat dengan reseptor IP3 dalam membran retikulum endoplasma licin dan mitokondria untuk membuka saluran Ca2+. DAG membantu mengaktifkan protein kinase C (PKC) yang memfosforilkan banyak protein lain, mengubah aktiviti pemangkinnya, dan membawa kepada tindak balas sel.
Kesan Ca2+ juga ketara: ia bekerjasama dengan DAG dalam mengaktifkan PKC dan boleh mengaktifkan laluan kinase CaM, di mana kalmodulin (CaM), sebuah protein termodulat kalsium, mengikat Ca2+ lalu mengalami perubahan konformasi, dan mengaktifkan kinase CaM.II yang mempunyai keupayaan unik untuk meningkatkan pertalian mengikatnya kepada CaM dengan autopemfosforilan, menjadikan CaM tidak tersedia bagi pengaktifan enzim lain. Kinase kemudian memfosforilkan enzim sasaran untuk mengawal aktiviti mereka. Kedua-dua laluan isyarat disambungkan bersama oleh Ca2+-CaM, yang juga merupakan subunit pengawalseliaan adenilil siklase dan fosfodiesterase dalam laluan isyarat cAMP.
Kawal atur reseptor[sunting | sunting sumber]
GPCR menjadi desensitisasi apabila terdedah kepada ligan mereka untuk jangka masa yang lama. Terdapat dua bentuk penyahpekaan yang dikenali: 1) penyahpekaan homolog, di mana GPCR yang aktif dikurangkan; dan 2) penyahpekaan heterolog, di mana GPCR yang diaktifkan menyebabkan penurunan kawal autr GPCR yang berbeza. Reaksi utama pengurangan kawal atur ini ialah pemfosforilan domain reseptor intrasel oleh kinase protein.
Pemfosforilan oleh kinase protein bergantungan cAMP[sunting | sunting sumber]
Kinase protein bergantungan AMP siklik (protein kinase A) diaktifkan oleh rantai isyarat yang datang daripada protein G (yang diaktifkan oleh reseptor) melalui adenilat siklase dan AMP siklik (cAMP). Dalam mekanisme maklum balas, kinase yang diaktifkan ini memfosforilkan reseptor. Lebih lama reseptor kekal aktif, lebih banyak kinase diaktifkan dan lebih banyak reseptor terfosforilasi. Dalam β<sub id="mwAsA">2</sub>-adrenoseptor, pemfosforilan ini menghasilkan penukaran gandingan daripada protein G kelas Gs kepada kelas G<sub id="mwAsM">i</sub>.[52] Pemfosforilan pengantara PKA bergantungan cAMP boleh menyebabkan penyahpekaan heterolog dalam reseptor selain daripada yang diaktifkan.[53]
Pemfosforilan oleh GRK[sunting | sunting sumber]
Kinase reseptor bergandingan protein G (GRK) ialah kinase protein yang memfosforilkan hanya GPCR aktif.[54] GRK merupakan pemodulat utama GPCR. Mereka membentuk keluarga tujuh kinase protein serina-treonina mamalia yang memfosforilkan reseptor terikat agonis. Pemfosforilan reseptor yang dimediasi GRK dengan cepat memulakan kemerosotan mendalam pada isyarat dan penyahpekaan reseptor. Aktiviti GRK dan penyasaran subselular dikawal ketat oleh interaksi dengan domain reseptor, subunit protein G, lipid, protein penambat dan protein sensitif kalsium.[55]
Pemfosforilan reseptor boleh mempunyai dua akibat:
- Translokasi: Reseptor bersama-sama bahagian membran yang tertanam di dalamnya dibawa ke bahagian dalam sel, di mana ia dinyahfosforilasi dalam persekitaran vesikel berasid[56] dan kemudian dibawa balik. Mekanisme ini digunakan untuk mengawal atur pendedahan jangka panjang, contohnya, kepada hormon, dengan membenarkan pemekaan semula mengikuti penyahpekaan. Sebagai alternatif, reseptor mungkin mengalami penguraian oleh lisosom, atau kekal disimpan, di mana ia dianggap mengambil bahagian dalam permulaan peristiwa pengisyaratan, dengan sifatnya bergantung pada penyetempatan subsel vesikel.[53]
- Arestin: Reseptor berfosforilasi boleh diikat dengan molekul arestin yang menghalangnya daripada mengikat (dan mengaktifkan) protein G, secara dasarnya mematikannya buat tempoh yang singkat. Mekanisme ini digunakan, sebagai contoh, dengan rodopsin dalam sel retina untuk mengimbangi pendedahan kepada cahaya terang. Dalam kebanyakan kes, pengikatan arestin terhadap reseptor ialah prasyarat untuk translokasi. Sebagai contoh, beta-arestin terikat kepada β2-adrenoreseptor bertindak sebagai penyesuai untuk mengikat dengan klatrin, dan dengan subunit beta AP2 (molekul penyesuai klatrin); oleh itu, penangkapan di sini bertindak sebagai perancah yang memasang komponen yang diperlukan bagi endositosis β2-adrenoreseptor berbantu klatrin.[57][58]
Mekanisme penamatan isyarat GPCR[sunting | sunting sumber]
Seperti di atas, protein G boleh menamatkan pengaktifannya sendiri oleh kerana keupayaan hidrolisis GTP dalamannya. Walau bagaimanapun, tindak balas ini berjalan pada kadar yang perlahan (≈0.02 kali/saat) dan, oleh itu, ia akan mengambil masa kira-kira 50 saat bagi mana-mana protein G tunggal untuk dinyahaktifkan jika faktor lain tidak digunakan. Dengan itu, terdapat kira-kira 30 isoform protein RGS yang mempercepatkan kadar hidrolisis kepada ≈30 kali/saat apabila terikat kepada Gα melalui domain GAP mereka. Peningkatan kadar 1500 kali ganda ini membolehkan sel bertindak balas kepada isyarat luaran dengan kelajuan tinggi, serta resolusi ruangan disebabkan oleh jumlah pengutus kedua yang terhad yang boleh dijana dan jarak terhad protein G boleh meresap dalam 0.03 saat. Bagi sebahagian besar hal, protein RGS adalah rambang dalam keupayaan mereka untuk menyahaktifkan protein G, manakala RGS yang terlibat dalam laluan isyarat tertentu nampaknya lebih ditentukan oleh tisu dan GPCR yang terlibat daripada yang lain. Di samping itu, protein RGS mempunyai fungsi tambahan untuk meningkatkan kadar pertukaran GTP pada GPCR, (iaitu, sebagai sejenis ko-GEF) seterusnya menyumbang kepada resolusi masa isyarat GPCR.
Di samping itu, GPCR mungkin dinyahpekakan secara sendiri. Ini boleh berlaku sebagai:
- hasil langsung daripada pendudukan ligan, di mana perubahan konformasi membenarkan pengambilan kinase pengawal atur GPCR (GRK), yang seterusnya memfosforilkan pelbagai sisa serina/treonina IL-3 dan ekor terminal C. Selepas pemfosforilan GRK, pertalian GPCR terhadap β-arestin (β-arestin-1/2 dalam kebanyakan tisu) meningkat, di mana titik β-arestin boleh mengikat dan bertindak untuk menghalang gandingan protein Gsecara sterik serta memulakan proses internalisasi reseptor melalui endositosis berbantu klatrin. Oleh kerana hanya reseptor ligan yang dinyahpekakan oleh mekanisme ini, ia dipanggil penyahpekaan homolog
- pertalian terhadap β-arestin boleh ditingkatkan dalam gaya bebas pendudukan ligan dan GRK melalui pemfosforilan tapak ser/thr yang berbeza (tetapi juga IL-3 dan ekor terminal C) oleh PKC dan PKA. Pemfosforilan ini selalunya mencukupi untuk menjejaskan gandingan protein G sendiri.[59]
- PKC/PKA mungkin, sebaliknya, memfosforilkan GRK yang juga boleh membawa kepada pemfosforilan GPCR dan pengikatan β-arestin dengan cara bebas pendudukan. Kedua-dua mekanisme terakhir ini membenarkan penyahpekaan satu GPCR disebabkan oleh aktiviti yang lain, atau penyahpekaan heterolog. GRK juga mungkin mempunyai domain GAP dan mungkin menyumbang kepada penyahaktifan melalui mekanisme bukan kinase juga. Gabungan mekanisme ini juga mungkin berlaku.
Sebaik sahaja β-arestin terikat kepada GPCR, ia mengalami perubahan konformasi yang membolehkannya berfungsi sebagai protein perancah untuk kompleks penyesuai yang dipanggil AP-2 yang seterusnya merekrut protein klatrin. Jika reseptor yang mencukupi di kawasan setempat merekrut klatrin dengan cara ini, ia terkumpul dan membran mentunas ke dalam sel sebagai tindak balas interaksi antara molekul klatrin dalam proses yang dipanggil opsonisasi. Sebaik sahaja lubang itu telah dicubit dari membran plasma disebabkan oleh tindakan dua protein lain yang dipanggil amfifisin dan dinamin, ia kini menjadi vesikel endositik. Pada ketika ini, molekul penyesuai dan klatrin telah tercerai, dan reseptor sama ada diperdagangkan kembali ke membran plasma atau disasarkan kepada lisosom bagi penguaraian.
Pada bila-bila masa dalam proses ini, β-arestin juga boleh merekrut protein lain seperti kinase tirosina bukan reseptor (nRTK) dan c-SRC yang boleh mengaktifkan ERK1/2 atau kinase protein diaktifkan mitogen (MAPK) lain memberi isyarat melalui, sebagai contoh, pemfosforilan GTPase kecil, Ras, atau merekrut protein lata ERK secara langsung (iaitu, Raf-1, MEK, ERK-1/2), di mana isyarat titik dimulakan kerana jaraknya yang dekat dengan satu sama lain. Satu lagi sasaran c-SRC ialah molekul dinamin yang terlibat dalam endositosis. Dinamin berpolimer di sekitar leher vesikel yang masuk, dan fosforilasinya oleh c-SRC memberikan tenaga yang diperlukan bagi perubahan konformasi yang membolehkan "pencubitan" terakhir dari membran.
Peraturan selular GPCR[sunting | sunting sumber]
Penyahpekaan reseptor dibantu melalui gabungan pemfosforilan, pengikatan β-arr dan endositosis seperti yang diterangkan di atas. Pengawalaturan penurunan berlaku apabila reseptor endositosis dibenamkan dalam endosom yang didagangkan untuk bergabung dengan lisosom. Oleh kerana membran lisosom kaya dengan pam proton, bahagian dalamannya mempunyai pH yang rendah (≈4.8 berbanding pH ≈7.2 di sitosol) yang bertindak untuk menyahtukarkan GPCR. Di samping itu, lisosom mengandungi banyak enzim penguraian termasuk protease yang boleh berfungsi hanya pada pH rendah sedemikian, dan oleh itu, ikatan peptida yang bergabung dengan residu GPCR bersama-sama boleh dibelah. Sama ada reseptor tertentu didagangkan ke lisosom, ditahan dalam endosom, atau didagangkan kembali ke membran plasma bergantung pada pelbagai faktor, termasuk jenis reseptor dan magnitud isyarat. Peraturan GPCR juga dimediasi oleh faktor transkripsi gen. Faktor-faktor ini boleh meningkatkan atau mengurangkan transkripsi gen dan dengan itu meningkatkan atau mengurangkan penjanaan reseptor baru (peraturan atas atau bawah) yang bergerak ke membran sel.
Pengoligomeran reseptor[sunting | sunting sumber]
Pengoligomeran GPCR ialah fenomena yang meluas. Salah satu contoh terbaik yang dikaji ialah reseptor GABAB metabotropik. Reseptor konstitutif yang dipanggil ini dibentuk oleh pengheterodimeran subunit GABABR1 dan GABABR2. Ekspresi GABABR1 tanpa GABABR2 dalam sistem heterolog membawa kepada pengekalan subunit dalam retikulum endoplasma. Ekspresi subunit GABABR2 sahaja, sementara itu, membawa kepada ekspresi permukaan subunit walaupun tanpa aktiviti berfungsi (iaitu, reseptor tidak mengikat agonis dan tidak boleh memulakan tindak balas selepas pendedahan terhadap agonis). Ekspresi kedua-dua subunit bersama-sama membawa kepada ekspresi membran plasma reseptor berfungsi. Telah ditunjukkan bahawa pengikatan GABABR2 kepada GABABR1 menyebabkan penutupan isyarat pengekalan[60] reseptor berfungsi.[61]
Asal-usul dan kepelbagaian superkeluarga[sunting | sunting sumber]
Transduksi isyarat berbantuan superkeluarga GPCR bermula pada asal usul kehidupan multisel. GPCR seperti mamalia ditemui dalam kulat, dan telah dikelaskan mengikut sistem pengelasan GRAFS berdasarkan cap jari GPCR.[17] Pengenalpastian ahli superkeluarga merentasi domain eukariot, dan perbandingan motif khusus keluarga telah menunjukkan bahawa superkeluarga GPCR mempunyai asal yang sama.[62] Motif ciri menunjukkan bahawa tiga daripada lima keluarga GRAFS, rodopsin, lekatan dan Frizzled, berkembang daripada reseptor cAMP Dictyostelium discoideum sebelum pemisahan opistokon. Kemudian, keluarga sekretin berkembang daripada keluarga reseptor lekatan GPCR sebelum pencapahan nematod.[17] GPCR serangga nampaknya berada dalam kumpulan mereka sendiri, dan Taste2 dikenal pasti sebagai keturunan rodopsin.[62] Ambil perhatian bahawa pemisahan sekretin dan lekatan adalah berdasarkan fungsi anggapan berbanding pencirian, kerana Kelas B klasik (7tm_2, Pfam PF00002) digunakan untuk mengenal pasti kedua-duanya dalam kajian.
Rujukan[sunting | sunting sumber]
- ^ a b "High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor". Science. 318 (5854): 1258–65. November 2007. Bibcode:2007Sci...318.1258C. doi:10.1126/science.1150577. PMC 2583103. PMID 17962520. Unknown parameter
|displayauthors=ignored (bantuan) - ^ a b Zhang, Jian V.; Li, Lei; Huang, Qingsheng; Ren, Pei-Gen (2013-01-01). "Chapter Three - Obestatin Receptor in Energy Homeostasis and Obesity Pathogenesis". Dalam Tao, Ya-Xiong (penyunting). Progress in Molecular Biology and Translational Science. G Protein-Coupled Receptors in Energy Homeostasis and Obesity Pathogenesis. 114. Academic Press. m/s. 89–107. doi:10.1016/B978-0-12-386933-3.00003-0. ISBN 9780123869333. PMID 23317783. Diarkibkan daripada yang asal pada 2023-01-17. Dicapai pada 2023-10-24.
- ^ a b Trzaskowski B, Latek D, Yuan S, Ghoshdastider U, Debinski A, Filipek S (2012). "Action of molecular switches in GPCRs--theoretical and experimental studies". Current Medicinal Chemistry. 19 (8): 1090–109. doi:10.2174/092986712799320556. PMC 3343417. PMID 22300046.
 Text was copied from this source, which is available under a Attribution 2.5 Generic (CC BY 2.5) licence
Text was copied from this source, which is available under a Attribution 2.5 Generic (CC BY 2.5) licence
- ^ "Evolution of key cell signaling and adhesion protein families predates animal origins". Science. 301 (5631): 361–3. July 2003. Bibcode:2003Sci...301..361K. doi:10.1126/science.1083853. PMID 12869759.
- ^ a b "G proteins: transducers of receptor-generated signals". Annual Review of Biochemistry. 56 (1): 615–49. 1987. doi:10.1146/annurev.bi.56.070187.003151. PMID 3113327.
- ^ a b "Mammalian G proteins and their cell type specific functions". Physiological Reviews. 85 (4): 1159–204. October 2005. doi:10.1152/physrev.00003.2005. PMID 16183910.
- ^ a b "Pharmacogenomics of GPCR Drug Targets". Cell. 172 (1–2): 41–54.e19. January 2018. doi:10.1016/j.cell.2017.11.033. PMC 5766829. PMID 29249361.
- ^ "The Nobel Prize in Chemistry 2012 Robert J. Lefkowitz, Brian K. Kobilka". 10 October 2012. Dicapai pada 10 October 2012.
- ^ "The top prescription drugs of 2012 globally: biologics dominate, but small molecule CNS drugs hold on to top spots". ACS Chemical Neuroscience. 4 (6): 905–7. June 2013. doi:10.1021/cn400107y. PMC 3689196. PMID 24024784.
- ^ a b "Comprehensive repertoire and phylogenetic analysis of the G protein-coupled receptors in human and mouse". Genomics. 88 (3): 263–73. September 2006. doi:10.1016/j.ygeno.2006.04.001. PMID 16753280.
- ^ "keyword:"G-protein coupled receptor [KW-0297]" AND organism:"Homo sapiens (Human) [9606]" in UniProtKB". www.uniprot.org. Diarkibkan daripada yang asal pada 2020-09-15. Dicapai pada 2019-06-24.
- ^ "Phylogenetic analysis of 277 human G-protein-coupled receptors as a tool for the prediction of orphan receptor ligands". Genome Biology. 3 (11): RESEARCH0063. October 2002. doi:10.1186/gb-2002-3-11-research0063. PMC 133447. PMID 12429062.
- ^ "Fingerprinting G-protein-coupled receptors". Protein Engineering. 7 (2): 195–203. February 1994. doi:10.1093/protein/7.2.195. PMID 8170923.
- ^ "GCRDb: a G-protein-coupled receptor database". Receptors & Channels. 2 (1): 1–7. 1994. PMID 8081729.
- ^ "International Union of Pharmacology. XLVI. G protein-coupled receptor list". Pharmacological Reviews. 57 (2): 279–88. June 2005. doi:10.1124/pr.57.2.5. PMID 15914470. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "InterPro". Diarkibkan daripada yang asal pada 21 February 2008. Dicapai pada 10 December 2007.
- ^ a b c "The origin of GPCRs: identification of mammalian like Rhodopsin, Adhesion, Glutamate and Frizzled GPCRs in fungi". PLOS ONE. 7 (1): e29817. 2012. Bibcode:2012PLoSO...729817K. doi:10.1371/journal.pone.0029817. PMC 3251606. PMID 22238661.
- ^ "The G protein-coupled receptor repertoires of human and mouse". Proceedings of the National Academy of Sciences of the United States of America. 100 (8): 4903–8. April 2003. Bibcode:2003PNAS..100.4903V. doi:10.1073/pnas.0230374100. PMC 153653. PMID 12679517. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "GPCR-CA: A cellular automaton image approach for predicting G-protein-coupled receptor functional classes". Journal of Computational Chemistry. 30 (9): 1414–23. July 2009. doi:10.1002/jcc.21163. PMID 19037861. Diarkibkan daripada yang asal pada 2017-04-09.
- ^ "Prediction of G-protein-coupled receptor classes based on the concept of Chou's pseudo amino acid composition: an approach from discrete wavelet transform". Analytical Biochemistry. 390 (1): 68–73. July 2009. doi:10.1016/j.ab.2009.04.009. PMID 19364489.
- ^ "Prediction of G-protein-coupled receptor classes in low homology using Chou's pseudo amino acid composition with approximate entropy and hydrophobicity patterns". Protein and Peptide Letters. 17 (5): 559–67. May 2010. doi:10.2174/092986610791112693. PMID 19594431.
- ^ "Cannabinoid Receptor 2 (CB2) Signals via G-alpha-s and Induces IL-6 and IL-10 Cytokine Secretion in Human Primary Leukocytes". ACS Pharmacology & Translational Science. 2 (6): 414–428. December 2019. doi:10.1021/acsptsci.9b00049. PMC 7088898. PMID 32259074.
- ^ "Sphingosine-1-phosphate suppresses TLR-induced CXCL8 secretion from human T cells". Journal of Leukocyte Biology. 93 (4): 521–8. April 2013. doi:10.1189/jlb.0712328. PMID 23345392.
- ^ "G protein-coupled receptors in the hypothalamic paraventricular and supraoptic nuclei--serpentine gateways to neuroendocrine homeostasis". Frontiers in Neuroendocrinology. 33 (1): 45–66. January 2012. doi:10.1016/j.yfrne.2011.07.002. PMC 3336209. PMID 21802439. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "G-protein-coupled receptors and cancer". Nature Reviews. Cancer. 7 (2): 79–94. February 2007. doi:10.1038/nrc2069. PMID 17251915.
- ^ "Molecular signatures of G-protein-coupled receptors". Nature. 494 (7436): 185–94. February 2013. Bibcode:2013Natur.494..185V. doi:10.1038/nature11896. PMID 23407534.
- ^ "Insights into the structure of class B GPCRs". Trends in Pharmacological Sciences. 35 (1): 12–22. January 2014. doi:10.1016/j.tips.2013.11.001. PMC 3931419. PMID 24359917.
- ^ "Crystal structure of rhodopsin: A G protein-coupled receptor". Science. 289 (5480): 739–45. August 2000. Bibcode:2000Sci...289..739P. CiteSeerX 10.1.1.1012.2275. doi:10.1126/science.289.5480.739. PMID 10926528. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Crystal structure of the human beta2 adrenergic G-protein-coupled receptor". Nature. 450 (7168): 383–7. November 2007. Bibcode:2007Natur.450..383R. doi:10.1038/nature06325. PMID 17952055. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "GPCR engineering yields high-resolution structural insights into beta2-adrenergic receptor function". Science. 318 (5854): 1266–73. November 2007. Bibcode:2007Sci...318.1266R. doi:10.1126/science.1150609. PMID 17962519. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Structure of a nanobody-stabilized active state of the β(2) adrenoceptor". Nature. 469 (7329): 175–80. January 2011. Bibcode:2011Natur.469..175R. doi:10.1038/nature09648. PMC 3058308. PMID 21228869. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Structure and function of an irreversible agonist-β(2) adrenoceptor complex". Nature. 469 (7329): 236–40. January 2011. Bibcode:2011Natur.469..236R. doi:10.1038/nature09665. PMC 3074335. PMID 21228876. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "The structural basis for agonist and partial agonist action on a β(1)-adrenergic receptor". Nature. 469 (7329): 241–4. January 2011. Bibcode:2011Natur.469..241W. doi:10.1038/nature09746. PMC 3023143. PMID 21228877. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Structure of an agonist-bound human A2A adenosine receptor". Science. 332 (6027): 322–7. April 2011. Bibcode:2011Sci...332..322X. doi:10.1126/science.1202793. PMC 3086811. PMID 21393508. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Crystal structure of the β2 adrenergic receptor-Gs protein complex". Nature. 477 (7366): 549–55. July 2011. Bibcode:2011Natur.477..549R. doi:10.1038/nature10361. PMC 3184188. PMID 21772288. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Cloning of adiponectin receptors that mediate antidiabetic metabolic effects". Nature. 423 (6941): 762–9. June 2003. Bibcode:2003Natur.423..762Y. doi:10.1038/nature01705. PMID 12802337. Unknown parameter
|displayauthors=ignored (bantuan) - ^ a b "Inactive-state preassembly of G(q)-coupled receptors and G(q) heterotrimers". Nature Chemical Biology. 7 (10): 740–7. August 2011. doi:10.1038/nchembio.642. PMC 3177959. PMID 21873996.
- ^ "beta-Arrestin: a protein that regulates beta-adrenergic receptor function". Science. 248 (4962): 1547–50. June 1990. Bibcode:1990Sci...248.1547L. doi:10.1126/science.2163110. PMID 2163110.
- ^ "The role of beta-arrestins in the termination and transduction of G-protein-coupled receptor signals". Journal of Cell Science. 115 (Pt 3): 455–65. February 2002. doi:10.1242/jcs.115.3.455. PMID 11861753.
|hdl-access=requires|hdl=(bantuan) - ^ "Distinct conformations of GPCR-β-arrestin complexes mediate desensitization, signaling, and endocytosis". Proceedings of the National Academy of Sciences of the United States of America. 114 (10): 2562–2567. March 2017. Bibcode:2017PNAS..114.2562C. doi:10.1073/pnas.1701529114. PMC 5347553. PMID 28223524. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Functional competence of a partially engaged GPCR-β-arrestin complex". Nature Communications. 7: 13416. November 2016. Bibcode:2016NatCo...713416K. doi:10.1038/ncomms13416. PMC 5105198. PMID 27827372. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "GPCR-G Protein-β-Arrestin Super-Complex Mediates Sustained G Protein Signaling". Cell. 166 (4): 907–919. August 2016. doi:10.1016/j.cell.2016.07.004. PMC 5418658. PMID 27499021. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Structure of an endosomal signaling GPCR-G protein-β-arrestin megacomplex". Nature Structural & Molecular Biology. 26 (12): 1123–1131. December 2019. doi:10.1038/s41594-019-0330-y. PMC 7108872. PMID 31740855. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "The year in G protein-coupled receptor research". Molecular Endocrinology. 24 (1): 261–74. January 2010. doi:10.1210/me.2009-0473. PMC 5428143. PMID 20019124.
- ^ "Thrombin and platelet activation". Chest. 124 (3 Suppl): 18S–25S. September 2003. doi:10.1378/chest.124.3_suppl.18S. PMID 12970120.
- ^ "Some G protein heterotrimers physically dissociate in living cells". Proceedings of the National Academy of Sciences of the United States of America. 103 (47): 17789–94. November 2006. Bibcode:2006PNAS..10317789D. doi:10.1073/pnas.0607116103. PMC 1693825. PMID 17095603.
- ^ "Activation of G protein-coupled receptors entails cysteine modulation of agonist binding". Journal of Molecular Structure: Theochem. 430: 57–71. 1998. doi:10.1016/S0166-1280(98)90217-2. Diarkibkan daripada yang asal pada 16 May 2011. Dicapai pada 14 January 2006.
- ^ "Integrin and GPCR Crosstalk in the Regulation of ASM Contraction Signaling in Asthma". Journal of Allergy. 2012: 341282. 2012. doi:10.1155/2012/341282. PMC 3465959. PMID 23056062.
- ^ "Biased agonists of the chemokine receptor CXCR3 differentially control chemotaxis and inflammation". Science Signaling. 11 (555): eaaq1075. November 2018. doi:10.1126/scisignal.aaq1075. PMC 6329291. PMID 30401786. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Social senses: G-protein-coupled receptor signaling pathways in Dictyostelium discoideum". Chemistry & Biology. 3 (4): 239–43. April 1996. doi:10.1016/S1074-5521(96)90103-9. PMID 8807851.
- ^ "A novel protein-protein interaction between a G protein-coupled receptor and the phosphatase SHP-2 is involved in bradykinin-induced inhibition of cell proliferation". The Journal of Biological Chemistry. 277 (43): 40375–83. October 2002. doi:10.1074/jbc.M202744200. PMID 12177051. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "G(i)-dependent localization of beta(2)-adrenergic receptor signaling to L-type Ca(2+) channels". Biophysical Journal. 79 (5): 2547–56. November 2000. doi:10.1016/S0006-3495(00)76495-2. PMC 1301137. PMID 11053129.
- ^ a b "Membrane trafficking of G protein-coupled receptors". Annual Review of Pharmacology and Toxicology. 44 (1): 559–609. 2004. doi:10.1146/annurev.pharmtox.44.101802.121558. PMID 14744258.
- ^ "G-protein-coupled receptor kinase 2 and hypertension: molecular insights and pathophysiological mechanisms". High Blood Pressure & Cardiovascular Prevention. 20 (1): 5–12. March 2013. doi:10.1007/s40292-013-0001-8. PMID 23532739.
- ^ "Mechanisms of regulation of the expression and function of G protein-coupled receptor kinases". Cellular Signalling. 15 (11): 973–81. November 2003. doi:10.1016/S0898-6568(03)00099-8. PMID 14499340.
- ^ "The role of sequestration in G protein-coupled receptor resensitization. Regulation of beta2-adrenergic receptor dephosphorylation by vesicular acidification". The Journal of Biological Chemistry. 272 (1): 5–8. January 1997. doi:10.1074/jbc.272.1.5. PMID 8995214.
- ^ "The interaction of beta-arrestin with the AP-2 adaptor is required for the clustering of beta 2-adrenergic receptor into clathrin-coated pits". The Journal of Biological Chemistry. 275 (30): 23120–6. July 2000. doi:10.1074/jbc.M002581200. PMID 10770944.
- ^ "The beta2-adrenergic receptor/betaarrestin complex recruits the clathrin adaptor AP-2 during endocytosis". Proceedings of the National Academy of Sciences of the United States of America. 96 (7): 3712–7. March 1999. Bibcode:1999PNAS...96.3712L. doi:10.1073/pnas.96.7.3712. PMC 22359. PMID 10097102.
- ^ "G-protein-coupled receptor phosphorylation: where, when and by whom". British Journal of Pharmacology. 153 (Suppl 1): S167–76. March 2008. doi:10.1038/sj.bjp.0707662. PMC 2268057. PMID 18193069.
- ^ "A trafficking checkpoint controls GABA(B) receptor heterodimerization". Neuron. 27 (1): 97–106. July 2000. doi:10.1016/S0896-6273(00)00012-X. PMID 10939334.
- ^ "Heterodimerization is required for the formation of a functional GABA(B) receptor". Nature. 396 (6712): 679–82. December 1998. Bibcode:1998Natur.396..679W. doi:10.1038/25354. PMID 9872316. Unknown parameter
|displayauthors=ignored (bantuan) - ^ a b "Independent HHsearch, Needleman--Wunsch-based, and motif analyses reveal the overall hierarchy for most of the G protein-coupled receptor families". Molecular Biology and Evolution. 28 (9): 2471–80. September 2011. doi:10.1093/molbev/msr061. PMID 21402729.
