Reseptor permukaan sel

Reseptor permukaan sel (reseptor membran, reseptor transmembran) ialah reseptor yang tertanam dalam membran plasma sel.[1] Mereka bertindak dalam pengisyaratan sel dengan menerima (mengikat) molekul ekstrasel. Ia merupakan protein membran integral khusus yang membolehkan komunikasi antara sel dan ruang ekstrasel. Molekul ekstrasel mungkin hormon, neurotransmiter, sitokin, faktor pertumbuhan, molekul lekatan sel atau nutrien; ia bertindak balas dengan reseptor untuk mendorong perubahan dalam metabolisme dan aktiviti sel. Dalam proses transduksi isyarat, pengikatan ligan mempengaruhi perubahan kimia berlata melalui membran sel.
Struktur dan mekanisme[sunting | sunting sumber]
Banyak reseptor membran adalah protein transmembran. Terdapat pelbagai jenis, termasuk glikoprotein dan lipoprotein.[2] Beratus-ratus reseptor berbeza diketahui, dan banyak lagi yang masih belum dikaji.[3][4] Reseptor transmembran biasanya dikelaskan berdasarkan struktur tertier (tiga dimensi) mereka. Jika struktur tiga dimensi tidak diketahui, ia boleh dikelaskan berdasarkan topologi membran. Dalam reseptor paling mudah, rantai polipeptida melintasi dwilapisan lipid sekali, manakala yang lain seperti reseptor bergandingan protein G melintasi sebanyak tujuh kali. Setiap membran sel boleh mempunyai beberapa jenis reseptor membran, dengan taburan yang berbeza-beza di permukaan. Reseptor tunggal juga boleh bertaburan secara berbeza pada kedudukan membran yang berbeza, bergantung pada jenis membran dan fungsi sel. Reseptor sering berkumpul di permukaan membran berbanding bertaburan secara sekata.[5][6]
Mekanisme[sunting | sunting sumber]
Dua model telah dicadangkan untuk menerangkan mekanisme tindakan reseptor transmembran.
- Pendimeran: Model pemdimeran mencadangkan bahawa sebelum pengikatan ligan, reseptor wujud dalam bentuk monomer. Apabila pengikatan agonis berlaku, monomer bergabung untuk membentuk dimer aktif.
- Putaran: Ligan yang terikat pada bahagian ekstrasel reseptor mendorong putaran (perubahan konformasi) sebahagian daripada heliks transmembran reseptor. Putaran mengubah bahagian reseptor mana yang terdedah terhadap bahagian intrasel membran, mengubah cara reseptor boleh berinteraksi dengan protein lain dalam sel.[7]
Domain[sunting | sunting sumber]

P = membran plasma
I = ruang intrasel
Reseptor transmembran dalam membran plasma biasanya boleh dibahagikan kepada tiga bahagian.
Domain ekstrasel[sunting | sunting sumber]
Domain ekstrasel merujuk kepada bahagian luaran sel atau organel. Jika rantai polipeptida melintasi dwilapisan beberapa kali, domain luaran terdiri daripada gelung yang terjalin merentasi membran. Berdasarkan takrifan, fungsi utama reseptor adalah untuk mengenali dan bertindak balas terhadap sejenis ligan. Contohnya, neurotransmiter, hormon atau ion atom mungkin terikat di domain ekstrasel sebagai ligan yang digabungkan dengan reseptor. Klotho ialah enzim yang memberi kesan kepada reseptor untuk mengenali ligan (FGF23).
Domain transmembran[sunting | sunting sumber]
Dua kelas reseptor transmembran yang paling banyak ialah GPCR dan protein transmembran lalu tunggal.[8][9] Dalam sesetengah reseptor, seperti reseptor asetilkolina nikotinik, domain transmembran membentuk liang protein melalui membran, atau di sekitar saluran ion. Selepas pengaktifan domain ekstrasel dengan ligan yang sesuai, liang dapat diakses oleh ion yang kemudiannya meresap. Dalam reseptor lain, domain transmembran mengalami perubahan konformasi apabila mengikat, dan memberi kesan terhadap keadaan intrasel. Dalam sesetengah reseptor seperti ahli superkeluarga 7TM, domain transmembran termasuk poket pengikat ligan.
Domain intrasel[sunting | sunting sumber]
Domain intraselular (atau sitoplasma) reseptor berinteraksi dengan bahagian dalam sel atau organel, menyampaikan isyarat. Terdapat dua laluan asas untuk interaksi ini:
- Domain intraselular berkomunikasi melalui interaksi protein-protein terhadap protein efektor, yang seterusnya menghantar isyarat ke destinasi.
- Dengan reseptor berkaitan enzim, domain intrasel mempunyai aktiviti enzim. Selalunya, ini adalah aktiviti tirosina kinase. Aktiviti enzim juga boleh disebabkan oleh enzim yang dikaitkan dengan domain intrasel.
Transduksi isyarat[sunting | sunting sumber]

Proses transduksi isyarat melalui reseptor membran melibatkan tindak balas luaran, di mana ligan mengikat reseptor membran, dan tindak balas dalaman, di mana tindak balas intrasel dicetuskan.[10][11]
Transduksi isyarat melalui reseptor membran memerlukan empat bahagian:
- Molekul isyarat ekstrasel: molekul isyarat ekstraselular dihasilkan oleh satu sel dan sekurang-kurangnya mampu bergerak ke sel jiran.
- Protein reseptor: sel mesti mempunyai protein reseptor permukaan sel yang mengikat molekul isyarat dan berkomunikasi ke dalam sel.
- Protein isyarat intrasel: ini menghantar isyarat kepada organel sel. Pengikatan molekul isyarat kepada protein reseptor akan mengaktifkan protein isyarat intraselular yang memulakan lata isyarat.
- Protein sasaran: konformasi atau sifat lain protein sasaran diubah apabila laluan isyarat aktif dan mengubah tingkah laku sel.[11]

Reseptor membran terutamanya dibahagikan mengikut struktur dan fungsi kepada 3 kelas: reseptor berhubungan saluran ion; reseptor berhubungan enzim; dan reseptor bergandingan protein G.
- Reseptor berhubungan saluran ion mempunyai saluran ion bagi anion dan kation, dan membentuk keluarga besar protein transmembran lalu berbilang. Ia mengambil bahagian dalam peristiwa isyarat pantas yang biasanya ditemui dalam sel yang aktif elektrik seperti neuron. Ia juga dipanggil saluran ion berpagaran ligan. Pembukaan dan penutupan saluran ion dikawal oleh neurotransmiter.
- Reseptor berhubungan enzim adalah sama ada enzim itu sendiri, atau secara langsung mengaktifkan enzim sekutuan. Ini biasanya merupakan reseptor lalu tunggal, dengan komponen enzim reseptor disimpan di dalam sel. Majoriti reseptor berkaitan enzim ialah atau bersekutu dengan kinase protein.
- Reseptor bergandingan protein G ialah protein membran integral yang mempunyai tujuh heliks transmembran. Reseptor ini mengaktifkan protein G dengan pengikatan agonis, dan protein G mengantara kesan reseptor terhadap laluan isyarat intrasel.
Reseptor berhubungan saluran ion[sunting | sunting sumber]
Semasa peristiwa transduksi isyarat dalam neuron, neurotransmiter mengikat kepada reseptor dan mengubah konformasi protein. Ini membuka saluran ion, membenarkan ion ekstrasel masuk ke dalam sel. Kebolehtelapan ion membran plasma diubah, dan ini mengubah isyarat kimia ekstrasel kepada isyarat elektrik intrasel yang mengubah pengujaan sel.[12]
Reseptor asetilkolina ialah reseptor yang dikaitkan dengan saluran kation. Protein terdiri daripada empat subunit: subunit alfa (α), beta (β), gama (γ), dan delta (δ). Terdapat dua subunit α dengan satu tapak pengikat asetilkolina setiap satu. Reseptor ini boleh wujud dalam tiga konformasi. Keadaan tertutup dan tidak berpenghuni ialah konformasi protein asli. Apabila dua molekul asetilkolin mengikat kedua-duanya pada tapak pengikatan pada subunit α, konformasi reseptor diubah dan pintu gerbang dibuka, membolehkan kemasukan banyak ion dan molekul kecil. Walau bagaimanapun, keadaan terbuka dan diduduki ini hanya bertahan untuk tempoh kecil dan kemudian pintu pagar ditutup, menjadi keadaan tertutup dan diduduki. Kedua-dua molekul asetilkolina tidak lama lagi akan berpisah daripada reseptor, mengembalikannya ke keadaan semula jadi tertutup dan tidak berpenghuni.[13][14]
Reseptor berhubungan enzim[sunting | sunting sumber]
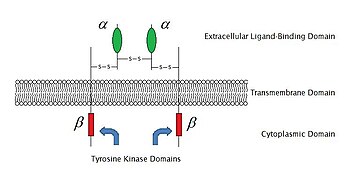
Sehingga 2009, terdapat 6 jenis reseptor berhubungan enzim yang diketahui: tirosina kinase reseptor; reseptor sekutuan tirosina kinase; tirosine fosfatase seperti reseptor; reseptor serina/treonina kinase; guanilil siklase reseptor; dan reseptor sekutuan histidina kinase. Tirosina kinase reseptor mempunyai populasi terbesar dan aplikasi terluas. Majoriti molekul ini ialah reseptor untuk faktor pertumbuhan seperti faktor pertumbuhan epidermis (EGF), faktor pertumbuhan terbitan platelet (PDGF), faktor pertumbuhan fibroblas (FGF), faktor pertumbuhan hepatosit (HGF), faktor pertumbuhan saraf (NGF) dan hormon seperti insulin. Kebanyakan reseptor ini akan dimerisasi selepas mengikat dengan ligannya, untuk mengaktifkan transduksi isyarat selanjutnya. Sebagai contoh, selepas reseptor EGF mengikat dengan ligan EGF, kedua-dua reseptor dimerisasi dan kemudian menjalani pemfosforilan sisa tirosina dalam bahagian enzim setiap molekul reseptor. Ini akan mengaktifkan tirosina kinase, dan memangkinkan tindak balas intrasel yang lebih lanjut.
Reseptor bergandingan protein G[sunting | sunting sumber]
Reseptor bergandingan protein G terdiri daripada keluarga protein besar reseptor transmembran. Mereka hanya terdapat dalam eukariota.[15] Ligan yang mengikat dan mengaktifkan reseptor ini termasuk: sebatian fotosensitif, bau, feromon, hormon dan neurotransmiter. Ini berbeza dari segi saiz daripada molekul kecil kepada peptida dan protein besar. Reseptor bergandingan protein G terlibat dalam banyak penyakit, dan dengan itu menjadi sasaran banyak ubat perubatan moden.[16]
Terdapat dua laluan transduksi isyarat utama yang melibatkan reseptor berganding G-protein: laluan isyarat cAMP dan laluan isyarat fosfatidilinositol.[17] Kedua-duanya dibantu melalui pengaktifan protein G. Protein G ialah protein trimer dengan tiga subunit ditetapkan sebagai α, β, dan γ. Sebagai tindak balas kepada pengaktifan reseptor, subunit α melepaskan guanosina difosfat (GDP) yang disesarkan oleh guanosina trifosfat (GTP), dengan itu mengaktifkan subunit α, yang kemudiannya berpisah daripada subunit β dan γ. Subunit α yang diaktifkan boleh menjejaskan protein isyarat intrasel atau menyasarkan protein berfungsi secara langsung.
Penyakit berkaitan reseptor membran[sunting | sunting sumber]
Jika reseptor membran ternyahasli atau kekurangan, transduksi isyarat boleh terhalang lalu menyebabkan penyakit. Sesetengah penyakit disebabkan oleh gangguan fungsi reseptor membran. Ini disebabkan oleh kekurangan atau penguraian reseptor melalui perubahan dalam gen yang mengekod dan mengawal protein reseptor. Reseptor membran TM4SF5 mempengaruhi penghijrahan sel hati dan hepatoma.[18] Selain itu, reseptor NMDA korteks mempengaruhi kecairan membran, dan terubah dalam penyakit Alzheimer.[19] Apabila sel dijangkiti oleh virus tidak bersampul, virus itu mula-mula mengikat kepada reseptor membran tertentu, dan kemudian melepasi dirinya sendiri atau komponen subviral ke bahagian sitoplasma membran sel. Dalam kes poliovirus, diketahui secara in vitro bahawa interaksi dengan reseptor menyebabkan penyusunan semula konformasi yang membebaskan protein virion yang dipanggil VP4. Terminus N VP4 adalah termiristil, dan dengan itu, bersifat hidrofobik (asid miristikː =CH3(CH2)12COOH). Ada usul bahawa perubahan konformasi yang disebabkan oleh pengikatan reseptor mengakibatkan pemasangan asid miristik pada VP4 dan pembentukan saluran untuk RNA.
Reka bentuk ubat berasaskan struktur[sunting | sunting sumber]

Melalui kaedah seperti kristalografi sinar-X dan spektroskopi NMR, maklumat tentang struktur 3D molekul sasaran telah meningkat mendadak, dan begitu juga maklumat struktur tentang ligan. Ini memacu perkembangan pesat reka bentuk ubat berasaskan struktur. Sesetengah ubat baru ini menyasarkan reseptor membran. Pendekatan semasa terhadap reka bentuk ubat berasaskan struktur boleh dibahagikan kepada dua kategori. Kategori pertama ialah menentukan ligan terhadap reseptor tertentu. Ini biasanya dicapai melalui pertanyaan pangkalan data, simulasi biofizik, dan pembinaan pustaka kimia. Dalam setiap kes, sejumlah besar molekul ligan berpotensi disaring untuk mencari yang sesuai dengan poket pengikat reseptor. Pendekatan ini biasanya dirujuk sebagai reka bentuk ubat berasaskan ligan. Kelebihan utama pencarian pangkalan data ialah ia menjimatkan masa dan kuasa untuk mendapatkan sebatian berkesan baharu. Satu lagi pendekatan pemetaan ligan secara gabungan, yang dirujuk sebagai reka bentuk ubat berasaskan reseptor. Dalam kes ini, molekul ligan direka bentuk dalam kekangan poket pengikat dengan memasang kepingan kecil secara berperingkat. Kepingan ini boleh sama ada atom atau molekul. Kelebihan utama kaedah sedemikian ialah struktur baharu boleh ditemui.[20][21][22]
Rujukan[sunting | sunting sumber]
- ^ "9.3: Signaling Molecules and Cellular Receptors - Types of Receptors". Biology LibreTexts (dalam bahasa Inggeris). 12 July 2018. Dicapai pada 24 July 2023.
- ^ Cuatrecasas P. (1974). "Membrane Receptors". Annual Review of Biochemistry. 43: 169–214. doi:10.1146/annurev.bi.43.070174.001125. PMID 4368906.
- ^ "The CRF peptide family and their receptors: yet more partners discovered". Trends Pharmacol. Sci. 23 (2): 71–7. February 2002. doi:10.1016/S0165-6147(02)01946-6. PMID 11830263.
- ^ "Formyl peptide receptor-like proteins are a novel family of vomeronasal chemosensors". Nature. 459 (7246): 574–7. May 2009. doi:10.1038/nature08029. PMID 19387439.
- ^ Rothberg K.G.; Ying Y.S.; Kamen B.A.; Anderson R.G. (1990). "Cholesterol controls the clustering of the glycophospholipid-anchored membrane receptor for 5-methyltetrahydrofolate". The Journal of Cell Biology. 111 (6): 2931–2938. doi:10.1083/jcb.111.6.2931. PMC 2116385. PMID 2148564.
- ^ Jacobson C.; Côté P.D.; Rossi S.G.; Rotundo R.L.; Carbonetto S. (2001). "The Dystroglycan Complex Is Necessary for Stabilization of Acetylcholine Receptor Clusters at Neuromuscular Junctions and Formation of the Synaptic Basement Membrane". The Journal of Cell Biology. 152 (3): 435–450. doi:10.1083/jcb.152.3.435. PMC 2195998. PMID 11157973.
- ^ Maruyama, Ichiro N. (2015-09-01). "Activation of transmembrane cell-surface receptors via a common mechanism? The "rotation model"". BioEssays. 37 (9): 959–967. doi:10.1002/bies.201500041. ISSN 1521-1878. PMC 5054922. PMID 26241732.
- ^ Superfamilies of single-pass transmembrane receptors in Membranome database
- ^ Superfamilies of single-pass transmembrane protein ligands and regulators of receptors in Membranome database
- ^ Ullricha A., Schlessingerb J.; Schlessinger, J (1990). "Signal transduction by receptors with tyrosine kinase activity". Cell. 61 (2): 203–212. doi:10.1016/0092-8674(90)90801-K. PMID 2158859.
- ^ a b Kenneth B. Storey (1990). Functional Metabolism. Wiley-IEEE. m/s. 87–94. ISBN 978-0-471-41090-4.
- ^ Hille B. (2001). Ion channels of excitable membranes. Sunderland, Mass. ISBN 978-0-87893-321-1.
- ^ Miyazawa A.; Fujiyoshi Y.; Unwin N. (2003). "Structure and gating mechanism of the acetylcholine receptor pore". Nature. 423 (6943): 949–955. doi:10.1038/nature01748. PMID 12827192.
- ^ Akabas M.H.; Stauffer D.A.; Xu M.; Karlin A. (1992). "Acetylcholine receptor channel structure probed in cysteine-substitution mutants". Science. 258 (5080): 307–310. doi:10.1126/science.1384130. PMID 1384130.
- ^ "Evolution of key cell signaling and adhesion protein families predates animal origins". Science. 301 (5631): 361–3. 2003. doi:10.1126/science.1083853. PMID 12869759.
- ^ Filmore, David (2004). "It's a GPCR world". Modern Drug Discovery. 2004 (November): 24–28.
- ^ Gilman A.G. (1987). "G Proteins: Transducers of Receptor-Generated Signals". Annual Review of Biochemistry. 56: 615–649. doi:10.1146/annurev.bi.56.070187.003151. PMID 3113327.
- ^ Müller-Pillascha F.; Wallrappa C.; Lachera U.; Friessb H.; Büchlerb M.; Adlera G.; Gress T. M. (1998). "Identification of a new tumour-associated antigen TM4SF5 and its expression in human cancer". Gene. 208 (1): 25–30. doi:10.1016/S0378-1119(97)00633-1. PMID 9479038.
- ^ Scheuer K.; Marasb A.; Gattazb W.F.; Cairnsc N.; Förstlb H.; Müller W.E. (1996). "Cortical NMDA Receptor Properties and Membrane Fluidity Are Altered in Alzheimer's Disease". Dementia. 7 (4): 210–214. doi:10.1159/000106881. PMID 8835885.
- ^ Wang R.; Gao Y.; Lai L. (2000). "LigBuilder: A Multi-Purpose Program for Structure-Based Drug Design". Journal of Molecular Modeling. 6 (7–8): 498–516. doi:10.1007/s0089400060498.
- ^ Schneider G.; Fechner U. (2005). "Computer-based de novo design of drug-like molecules". Nature Reviews Drug Discovery. 4 (8): 649–663. doi:10.1038/nrd1799. PMID 16056391.
- ^ Jorgensen W.L. (2004). "The Many Roles of Computation in Drug Discovery". Science. 303 (5665): 1813–1818. doi:10.1126/science.1096361. PMID 15031495.
Pautan luar[sunting | sunting sumber]
- Pangkalan Data IUPHAR GPCR Diarkibkan 2019-03-23 di Wayback Machine
- Cell+Surface+Receptors dalam Tajuk Subjek Perubatan (MeSH) di Perpustakaan Perubatan Negara AS
