Transkripsi (biologi)
Transkripsi ialah proses menyalin segmen DNA ke dalam RNA. Segmen DNA yang ditranskripsikan ke dalam molekul RNA yang boleh mengekod protein menghasilkan RNA pengutus (mRNA). Segmen DNA lain ditranskripsikan ke dalam molekul RNA yang dipanggil RNA bukan pengekod (ncRNA).
Kedua-dua DNA dan RNA ialah asid nukleik, yang menggunakan pasangan asas nukleotida sebagai bahasa pelengkap. Semasa transkripsi, urutan DNA dibaca oleh polimerase RNA, yang menghasilkan untaian RNA antiselari pelengkap yang dipanggil transkrip primer.
Dalam virologi, istilah transkripsi juga boleh digunakan apabila merujuk kepada sintesis mRNA daripada molekul RNA (iaitu setara dengan replikasi RNA). Sebagai contoh, genom virus RNA untaian tunggal deria negatif (ssRNA -) boleh menjadi templat RNA untaian tunggal deria positif (ssRNA +). Ini kerana helaian deria positif mengandungi maklumat urutan yang diperlukan untuk menterjemah protein virus yang diperlukan dalam replikasi virus. Proses ini dimangkinkan oleh replikase RNA virus.[1]
Latar belakang[sunting | sunting sumber]
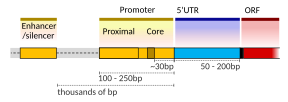
Pengekodan unit transkripsi DNA untuk protein mungkin mengandungi kedua-dua urutan pengekod yang akan diterjemahkan ke dalam protein, dan jujukan kawal atur yang mengarahkan dan mengawal sintesis protein tersebut. Urutan kawal selia sebelum (hulu) jujukan pengekod dipanggil kawasan tidak diterjemahkan lima prima (5' UTR); jujukan selepas (hilir) jujukan pengekod pula dipanggil kawasan tidak diterjemahkan tiga prima (3' UTR).[2]
Berbanding dengan replikasi DNA, transkripsi menghasilkan pelengkap RNA yang merangkumi nukleotida urasil (U) yang menggantikan timina (T) di pelengkap DNA.[3]
Hanya satu daripada dua helai DNA berfungsi sebagai templat untuk transkripsi. Untaian antideria DNA dibaca oleh RNA polimerase dari hujung 3' hingga 5' hujung semasa transkripsi (3' → 5'). RNA pelengkap dicipta dalam arah yang bertentangan, dalam arah 5' → 3', sepadan dengan urutan untaian deria, kecuali pertukaran urasil bagi timina. Arah ini adalah kerana polimerase RNA hanya boleh menambah nukleotida pada hujung 3' rantai mRNA yang terbina. Penggunaan hanya untaian DNA 3' → 5' ini menghilangkan keperluan serpihan Okazaki yang ada dalam replikasi DNA.[2] Ini juga menghilangkan keperluan primer RNA untuk memulakan sintesis RNA seperti dalam replikasi DNA.
Untaian bukan templat (deria) DNA dipanggil untaian pengekod kerana urutannya adalah sama dengan transkrip RNA yang baru dicipta (kecuali penggantian dengan urasil). Ini ialah helai yang digunakan berdasarkan tatanama apabila membentangkan urutan DNA.[4]
Transkripsi mempunyai beberapa mekanisme pembacaan pruf, tetapi kurang berkesan daripada kawalan untuk penyalinan DNA. Akibatnya, transkripsi mempunyai ketepatan penyalinan yang lebih rendah daripada replikasi DNA.[5]
Langkah-langkah utama[sunting | sunting sumber]
Transkripsi dibahagikan kepada permulaan, pelarian promoter, pemanjangan dan penamatan.[6]
Persediaan[sunting | sunting sumber]
Penguat, faktor transkripsi, kompleks perantara dan gelung DNA dalam transkripsi mamalia[sunting | sunting sumber]

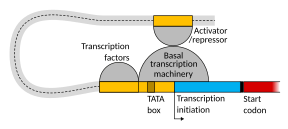
Penyediaan transkripsi dalam mamalia dikawal oleh banyak unsur kawal atur cis, termasuk unsur promoter teras dan proksimal promoter yang terletak berhampiran tapak permulaan transkripsi gen. Promoter teras yang bergabung dengan faktor transkripsi am adalah mencukupi untuk mengarahkan permulaan transkripsi, tetapi secara amnya mempunyai aktiviti basal yang rendah.[7] Modul kawal atur cis lain yang penting disetempatkan di kawasan DNA yang jauh dari tapak permulaan transkripsi. Ini termasuk penguat, penyenyap, penebat dan elemen penambatan.[8] Di antara aneka unsur ini, penambah dan faktor transkripsi yang berkaitan mempunyai peranan utama dalam permulaan transkripsi gen.[9] Penguat yang disetempatkan di kawasan DNA yang jauh daripada promoter gen boleh memberi kesan yang sangat besar terhadap transkripsi gen, dengan sesetengah gen mengalami peningkatan transkripsi sehingga 100 kali ganda disebabkan oleh penguat yang diaktifkan.[10]
Penguat ialah kawasan genom yang menjadi elemen kawal atur gen utama. Penguat mengawal program transkripsi gen jenis sel khusus, selalunya dengan menggelung melalui jarak jauh untuk mendekati promoter gen sasaran mereka.[11] Walaupun terdapat ratusan ribu kawasan DNA penguat,[12]dalam sebilangan tisu tertentu, hanya penambah khusus dirapatkan dengan promoter yang dikawal atur. Dalam kajian neuron korteks otak, 24,937 gelungan ditemui yang membawa penguat terhadap promoter sasaran.[10] Berbilang penguat, setiap satu selalunya berjarak puluhan atau ratusan ribu nukleotida jauh dari gen sasaran, bergelung ke promoter sasaran, dan boleh menyelaras antara satu sama lain untuk mengawal transkripsi gen sasaran.[11]
Ilustrasi skematik dalam bahagian ini menunjukkan penguat bergelung untuk mendekati promoter gen sasaran. Gelung distabilkan oleh dimer protein penyambung (cth., dimer CTCF atau YY1), dengan satu anggota dimer berlabuh pada motif pengikatnya di penguat, dan anggota lain berlabuh pada motif pengikatnya di promoter (diwakili oleh zigzag merah dalam ilustrasi).[13] Beberapa faktor transkripsi khusus fungsi sel (terdapat kira-kira 1,600 faktor transkripsi dalam sel manusia[14]) secara amnya terikat dalam motif khusus penguat,[15] dan sebilangan kecil faktor transkripsi terikat penambah ini mengawal kadar transkripsi gen sasaran apabila dibawa dekat dengan promoter melalui gelungan DNA. Mediator (kompleks biasanya terdiri daripada kira-kira 26 protein dalam struktur berinteraksi) menyampaikan isyarat kawal atur daripada faktor transkripsi terikat DNA penguat terus kepada enzim RNA polimerase II (pol II) yang terikat di promoter.[16]
Penguat yang aktif biasanya ditranskripsikan daripada kedua-dua helai DNA dengan RNA polimerase yang bertindak dalam dua arah berbeza, menghasilkan dua RNA penguat (eRNA) seperti yang digambarkan dalam rajah.[17] Penambah yang tidak aktif mungkin terikat oleh faktor transkripsi yang tidak aktif. Pemfosforilan faktor transkripsi boleh mengaktifkannya, dan faktor transkripsi yang diaktifkan kemudian boleh mengaktifkan penguat yang terikat (lihat bintang merah kecil yang mewakili pemfosforilan faktor transkripsi yang terikat terhadap penguat dalam ilustrasi).[18] Penguat aktif memulakan transkripsi RNA-nya sebelum mengaktifkan transkripsi RNA pengutus dari gen sasarannya.[19]
Pemetilan dan penyahmetilan pulau CpG[sunting | sunting sumber]

Kawal atur transkripsi pada kira-kira 60% daripada promoter juga dikawal oleh pemetilan sitosina dalam dinukleotida CpG (di mana sitosina 5' diikuti oleh guanina 3' atau tapak CpG). 5-metilsitosina (5-mC) ialah bentuk pemetilan sitosina (lihat rajah). 5-mC ialah penanda epigenetik yang ditemui terutamanya dalam tapak CpG. Kira-kira 28 juta dinukleotida CpG wujud dalam genom manusia.[20] Dalam kebanyakan tisu mamalia, secara purata, 70% hingga 80% sitosina CpG dimetilkan (membentuk 5-metilCpG atau 5-mCpG).[21] Sitosina bermetil dalam jujukan sitosina 5'-guanina 3' sering wujud berkumpulan, dipanggil pulau CpG. Kira-kira 60% jujukan promoter mempunyai pulau CpG, manakala hanya kira-kira 6% daripada jujukan penguat mempunyai pulau CpG.[22] Pulau CpG membentuk urutan kawal atur kerana jika pulau CpG dimetilkan dalam promoter gen, ini boleh mengurangkan atau menyenyapkan transkripsi gen.[23]
Pemetilan DNA mengawal transkripsi gen melalui interaksi dengan protein domain pengikat metil (MBD) seperti MeCP2, MBD1 dan MBD2. Protein MBD ini mengikat paling kuat terhadap pulau CpG yang sangat bermetil.[24] Protein MBD ini mempunyai kedua-dua domain pengikat metil-CpG serta domain penindasan transkripsi.[24] Ia mengikat DNA termetil, dan membimbing atau mengarahkan kompleks protein dengan pembentukan semula kromatin dan/atau aktiviti pengubahsuaian histon ke pulau CpG bermetil. Protein MBD secara amnya menindas kromatin tempatan seperti memangkinkan pengenalan penanda histon penindas atau mewujudkan persekitaran tindasan keseluruhan di kromatin melalui pembentukan semula nukleosom dan penyusunan semula kromatin.[24]

Seperti yang dinyatakan dalam bahagian sebelumnya, faktor transkripsi ialah protein yang mengikat urutan DNA tertentu untuk mengawal ekspresi gen. Jujukan pengikatan faktor transkripsi DNA biasanya kira-kira 10 atau 11 nukleotida panjang. Seperti yang diringkaskan pada tahun 2009, Vaquerizas et al. menyatakan bahawa terdapat kira-kira 1,400 faktor transkripsi berbeza yang dikodkan dalam genom manusia oleh gen yang membentuk kira-kira 6% daripada semua gen pengekod protein manusia.[25] Kira-kira 94% daripada tapak pengikat faktor transkripsi (TFBS) yang dikaitkan dengan gen responsif isyarat wujud dalam penambah, manakala hanya kira-kira 6% daripada TFBS tersebut berlaku dalam promoter.[15]
Protein EGR1 ialah faktor transkripsi khusus yang penting dalam kawal atur pemetilan pulau CpG. Tapak pengikat faktor transkripsi EGR1 selalunya terletak dalam jujukan penguat atau promoter.[26] Terdapat kira-kira 12,000 tapak pengikatan EGR1 dalam genom mamalia dan kira-kira separuh daripada tapak pengikatan EGR1 terletak di promoter dan separuh lagi dalam penguat.[26] Pengikatan EGR1 terhadap tapak pengikatan DNA sasarannya tidak sensitif terhadap pemetilan sitosina dalam DNA.[26]
Walaupun hanya sejumlah kecil protein faktor transkripsi EGR1 yang dapat dikesan dalam sel yang tidak dirangsang, terjemahan gen EGR1 ke dalam protein dalam satu jam selepas rangsangan meningkat secara drastik.[27] Pengeluaran protein faktor transkripsi EGR1 dalam pelbagai jenis sel boleh dirangsang oleh faktor pertumbuhan, neurotransmiter, hormon, tekanan dan kecederaan.[27] Di otak, apabila neuron diaktifkan, protein EGR1 dikawal atur, dan ia mengikat (merekrut) enzim TET1 sedia ada yang dihasilkan dalam jumlah tinggi dalam neuron. Enzim TET boleh memangkinkan penyahmetilan 5-metilsitosina. Apabila faktor transkripsi EGR1 membawa enzim TET1 ke tapak pengikat EGR1 dalam promoter, enzim TET boleh menyahmetilkan pulau CpG yang ada di promoter tersebut. Selepas penyametilan, promoter ini kemudiannya boleh memulakan transkripsi gen sasaran mereka. Beratus-ratus gen dalam neuron dinyatakan secara berbeza selepas pengaktifan neuron melalui pengambilan EGR1 oleh TET1 terhadap jujukan kawal selua pemetilan dalam promoternya.[26]
Metilasi promoter juga diubah sebagai tindak balas kepada isyarat. Tiga DNA metiltransferase mamalia (DNMT1, DNMT3A dan DNMT3B) memangkinkan penambahan kumpulan metil kepada sitosina dalam DNA. Walaupun DNMT1 ialah metiltransferase penyelenggaraan, DNMT3A dan DNMT3B boleh menjalankan pemetilan baharu. Terdapat juga dua isobentuk protein hiris cantum yang dihasilkan daripada gen DNMT3A: protein DNA metiltransferase, DNMT3A1 dan DNMT3A2.[28]
Isobentuk sambatan DNMT3A2 berkelakuan seperti produk gen awal segera klasik, dan sebagai contoh, ia dihasilkan secara teguh dan sementara selepas pengaktifan neuron.[29] Tempat di mana isobentuk DNA metiltransferase DNMT3A2 mengikat dan menambah kumpulan metil terhadap sitosina nampaknya ditentukan oleh pengubahsuaian pascaterjemahan histon.[30][31][32]
Sebaliknya, pengaktifan saraf menyebabkan penguraian DNMT3A1, disertai dengan pengurangan pemetilan sekurang-kurangnya satu promoter sasaran yang dinilai.[33]
Permulaan[sunting | sunting sumber]
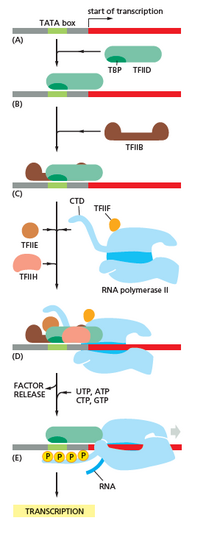
Transkripsi bermula dengan polimerase RNA dan satu atau lebih faktor transkripsi umum yang mengikat jujukan promoter DNA untuk membentuk kompleks tertutup promoter-RNA polimerase. Dalam kompleks tertutup, DNA promoter masih beruntaian ganda dua sepenuhnya.[6]
RNA polimerase dibantu oleh satu atau lebih faktor transkripsi umum, kemudian melepaskan kira-kira 14 pasangan bes DNA untuk membentuk kompleks terbuka promoter-RNA polimerase. Dalam kompleks terbuka, DNA promoter sebahagiannya tidak terbuka dan beruntai tunggal. DNA beruntai tunggal yang terdedah dirujuk sebagai "gelembung transkripsi".[6]
Polimerase RNA yang dibantu oleh satu atau lebih faktor transkripsi umum kemudian memilih tapak permulaan transkripsi dalam gelembung transkripsi, dan mengikat kepada NTP permulaan dan NTP lanjutan (atau primer RNA pendek dan NTP lanjutan) yang melengkapi urutan tapak permulaan transkripsi, dan memangkinkan pembentukan ikatan untuk menghasilkan satu produk RNA awal.[6]
Dalam bakteria, holoenzim polimerase RNA terdiri daripada lima subunit: 2 subunit α, 1 subunit β, 1 subunit β', dan 1 subunit ω. Dalam bakteria, terdapat satu faktor transkripsi RNA umum yang dikenali sebagai faktor sigma. Enzim teras polimerase RNA mengikat kepada faktor transkripsi umum (sigma) bakteria untuk membentuk holoenzim polimerase RNA, dan kemudiannya mengikat promoter.[6] (RNA polimerase dipanggil holoenzim apabila subunit sigma dilekatkan pada enzim teras yang terdiri daripada 2 subunit α, 1 subunit β, subunit 1 β' sahaja). Tidak seperti dalam eukariot, nukleotida permulaan mRNA bakteria baru lahir tidak dihadkan dengan nukleotida guanina yang diubah suai. Nukleotida permulaan transkrip bakteria mengandungi 5' trifosfat (5'-PPP) yang boleh digunakan dalam pemetaan genom seluruh tapak permulaan transkripsi.[35]
Dalam arkea dan eukariot, RNA polimerase mengandungi subunit homolog kepada setiap lima subunit RNA polimerase dalam bakteria, dan juga mengandungi subunit tambahan. Dalam arkea dan eukariot, fungsi sigma faktor transkripsi umum bakteria dilakukan oleh beberapa faktor transkripsi umum yang berfungsi bersama.[6] Dalam arkea, terdapat tiga faktor transkripsi umum: TBP, TFB dan TFE. Dalam eukariot, dalam transkripsi bergantungan RNA polimerase II, terdapat enam faktor transkripsi umum: TFIIA, TFIIB (ortolog TFB arkea), TFIID (faktor multisubunit di mana subunit utama, TBP, ialah ortolog TBP arkea), TFIIE (sebuah ortolog TFE kuno), TFIIF dan TFIIH. TFIID ialah komponen pertama yang mengikat DNA oleh kerana pengikatan TBP, manakala TFIIH ialah komponen terakhir yang diambil. Dalam kedua-dua domain, kompleks tertutup promoter-RNA polimerase biasanya dirujuk sebagai "kompleks prapermulaan".[36]
Permulaan transkripsi dikawal oleh protein tambahan yang dikenali sebagai pengaktif dan penindas, dan, dalam beberapa kes, kopengaktif atau kopenindas yang berkaitan yang memodulasi pembentukan dan fungsi kompleks permulaan transkripsi.[6]
Pengeluaran dari promoter[sunting | sunting sumber]
Selepas ikatan pertama disintesis, RNA polimerase mesti keluar dari promoter. Pada masa ini, terdapat kecenderungan untuk melepaskan transkrip RNA dan menghasilkan transkrip terpotong. Ini dipanggil permulaan terbantut, dan biasa berlaku dalam kedua-dua eukariot dan prokariot.[37]
Secara mekanikal, pengeluaran promoter berlaku melalui pemampatan DNA, memberikan tenaga yang diperlukan untuk memecahkan interaksi antara holoenzim polimerase RNA dan promoter.[38]
Dalam bakteria, tanggapan dahulukala ialah faktor sigma pasti dikeluarkan selepas pelepasan promoter berlaku. Teori ini telah dikenali sebagai model pelepasan wajib. Walau bagaimanapun, data terkemudian menunjukkan bahawa ketika dan selepas pelepasan promoter, faktor sigma dikeluarkan mengikut model stokastik yang dikenali sebagai model keluaran stokastik.[39]
Dalam eukariot pula, ketika pelepasan promoter, TFIIH memfosforilkan serina 5 di domain terminal karboksi RNA polimerase II di promoter bergantungan polimerase, dan membawa kepada pengambilan enzim pelindung (CE).[40][41] Mekanisme tepat bagaimana CE mendorong pelepasan promoter dalam eukariot belum diketahui.
Pemanjangan[sunting | sunting sumber]

Satu helai DNA, untaian templat (atau untaian bukan pengekod), digunakan sebagai templat sintesis RNA. Semasa transkripsi diteruskan, RNA polimerase merentasi untaian templat dan menggunakan pelengkap pasangan bes dengan templat DNA untuk mencipta salinan RNA (yang memanjang semasa perjalanan). Walaupun RNA polimerase merentasi untaian templat dari 3' → 5', untaian pengekod (bukan templat) dan RNA yang baru terbentuk juga boleh digunakan sebagai titik rujukan, jadi transkripsi boleh digambarkan sebagai berlaku 5' → 3'. Ini menghasilkan molekul RNA daripada 5' → 3', salinan tepat helai pengekodan (kecuali timina digantikan dengan urasil, dan nukleotida terdiri daripada gula ribosa (5-karbon) di mana DNA pula mempunyai deoksiribosa (kurang satu atom oksigen) dalam tulang belakang gula-fosfatnya).[3]
Transkripsi mRNA boleh melibatkan berbilang RNA polimerase di satu templat DNA serta berbilang pusingan transkripsi (penguatan mRNA tertentu), membolehkan begitu banyak molekul mRNA boleh dihasilkan dengan cepat daripada satu salinan gen. Kadar pemanjangan lazim dalam prokariot dan eukariota ialah kira-kira 10–100 nt/saat.[42] Walau bagaimanapun, dalam eukariot, nukleosom bertindak sebagai penghalang utama untuk mentranskripsi polimerase semasa pemanjangan transkripsi.[43][44] Dalam organisma ini, jeda yang disebabkan oleh nukleosom boleh dikawal oleh faktor pemanjangan transkripsi seperti TFIIS.[44]
Pemtusan dwiuntai kawasan DNA yang ditranskripsi secara aktif dibaiki oleh rekombinasi homolog semasa fasa S dan G2 kitaran sel.[45][46] Memandangkan transkripsi meningkatkan kebolehcapaian DNA terhadap bahan kimia eksogen dan metabolit dalaman yang boleh menyebabkan kerosakan rekombinan, rekombinasi homolog bagi jujukan DNA tertentu mungkin dirangsang kuat oleh transkripsi.[47]
Penamatan[sunting | sunting sumber]
Bakteria menggunakan dua strategi berbeza untuk penamatan transkripsi - penamatan bebas Rho dan bergantungan Rho. Dalam penamatan transkripsi bebas Rho, transkripsi RNA berhenti apabila molekul RNA yang baru disintesis membentuk gelung pin rambut kaya dengan jujukan guanosina-sitidina (GC) diikuti dengan rentetan urasil (U). Apabila "pin rambut" terbentuk, tekanan mekanikal memecahkan ikatan rU-dA yang lemah yang kini mengisi hibrid DNA-RNA. Ini menarik transkrip poli-U keluar dari tapak aktif polimerase lalu menamatkan transkripsi. Dalam penamatan bergantungan Rho, faktor Rho, suatu faktor protein, mengganggu kestabilan interaksi antara templat dan mRNA lalu melepaskan mRNA yang baru disintesis dari kompleks pemanjangan.[48]
Penamatan transkripsi dalam eukariota kurang difahami dengan baik berbanding bakteria, tetapi melibatkan pembelahan transkrip baharu, diikuti dengan penambahan adenina bebas templat di hujung 3' baharunya, dalam proses yang dipanggil pempoliadenilan.[49]
Di luar penamatan oleh jujukan penamat (yang merupakan sebahagian daripada gen), transkripsi juga mungkin perlu ditamatkan apabila ia menghadapi keadaan seperti kerosakan DNA atau garpu replikasi aktif. Dalam bakteria, ATPase Mfd boleh mengeluarkan polimerase yang terhenti di kerosakan dengan membuka pengapitnya. Ia juga merekrut jentera pembaikan pemotongan nukleotida untuk membaiki kerosakan. Mfd juga dicadangkan dalam penyelesaian konflik antara replikasi DNA dan transkripsi.[50] Dalam eukaiot, ATPase TTF2 membantu menyekat tindakan RNAP I dan II semasa mitosis, menghalang ralat dalam pemisahan kromosom.[51] Dalam arkea, Eta ATPase dicadangkan untuk memainkan peranan yang sama.[52]
Pascatranskripsi RNA[sunting | sunting sumber]
Polimerase RNA memainkan peranan yang sangat penting dalam semua langkah termasuk, perubahan pascatranskripsi dalam RNA.
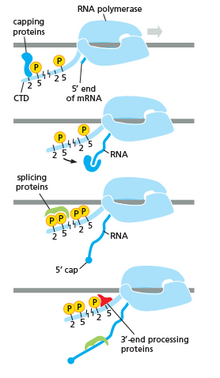
Seperti yang ditunjukkan dalam imej sebelah kanan, jelas bahawa CTD (domain terminal C) ialah suatu ekor yang mengubah bentuknya; ekor ini akan digunakan sebagai pembawa penyambungan, penutup dan poliadenilasi, seperti yang ditunjukkan dalam imej sebelah kiri.[53]
Perencat[sunting | sunting sumber]
Perencat transkripsi boleh digunakan sebagai antibiotik terhadap, contohnya, bakteria patogen (antibakteria) dan kulat (antikulat). Contoh antibakteria sedemikian ialah rifampisin yang menghalang transkripsi bakteria DNA ke dalam mRNA dengan menghalang polimerase RNA bergantungan DNA dengan mengikat subunit betanya, manakala 8-hidroksikuinolina ialah perencat transkripsi antikulat.[54] Kesan pemetilan histon juga mungkin berfungsi untuk menghalang tindakan transkripsi. Produk semula jadi bioaktif yang kuat seperti triptolida yang menghalang transkripsi mamalia melalui perencatan subunit XPB faktor transkripsi umum TFIIH telah dilaporkan sebagai konjugat glukosa untuk menyasarkan sel kanser hipoksia dengan peningkatan pengeluaran pengangkut glukosa.[55]
Perencat endogen[sunting | sunting sumber]
Dalam vertebrata, majoriti penganjur gen mengandungi pulau CpG dengan banyak tapak CpG.[56] Apabila banyak tapak CpG promoter gen dimetilkan, gen menjadi terhalang (disenyapkan).[57] Kanser kolorektum biasanya mempunyai 3 hingga 6 mutasi pemandu, dan 33 hingga 66 mutasi penumpang.[58] Walau bagaimanapun, perencatan transkripsi mungkin lebih penting daripada mutasi dalam menyebabkan perkembangan kanser. Sebagai contoh, dalam kanser kolorektum, kira-kira 600 hingga 800 gen dihalang transkripsi oleh pemetilan pulau CpG. Penindasan transkripsi dalam kanser juga boleh berlaku oleh mekanisme epigenetik lain seperti pengeluaran mikro-RNA yang diubah.[59] Dalam barah payudara, penindasan transkripsi BRCA1 mungkin berlaku lebih kerap oleh mikro-RNA-182 yang terlalu banyak terhasil daripada hipermetilasi promoter BRCA1.[perlu rujukan]
Kilang transkripsi[sunting | sunting sumber]
Unit transkripsi aktif dikelompokkan dalam nukleus, di tapak diskret yang dipanggil kilang transkripsi atau eukromatin. Tapak sedemikian boleh ditampakkan dengan membenarkan polimerase terlibat memanjangkan transkripnya dalam pelopor berteg (Br-UTP atau Br-U) atau dengan imunopelabelan RNA baharu yang diteg. Kilang transkripsi juga boleh disetempatkan menggunakan penghibridan in situ pendarfluor atau ditandai oleh antibodi yang diarahkan terhadap polimerase. Terdapat ~10,000 kilang dalam nukleoplasma sel HeLa, antaranya ialah ~8,000 kilang polimerase II dan ~2,000 kilang polimerase III. Setiap kilang polimerase II mengandungi ~8 polimerase. Memandangkan kebanyakan unit transkripsi aktif dikaitkan dengan hanya satu polimerase, setiap kilang biasanya mengandungi ~8 unit transkripsi yang berbeza. Unit ini mungkin dikaitkan melalui promoter dan/atau penambah dengan gelung membentuk "awan" di sekeliling faktor tersebut.[60]
Sejarah[sunting | sunting sumber]
Molekul yang membolehkan bahan genetik direalisasikan sebagai protein pertama kali dihipotesiskan oleh François Jacob dan Jacques Monod. Severo Ochoa memenangi Hadiah Nobel dalam Fisiologi atau Perubatan pada tahun 1959 kerana membangunkan proses untuk mensintesis RNA secara in vitro dengan polinukleotida fosforilase yang menjadi berguna untuk memecahkan kod genetik. Sintesis RNA oleh RNA polimerase telah ditubuhkan secara in vitro oleh beberapa makmal pada tahun 1965; bagaimanapun, RNA yang disintesis oleh enzim ini mempunyai sifat yang mencadangkan kewujudan faktor tambahan yang diperlukan untuk menamatkan transkripsi dengan betul.[perlu rujukan]
Roger D. Kornberg memenangi Hadiah Nobel dalam Kimia 2006 "sempena kajiannya tentang asas molekul transkripsi eukariot."[61]
Pengukuran dan pengesanan[sunting | sunting sumber]
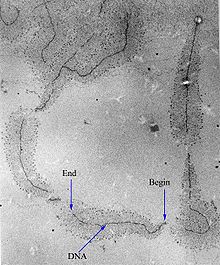
Transkripsi boleh diukur dan dikesan dalam pelbagai cara:
- Asai transkripsi kaset tanpa G: mengukur kekuatan promoter
- Ujian transkripsi larian: mengenal pasti tapak permulaan transkripsi (TSS)
- Ujian larian nukleus: mengukur kelimpahan relatif transkrip yang baru dibentuk
- KAS-seq: mengukur DNA untai tunggal yang dihasilkan oleh polimerase RNA; boleh dibuat dengan 1,000 sel.[62]
- Ujian perlindungan RNase dan ChiP-Chip RNAP: mengesan tapak transkripsi aktif
- RT-PCR: mengukur kelimpahan mutlak tahap RNA total atau nukleus, tetapi mungkin berbeza daripada kadar transkripsi
- Mikroarai DNA: mengukur kelimpahan relatif bagi jumlah global atau paras RNA nuklear; bagaimanapun, ini mungkin berbeza daripada kadar transkripsi
- Penghibridan in situ: mengesan kehadiran transkrip
- Penandaan MS2: dengan memasukkan gelung batang RNA seperti MS2 ke dalam gen, ini akan digabungkan ke dalam RNA yang baru disintesis. Gelung batang kemudiannya boleh dikesan menggunakan gabungan GFP dan protein kot MS2 yang mempunyai pertalian tinggi serta interaksi jujukan khusus dengan gelung batang MS2. Pengambilan GFP ke tapak transkripsi digambarkan sebagai tempat pendarfluor tunggal. Pendekatan baharu ini telah mendedahkan bahawa transkripsi berlaku dalam letusan terputus-putus atau denyutan. Dengan pengecualian ketara dalam teknik in situ, kebanyakan kaedah lain menyediakan purata populasi sel, dan tidak mampu mengesan sifat asas gen ini.[63]
- Blot Northern: kaedah tradisional, dan sehingga kemunculan RNA-Seq, yang paling kuantitatif
- RNA-Seq: menggunakan teknik penjujukan generasi lanjutan untuk menyusun keseluruhan transkrip, dan membolehkan pengukuran kelimpahan relatif RNA serta pengesanan variasi tambahan seperti gen gabungan, suntingan pascatranskripsi dan tapak hiris cantum baharu
- RNA-Seq sel tunggal: menguatkan dan membaca transkrip separa daripada sel terpencil, membolehkan analisis terperinci RNA dalam tisu, embrio dan kanser
Transkripsi terbalik[sunting | sunting sumber]
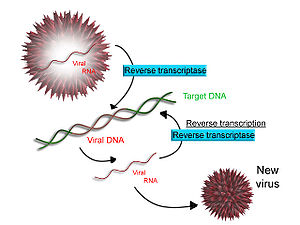
Sesetengah virus (seperti HIV, penyebab AIDS), mempunyai keupayaan untuk menyalin RNA ke dalam DNA. HIV mempunyai genom RNA yang ditranskripsi secara terbalik menjadi DNA. DNA yang terhasil boleh digabungkan dengan genom DNA sel perumah. Enzim utama yang bertanggungjawab untuk sintesis DNA daripada templat RNA dipanggil sebagai transkriptase terbalik.[64]
Dalam kes HIV, transkripase terbalik bertanggungjawab dalam mensintesis untaian DNA pelengkap (cDNA) kepada genom RNA virus. Enzim ribonuklease H kemudiannya mencerna helai RNA, dan transkripase terbalik mensintesis untaian pelengkap DNA untuk membentuk struktur DNA heliks berganda (cDNA). cDNA disepadukan ke dalam genom sel perumah oleh enzim integrase, lalu menyebabkan sel perumah menjana protein virus yang terhimpun semula menjadi zarah virus baharu.
Sesetengah sel eukariot mengandungi enzim dengan aktiviti transkripsi terbalik yang dipanggil telomerase. Telomerase membawa templat RNA dari mana ia mensintesis telomer, sejenis urutan DNA berulang, di penghujung kromosom linear. Ia adalah penting kerana setiap kali kromosom linear digandakan, ia menjadi pendek. Dengan telomer di hujung kromosom, pemendekan menghilangkan beberapa urutan berulang yang tidak penting berbanding jujukan DNA pengekod protein yang terletak jauh dari hujung kromosom.
Telomerase sering diaktifkan dalam sel barah untuk membolehkan sel barah menyalin genom mereka tanpa had tanpa kehilangan urutan DNA pengekod protein yang penting. Pengaktifan telomerase boleh menjadi sebahagian daripada proses yang membolehkan sel kanser bersifat abadi. Faktor pengabadian kanser melalui pemanjangan telomer akibat telomerase telah terbukti berlaku dalam 90% daripada semua barah karsinogen in vivo, dengan baki 10% menggunakan laluan penyelenggaraan telomer alternatif yang dipanggil pemanjangan telomer alternatif (ALT).[65]
Rujukan[sunting | sunting sumber]
- ^ "Tentative identification of RNA-dependent RNA polymerases of dsRNA viruses and their relationship to positive strand RNA viral polymerases". FEBS Letters. 252 (1–2): 42–6. July 1989. doi:10.1016/0014-5793(89)80886-5. PMID 2759231.
- ^ a b Eldra P. Solomon, Linda R. Berg, Diana W. Martin. Biology, 8th Edition, International Student Edition. Thomson Brooks/Cole. ISBN 978-0495317142
- ^ a b Clark, David P. (2005-06-24). Molecular Biology (dalam bahasa Inggeris). Elsevier. m/s. 134. ISBN 978-0-08-045421-4.
- ^ "DNA Strands". www.sci.sdsu.edu. Diarkibkan daripada yang asal pada 27 October 2017. Dicapai pada 1 May 2018.
- ^ Berg J, Tymoczko JL, Stryer L (2006). Biochemistry (ed. 6th). San Francisco: W. H. Freeman. ISBN 0-7167-8724-5.
- ^ a b c d e f g Watson JD, Baker TA, Bell SP, Gann AA, Levine M, Losick RM (2013). Molecular Biology of the Gene (ed. 7th). Pearson.
- ^ "Eukaryotic core promoters and the functional basis of transcription initiation". Nat Rev Mol Cell Biol. 19 (10): 621–637. October 2018. doi:10.1038/s41580-018-0028-8. PMC 6205604. PMID 29946135.
- ^ "The Why of YY1: Mechanisms of Transcriptional Regulation by Yin Yang 1". Front Cell Dev Biol. 8: 592164. 2020. doi:10.3389/fcell.2020.592164. PMC 7554316. PMID 33102493.
- ^ "Transcription factors: from enhancer binding to developmental control". Nat Rev Genet. 13 (9): 613–26. September 2012. doi:10.1038/nrg3207. PMID 22868264.
- ^ a b "Three-dimensional genome restructuring across timescales of activity-induced neuronal gene expression". Nat Neurosci. 23 (6): 707–717. June 2020. doi:10.1038/s41593-020-0634-6. PMC 7558717. PMID 32451484.
- ^ a b "Long-range enhancer-promoter contacts in gene expression control". Nat Rev Genet. 20 (8): 437–455. August 2019. doi:10.1038/s41576-019-0128-0. PMID 31086298.
- ^ "Enhancers: five essential questions". Nat Rev Genet. 14 (4): 288–95. April 2013. doi:10.1038/nrg3458. PMC 4445073. PMID 23503198.
- ^ "YY1 Is a Structural Regulator of Enhancer-Promoter Loops". Cell. 171 (7): 1573–1588.e28. December 2017. doi:10.1016/j.cell.2017.11.008. PMC 5785279. PMID 29224777.
- ^ "The Human Transcription Factors". Cell. 172 (4): 650–665. February 2018. doi:10.1016/j.cell.2018.01.029. PMID 29425488.
- ^ a b "Positional specificity of different transcription factor classes within enhancers". Proc Natl Acad Sci U S A. 115 (30): E7222–E7230. July 2018. Bibcode:2018PNAS..115E7222G. doi:10.1073/pnas.1804663115. PMC 6065035. PMID 29987030.
- ^ "The Mediator complex: a central integrator of transcription". Nat Rev Mol Cell Biol. 16 (3): 155–66. March 2015. doi:10.1038/nrm3951. PMC 4963239. PMID 25693131.
- ^ "The degree of enhancer or promoter activity is reflected by the levels and directionality of eRNA transcription". Genes Dev. 32 (1): 42–57. January 2018. doi:10.1101/gad.308619.117. PMC 5828394. PMID 29378788.
- ^ "MAP kinase phosphorylation-dependent activation of Elk-1 leads to activation of the co-activator p300". EMBO J. 22 (2): 281–91. January 2003. doi:10.1093/emboj/cdg028. PMC 140103. PMID 12514134.
- ^ "Enhancer RNAs predict enhancer-gene regulatory links and are critical for enhancer function in neuronal systems". Nucleic Acids Res. 48 (17): 9550–9570. September 2020. doi:10.1093/nar/gkaa671. PMC 7515708. PMID 32810208.
- ^ "DNA methylation in human epigenomes depends on local topology of CpG sites". Nucleic Acids Res. 44 (11): 5123–32. June 2016. doi:10.1093/nar/gkw124. PMC 4914085. PMID 26932361.
- ^ "Cytosine methylation and CpG, TpG (CpA) and TpA frequencies". Gene. 333: 143–9. May 2004. doi:10.1016/j.gene.2004.02.043. PMID 15177689.
- ^ "Pervasive and CpG-dependent promoter-like characteristics of transcribed enhancers". Nucleic Acids Res. 48 (10): 5306–5317. June 2020. doi:10.1093/nar/gkaa223. PMC 7261191. PMID 32338759.
- ^ "DNA methylation patterns and epigenetic memory". Genes Dev. 16 (1): 6–21. January 2002. doi:10.1101/gad.947102. PMID 11782440.
- ^ a b c "Methyl-CpG-binding domain proteins: readers of the epigenome". Epigenomics. 7 (6): 1051–73. 2015. doi:10.2217/epi.15.39. PMID 25927341.
- ^ "A census of human transcription factors: function, expression and evolution". Nat. Rev. Genet. 10 (4): 252–63. April 2009. doi:10.1038/nrg2538. PMID 19274049.
- ^ a b c d "EGR1 recruits TET1 to shape the brain methylome during development and upon neuronal activity". Nat Commun. 10 (1): 3892. August 2019. Bibcode:2019NatCo..10.3892S. doi:10.1038/s41467-019-11905-3. PMC 6715719. PMID 31467272.
- ^ a b "Genome-wide investigation of in vivo EGR-1 binding sites in monocytic differentiation". Genome Biol. 10 (4): R41. 2009. doi:10.1186/gb-2009-10-4-r41. PMC 2688932. PMID 19374776.
- ^ "Neuronal DNA Methyltransferases: Epigenetic Mediators between Synaptic Activity and Gene Expression?". Neuroscientist. 24 (2): 171–185. April 2018. doi:10.1177/1073858417707457. PMC 5846851. PMID 28513272.
- ^ "Rescue of aging-associated decline in Dnmt3a2 expression restores cognitive abilities". Nat Neurosci. 15 (8): 1111–3. July 2012. doi:10.1038/nn.3151. PMID 22751036.
- ^ "The Dnmt3a PWWP domain reads histone 3 lysine 36 trimethylation and guides DNA methylation". J Biol Chem. 285 (34): 26114–20. August 2010. doi:10.1074/jbc.M109.089433. PMC 2924014. PMID 20547484.
- ^ "Isoform-specific localization of DNMT3A regulates DNA methylation fidelity at bivalent CpG islands". EMBO J. 36 (23): 3421–3434. December 2017. doi:10.15252/embj.201797038. PMC 5709737. PMID 29074627.
- ^ "H3K36me2/3 Binding and DNA Binding of the DNA Methyltransferase DNMT3A PWWP Domain Both Contribute to its Chromatin Interaction". J Mol Biol. 431 (24): 5063–5074. December 2019. doi:10.1016/j.jmb.2019.09.006. PMID 31634469.
- ^ "Synaptic control of DNA methylation involves activity-dependent degradation of DNMT3A1 in the nucleus". Neuropsychopharmacology. 45 (12): 2120–2130. November 2020. doi:10.1038/s41386-020-0780-2. PMC 7547096. PMID 32726795.
- ^ a b Pakay, Julian; Duivenvoorden, Hendrika; Shafee, Thomas; Clarke, Kaitlin (2023). Threshold Concepts in Biochemistry. La Trobe eBureau. doi:10.26826/1017. ISBN 978-0-6484681-9-6. S2CID 258899183 Check
|s2cid=value (bantuan). - ^ Boutard, Magali (2016). "Global repositioning of transcription start sites in a plant-fermenting bacterium". Nature Communications. 7: 13783. Bibcode:2016NatCo...713783B. doi:10.1038/ncomms13783. PMC 5171806. PMID 27982035.
- ^ Roeder, Robert G. (1991). "The complexities of eukaryotic transcription initiation: regulation of preinitiation complex assembly". Trends in Biochemical Sciences. 16 (11): 402–408. doi:10.1016/0968-0004(91)90164-Q. ISSN 0968-0004. PMID 1776168.
- ^ "Direct detection of abortive RNA transcripts in vivo". Science. 324 (5929): 927–8. May 2009. Bibcode:2009Sci...324..927G. doi:10.1126/science.1169237. PMC 2718712. PMID 19443781.
- ^ "Abortive initiation and productive initiation by RNA polymerase involve DNA scrunching". Science. 314 (5802): 1139–43. November 2006. Bibcode:2006Sci...314.1139R. doi:10.1126/science.1131398. PMC 2754787. PMID 17110577.
- ^ "Holoenzyme switching and stochastic release of sigma factors from RNA polymerase in vivo". Molecular Cell. 20 (3): 357–66. November 2005. doi:10.1016/j.molcel.2005.10.011. PMID 16285918.
- ^ "Functional interactions of RNA-capping enzyme with factors that positively and negatively regulate promoter escape by RNA polymerase II". Proceedings of the National Academy of Sciences of the United States of America. 101 (20): 7572–7. May 2004. Bibcode:2004PNAS..101.7572M. doi:10.1073/pnas.0401493101. PMC 419647. PMID 15136722.
- ^ "Transcription factors IIE and IIH and ATP hydrolysis direct promoter clearance by RNA polymerase II". Cell. 77 (1): 145–56. April 1994. doi:10.1016/0092-8674(94)90242-9. PMID 8156590.
- ^ Milo, Ron; Philips, Rob. "Cell Biology by the Numbers: What is faster, transcription or translation?". book.bionumbers.org. Diarkibkan daripada yang asal pada 20 April 2017. Dicapai pada 8 March 2017.
- ^ "Nucleosomal fluctuations govern the transcription dynamics of RNA polymerase II". Science. 325 (5940): 626–8. July 2009. Bibcode:2009Sci...325..626H. doi:10.1126/science.1172926. PMC 2775800. PMID 19644123.
- ^ a b "Nucleosomal arrangement affects single-molecule transcription dynamics". Proceedings of the National Academy of Sciences. 113 (45): 12733–12738. 2016. Bibcode:2016PNAS..11312733F. doi:10.1073/pnas.1602764113. PMC 5111697. PMID 27791062.
- ^ Aymard F, Bugler B, Schmidt CK, Guillou E, Caron P, Briois S, Iacovoni JS, Daburon V, Miller KM, Jackson SP, Legube G. Transcriptionally active chromatin recruits homologous recombination at DNA double-strand breaks. Nat Struct Mol Biol. 2014 Apr;21(4):366-74. doi: 10.1038/nsmb.2796. Epub 2014 Mar 23. PMID: 24658350; PMCID: PMC4300393
- ^ Ouyang J, Yadav T, Zhang JM, Yang H, Rheinbay E, Guo H, Haber DA, Lan L, Zou L. RNA transcripts stimulate homologous recombination by forming DR-loops. Nature. 2021 Jun;594(7862):283-288. doi: 10.1038/s41586-021-03538-8. Epub 2021 May 12. PMID: 33981036; PMCID: PMC8855348
- ^ García-Rubio M, Huertas P, González-Barrera S, Aguilera A. Recombinogenic effects of DNA-damaging agents are synergistically increased by transcription in Saccharomyces cerevisiae. New insights into transcription-associated recombination. Genetics. 2003 Oct;165(2):457-66. doi: 10.1093/genetics/165.2.457. PMID: 14573461; PMCID: PMC1462770
- ^ "Rho-dependent termination and ATPases in transcript termination". Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression. 1577 (2): 251–260. September 2002. doi:10.1016/S0167-4781(02)00456-6. PMID 12213656.
- ^ "Overlapping pathways dictate termination of RNA polymerase II transcription". Biochimie. 89 (10): 1177–82. October 2007. doi:10.1016/j.biochi.2007.05.007. PMID 17629387.
- ^ Shi, J; Wen, A; Zhao, M; Jin, S; You, L; Shi, Y; Dong, S; Hua, X; Zhang, Y (18 November 2020). "Structural basis of Mfd-dependent transcription termination". Nucleic Acids Research. 48 (20): 11762–11772. doi:10.1093/nar/gkaa904. PMC 7672476. PMID 33068413.
- ^ Jiang, Y; Liu, M; Spencer, CA; Price, DH (7 May 2004). "Involvement of transcription termination factor 2 in mitotic repression of transcription elongation". Molecular Cell. 14 (3): 375–85. doi:10.1016/s1097-2765(04)00234-5. PMID 15125840.
- ^ Marshall, CJ; Qayyum, MZ; Walker, JE; Murakami, KS; Santangelo, TJ (9 August 2022). "The structure and activities of the archaeal transcription termination factor Eta detail vulnerabilities of the transcription elongation complex". Proceedings of the National Academy of Sciences of the United States of America. 119 (32): e2207581119. Bibcode:2022PNAS..11907581M. doi:10.1073/pnas.2207581119. PMC 9371683 Check
|pmc=value (bantuan). PMID 35917344 Check|pmid=value (bantuan). - ^ Cramer, P.; Armache, K.-J.; Baumli, S.; Benkert, S.; Brueckner, F.; Buchen, C.; Damsma, G.E.; Dengl, S.; Geiger, S.R. (June 2008). "Structure of Eukaryotic RNA Polymerases". Annual Review of Biophysics. 37 (1): 337–352. doi:10.1146/annurev.biophys.37.032807.130008. ISSN 1936-122X. PMID 18573085.
- ^ http://www.sigmaaldrich.com/US/en/product/sial/h6878 8-Hydroxyquinoline from SIGMA-ALDRICH. Retrieved 2022-02-15
- ^ "A Glucose-Triptolide Conjugate Selectively Targets Cancer Cells under Hypoxia". iScience. 23 (9): 101536. 2020. Bibcode:2020iSci...23j1536D. doi:10.1016/j.isci.2020.101536. PMC 7509213. PMID 33083765.
- ^ "A genome-wide analysis of CpG dinucleotides in the human genome distinguishes two distinct classes of promoters". Proceedings of the National Academy of Sciences of the United States of America. 103 (5): 1412–7. January 2006. Bibcode:2006PNAS..103.1412S. doi:10.1073/pnas.0510310103. PMC 1345710. PMID 16432200.
- ^ "DNA methylation patterns and epigenetic memory". Genes & Development. 16 (1): 6–21. January 2002. doi:10.1101/gad.947102. PMID 11782440.
- ^ "Cancer genome landscapes". Science. 339 (6127): 1546–58. March 2013. Bibcode:2013Sci...339.1546V. doi:10.1126/science.1235122. PMC 3749880. PMID 23539594.
- ^ "MicroRNAs in the DNA Damage/Repair Network and Cancer". International Journal of Genomics. 2014: 820248. 2014. doi:10.1155/2014/820248. PMC 3926391. PMID 24616890.
- ^ "TNFα signals through specialized factories where responsive coding and miRNA genes are transcribed". The EMBO Journal. 31 (23): 4404–14. November 2012. CiteSeerX 10.1.1.919.1919. doi:10.1038/emboj.2012.288. PMC 3512387. PMID 23103767.
- ^ "Chemistry 2006". Nobel Foundation. Diarkibkan daripada yang asal pada March 15, 2007. Dicapai pada March 29, 2007.
- ^ "Kethoxal-assisted single-stranded DNA sequencing captures global transcription dynamics and enhancer activity in situ". Nature Methods. 17 (5): 515–523. April 2020. doi:10.1038/s41592-020-0797-9. PMC 7205578. PMID 32251394.
- ^ "Nature, nurture, or chance: stochastic gene expression and its consequences". Cell. 135 (2): 216–26. October 2008. doi:10.1016/j.cell.2008.09.050. PMC 3118044. PMID 18957198.
- ^ Clark, David P. (2005-06-24). Molecular Biology (dalam bahasa Inggeris). Elsevier. m/s. 63. ISBN 978-0-08-045421-4.
- ^ "Alternative lengthening of telomeres: models, mechanisms and implications". Nature Reviews Genetics. 11 (5): 319–30. May 2010. doi:10.1038/nrg2763. PMID 20351727.