Ikatan glikosidik
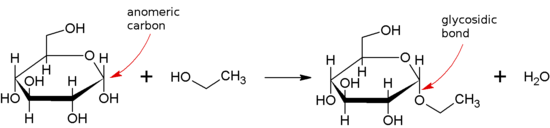
Ikatan glikosidik ialah sejenis ikatan eter yang bergabung dengan molekul karbohidrat (gula) kepada kumpulan lain, yang mungkin atau mungkin bukan karbohidrat lain.
Ikatan glikosidik terbentuk antara kumpulan hemiasetal atau hemiketal sakarida (atau molekul terbitan sakarida), dan kumpulan hidroksil beberapa sebatian seperti alkohol. Bahan yang mengandungi ikatan glikosidik ialah glikosida.
Istilah "glikosida" kini diluaskan untuk meliputi sebatian dengan ikatan yang terbentuk antara kumpulan gula hemiasetal (atau hemiketal) dan beberapa kumpulan kimia selain hidroksil, seperti -SR (tioglikosida), -SeR (selenoglikosida), -NR1R2 (N-glikosida), atau -CR1R2R3 (C-glikosida).
Khususnya dalam glikosida semula jadi, sebatian ROH dari mana sisa karbohidrat telah dikeluarkan sering dipanggil aglikon, dan sisa karbohidrat itu sendiri kadangkala dirujuk sebagai "glikon".
Ikatan S-, N-, C- dan O-glikosidik[sunting | sunting sumber]
Ikatan glikosidik dalam bentuk yang dibincangkan di atas dikenali sebagai "ikatan O-glikosidik", merujuk kepada oksigen glikosidik yang menghubungkan glikosida kepada aglikon atau mengurangkan gula akhir. Dalam analogi, seseorang juga berfikir tentang ikatan S-glikosidik (yang membentuk tioglikosida), di mana oksigen ikatan glikosidik digantikan dengan atom sulfur. Dengan cara sama, ikatan N-glikosidik mempunyai ikatan glikosidik oksigen digantikan dengan nitrogen. Bahan yang mengandungi ikatan N-glikosidik juga dikenali sebagai glikosilamina. Ikatan C-glikosil mempunyai oksigen glikosidik digantikan oleh karbon; istilah "C-glikosida" dianggap salah oleh IUPAC, dan tidak digalakkan.[1] Semua ikatan glikosidik terubah suai ini mempunyai kerentanan yang berbeza terhadap hidrolisis, dan dalam kes struktur C-glikosil, ia biasanya lebih kalis hidrolisis.
Penomboran dan perbezaan ikatan glikosidik α/β[sunting | sunting sumber]

Apabila pusat anomer terlibat dalam ikatan glikosidik (seperti kelaziman semula jadi) maka seseorang boleh membezakan antara ikatan α- dan β-glikosidik dengan stereokimia relatif kedudukan anomerik dan pusat stereo yang paling jauh dari C1 dalam sakarida.[2]
Pendekatan kimia[sunting | sunting sumber]
Nüchter et al. (2001) telah menunjukkan pendekatan baru terhadap pengglikosidaan Fischer.[3][4][5] Dengan ketuhar gelombang mikro yang dilengkapi dengan radas refluks dalam reaktor pemutar dengan bom tekanan, Nüchter et al. (2001) dapat mencapai α- dan β-D-glukosida dengan pemerolehan 100%. Kaedah ini boleh dilakukan pada skala berbilang kilogram.
Kaedah Vishal Y Joshi[sunting | sunting sumber]
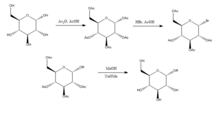
Joshi et al. (2006)[6] mencadangkan kaedah Koenigs-Knorr dalam sintesis stereoselektif alkil D-glukopiranosida melalui pengglikosilan dengan pengecualian menggunakan litium karbonat yang lebih murah dan beracun daripada kaedah lazim yang menggunakan garam perak atau merkuri. D-glukosa mula-mulanya dilindungi dengan membentuk perasetat dengan penambahan anhidrida asetik dalam asid asetik, disusuli penambahan hidrogen bromida yang berbrominat pada kedudukan 5. Dengan penambahan ROH alkohol dan litium karbonat, OR menggantikan bromin, dan apabila hidroksil pengasetilan dinyahlindung, produk disintesis dalam ketulenan yang agak tinggi. Ia dicadangkan oleh Joshi et al. (2001) bahawa litium bertindak sebagai nukleofil yang menyerang karbon pada kedudukan 5, dan melalui keadaan peralihan, alkohol digantikan dengan kumpulan bromin. Kelebihan kaedah ini serta stereoselektivi dan kos rendah garam litium termasuk ia boleh dilakukan pada suhu bilik dan hasilnya agak baik berbanding dengan kaedah Koenigs-Knorr konvensional.[7]
Glikosida hidrolase[sunting | sunting sumber]
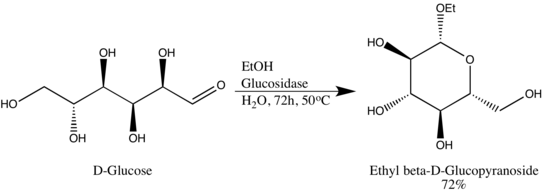
Hidrolase glikosida (atau glikosidase), ialah enzim yang memecahkan ikatan glikosidik. Hidrolase glikosida biasanya boleh bertindak sama ada pada ikatan α- atau pada ikatan β-glikosidik, tetapi tidak kedua-duanya. Pengkhususan ini membolehkan penyelidik mendapatkan glikosida dalam lebihan epimerik yang tinggi, satu contoh ialah penukaran D-glukosa oleh Wen-Ya Lu kepada etil β-D-glukopiranosida menggunakan glukosidase yang diperoleh secara semula jadi. Perlu diingat bahawa Wen-Ya Lu menggunakan glukosidase secara terbalik, bertentangan dengan fungsi biologi enzim:[8]
Glikosiltransferase[sunting | sunting sumber]

Sebelum unit monosakarida digabungkan ke dalam glikoprotein, polisakarida atau lipid dalam organisma hidup, mereka biasanya mula-mula "diaktifkan" dengan pencantuman melalui ikatan glikosidik kepada kumpulan fosfat nukleotida seperti uridina difosfat (UDP), guanosina difosfat (GDP), timidina difosfat (TDP) atau sitidina monofosfat (CMP). Perantaraan biokimia yang diaktifkan ini dikenali sebagai gula nukleotida atau penderma gula. Banyak laluan biosintetik menggunakan mono- atau oligosakarida yang diaktifkan oleh ikatan difosfat kepada lipid seperti dolikol. Penderma yang diaktifkan ini kemudiannya adalah substrat untuk enzim yang dikenali sebagai glikosiltransferase, yang memindahkan unit gula daripada penderma diaktifkan kepada nukleofil penerima (substrat penerima).
Disakarida fosforilase[sunting | sunting sumber]
Pendekatan biomangkin yang berbeza telah dibangunkan ke arah sintesis glikosida dalam dekad yang lalu, yang menggunakan "glikosiltransferase" dan "hidrolase glikosida" sebagai pemangkinan yang paling biasa. Enzim pertama sering memerlukan bahan yang mahal dan kemudiannya sering menunjukkan hasil yang rendah, De Winter et al.[10] menyiasat penggunaan selobiosa fosforilase (CP) terhadap sintesis alfa-glikosida dalam cecair berion. Keadaan terbaik bagi penggunaan CP didapati dengan kehadiran IL AMMOENG 101 dan etil asetat.
Glikosilasi terarah[sunting | sunting sumber]
Pelbagai pendekatan kimia wujud untuk menggalakkan selektiviti ikatan α- dan β-glikosidik. Sifat kekhususan substrat yang sangat ketat dan aktiviti keseluruhan piranosida boleh memberikan kesukaran sintetik utama. Kekhususan keseluruhan pengglikosilan boleh dipertingkatkan dengan menggunakan pendekatan yang mengambil kira keadaan peralihan relatif yang boleh dilalui karbon anomer semasa pengglikosilan biasa. Paling ketara, pengiktirafan dan penggabungan model Felkin-Ahn-Eisenstein ke dalam reka bentuk kimia rasional secara amnya boleh memberikan hasil yang boleh dipercayai, dengan syarat bahawa transformasi boleh menjalani kawalan konformasi jenis ini dalam keadaan peralihan.
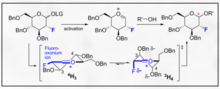
Pengglikosilan terarah fluorin mewakili pegangan yang menggalakkan terhadap selektiviti B dan pengenalan fungsi C2 biomimetik bukan semula jadi terhadap karbohidrat. Satu contoh yang disediakan oleh Bucher et al. menyediakan cara untuk menggunakan ion fluorooksonium dan trikloroasetimidat untuk menggalakkan stereoselektiviti B melalui kesan gauche.[11] Stereoselektiviti yang munasabah ini jelas melalui visualisasi model Felkin-Ahn bagi bentuk konformasi kerusi yang mungkin.
Kaedah ini mewakili cara yang menggalakkan untuk menggabungkan B-etil, isopropil dan glikosida lain secara khusus dengan kimia trikloroasetimidat biasa.
Glikopeptida berikatan O dan kegunaan[sunting | sunting sumber]
Glikopeptida berikatan O baru-baru ini telah ditunjukkan menunjukkan kebolehtelapan dan keberkesanan sistem saraf pusat (CNS) yang sangat baik dalam pelbagai model haiwan dengan penyakit. Di samping itu, salah satu aspek yang paling menarik ialah keupayaan O-glikosilasi untuk memanjangkan separuh hayat, mengurangkan pelepasan dan meningkatkan PK/PD peptida aktif melebihi peningkatan penembusan CNS. Penggunaan semula jadi gula sebagai bahagian pelarut dalam metabolisme Fasa II dan III (asid glukuronik) telah mewujudkan kelebihan evolusi kerana enzim mamalia tidak secara langsung berkembang untuk menguraikan produk terglikosilasi O di bahagian yang lebih besar.
Sifat khusus glikopeptida ikatan O ialah terdapat banyak contoh yang merupakan penembus CNS. Asas asas kesan ini dianggap melibatkan "lompatan membran" atau "serapan lompat". Proses yang dipacu gerakan bukan Brown ini dianggap berlaku disebabkan oleh ketakselanjaran membran plasma. "Sebaran lompat" terutamanya menggabungkan resapan bebas dan peralihan antara bahagian. Contoh terkini termasuk kebolehtelapan tinggi analog met-enkephalin. Pentapetida mOR agonis penuh, DAMGO, juga merupakan penembus CNS dengan glikosilasi.[12][13][14]
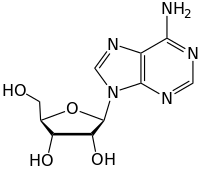
Ikatan N-glikosidik dalam DNA[sunting | sunting sumber]
Molekul DNA mengandungi cincin karbon beranggota 5 yang dipanggil ribosa yang melekat terus kepada dua kumpulan fosfat dan nukleobase yang mengandungi kumpulan amino. Atom nitrogen daripada kumpulan amino dalam nukleotida dikaitkan secara kovalen dengan karbon anomer struktur gula ribosa melalui ikatan N-glikosidik. Kadangkala, nukleobes yang melekat di ribosa mengalami penyahaminaan, pengalkilan atau pengoksidaan yang mengakibatkan lesi sitotoksik di sepanjang tulang belakang DNA. Pengubahsuaian ini sangat mengancam kepaduan molekul DNA, yang membawa kepada perkembangan penyakit seperti kanser. DNA glikosilase ialah enzim yang memangkinkan hidrolisis ikatan N-glikosidik untuk membebaskan nukleobes yang rosak atau diubah suai daripada DNA, dengan membelah ikatan glikosidik karbon-nitrogen pada karbon 2', seterusnya memulakan laluan pembaikan pemotongan bes (BER).
Glikosilase monofungsi memangkinkan hidrolisis ikatan N-glikosidik sama ada melalui mekanisme seperti SN1 yang berperingkat atau mekanisme seperti SN2 yang bersepadu. Dalam gaya berperingkat, nukleobes bertindak sebagai kumpulan peninggal sebelum karbon anomerik diserang oleh molekul air, menghasilkan perantaraan ion oksakarbenium tidak stabil berhayat pendek. Perantaraan ini bertindak balas dengan pantas dengan molekul air berdekatan untuk menggantikan ikatan N-glikosidik ribosa dan nukleobes dengan ikatan O-glikosidik dengan kumpulan hidroksi. Dalam mekanisme bersepadu, air bertindak sebagai nukleofil dan menyerang karbon anomerik sebelum nukleobes bertindak seperti kumpulan peninggal. Perantaraan yang dihasilkan ialah ion oksakarbenium yang serupa di mana kedua-dua kumpulan hidroksi dan nukleobase masih melekat pada karbon anomer. Kedua-dua mekanisme secara teorinya menghasilkan produk yang sama. Kebanyakan ribonukleotida dihidrolisiskan melalui mekanisme seperti SN2 gabungan, manakala kebanyakan deoksiribonukleotida meneruskan melalui mekanisme berperingkat.
Tindak balas ini secara amnya tidak dapat diterbalikkan. Oleh kerana pembelahan ikatan N-glikosidik daripada tulang belakang DNA boleh membawa kepada tindak balas mutagen dan sitotoksik yang memudaratkan organisma, terdapat juga keupayaan untuk memangkinkan sintesis ikatan N-glikosidik melalui tapak DNA tanpa bes dan nukleobase tertentu.[15]
Rujukan[sunting | sunting sumber]
- ^ "Nomenclature of Carbohydrates (Recommendations 1996)". Department of Chemistry, Queen Mary University of London.
- ^ Bertozzi C, Rabuka D (2009). "Structural Basis of Glycan Diversity". Dalam Varki A, Cummings RD, Esko JD, dll. (penyunting). Essentials of Glycobiology (ed. 2nd). Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-770-9.
- ^ Fischer, Emil (1893). "Ueber die Glucoside der Alkohole". Berichte der deutschen chemischen Gesellschaft. 26 (3): 2400–2412. doi:10.1002/cber.18930260327.
- ^ Fischer, Emil (1895). "Ueber die Verbindungen der Zucker mit den Alkoholen und Ketonen". Berichte der Deutschen Chemischen Gesellschaft (dalam bahasa Inggeris). 28 (1): 1145–1167. doi:10.1002/cber.189502801248. ISSN 1099-0682.
- ^ Nüchter, Matthias; Ondruschka, Bernd; Lautenschläger, Werner (2001). "Microwave-Assisted Synthesis of Alkyl Glycosides". Synthetic Communications. 31 (9): 1277–1283. doi:10.1081/scc-100104035. ISSN 0039-7911.
- ^ "A convenient stereoselective synthesis of β-D-glucopyranosides". Indian Journal of Chemistry. 45B: 461–465. 2006.
- ^ "Ueber einige Derivate des Traubenzuckers und der Galactose". Berichte der Deutschen Chemischen Gesellschaft. 34 (1): 957–981. 1901. doi:10.1002/cber.190103401162.
- ^ a b Lu WY, Lin GQ, Yu HL, Tong AM, Xu JH (2009-12-09). Whittall J, Sutton PW (penyunting). Practical Methods for Biocatalysis and Biotransformations. John Wiley & Sons. m/s. 236–239. ISBN 978-0-470-74859-6.
- ^ "Fluorine-directed glycosylation". Angewandte Chemie International Edition. 49 (46): 8724–8. November 2010. doi:10.1002/anie.201004467. PMID 20886497.
- ^ "Chemoenzymatic Synthesis of β-D Glucosides using Cellobiose Phosphorylase from Clostridium thermocellum". Advanced Synthesis & Catalysis. 357 (8): 1961–1969. 2015. doi:10.1002/adsc.201500077. ISSN 1615-4150.
- ^ Durantie, Estelle; Bucher, Christoph; Gilmour, Ryan (16 May 2012). "Fluorine-Directed β-Galactosylation: Chemical Glycosylation Development by Molecular Editing". Chemistry – A European Journal. 18 (26): 8208–8215. doi:10.1002/chem.201200468. PMID 22592962. Dicapai pada 24 April 2022.
- ^ "Improved bioavailability to the brain of glycosylated Met-enkephalin analogs". Brain Research. 881 (1): 37–46. October 2000. doi:10.1016/S0006-8993(00)02794-3. PMID 11033091. Unknown parameter
|displayauthors=ignored (bantuan) - ^ "Glycosylated neuropeptides: a new vista for neuropsychopharmacology?". Medicinal Research Reviews. 25 (5): 557–585. September 2005. doi:10.1002/med.20039. PMID 16075406.
- ^ Egleton, Richard D.; Bilsky, Edward J.; Tollin, Gordon; Dhanasekaran, Muthu; Lowery, John; Alves, Isabel; Davis, Peg; Porreca, Frank; Yamamura, Henry I. (2005-01-10). "Biousian glycopeptides penetrate the blood–brain barrier". Tetrahedron: Asymmetry. Carbohydrate Science. Part 1. 16 (1): 65–75. doi:10.1016/j.tetasy.2004.11.038.
- ^ "Mechanisms for enzymatic cleavage of the N-glycosidic bond in DNA". Organic & Biomolecular Chemistry. 12 (42): 8367–8378. November 2014. doi:10.1039/c4ob01063a. PMC 4238931. PMID 25181003.
