Hem

Hem ialah sebuah pelopor hemoglobin yang berperanan dalam berikat dengan oksigen dalam pengangkutan darah. Hem dihasilkan di sumsum tulang serta hati.[1] Perkataan ini terbit daripada perkataan Yunani Purba αἷμα haima yang bererti "darah".
Secara lazim, hem dikenali sebagai komponen hemoglobin, pigmen merah dalam darah, tetapi juga ditemui dalam protein-protein darah utama lain seperti mioglobin, sitokrom, katalase, heme peroksidase sintase nitrik oksida endotelium.[2][3]
Jenis
[sunting | sunting sumber]Hem terdiri daripada beberapa jenis lazim seperti dalam jadual di bawah. Hem B ialah jenis paling lazim, dengan hem-hem utama lain termasuk hem A dan hem C. Hem-hem yang wujud secara terasing lazimnya diwakili huruf besar sementara hem yang terikat dengan protein diwakili dengan huruf kecil. Sitrokom a merujuk kepada hem A dalam suatu gabungan dengan protein membran yang membentuk sebahagian sitokrom c oksidase.[4]
| Hem A | Hem B | Hem C | Hem O | ||
|---|---|---|---|---|---|
| Nombor PubChem | 7888115 | 444098 | 444125 | 6323367 | |
| Formula kimia | C49H56O6N4Fe | C34H32O4N4Fe | C34H36O4N4S2Fe | C49H58O5N4Fe | |
| Kumpulan berfungsi di C3 | 
|
–CH(OH)CH2Far | –CH=CH2 | –CH(sistein-S-il)CH3 | –CH(OH)CH2Far |
| Kumpulan berfungsi di C8 | –CH=CH2 | –CH=CH2 | –CH(sistein-S-il)CH3 | –CH=CH2 | |
| Kumpulan berfungsi di C18 | –CH=O | –CH3 | –CH3 | –CH3 | |
Sintesis
[sunting | sunting sumber]
Proses enzimatik yang menghasilkan heme dengan betul dipanggil sintesis porfirin, dengan semua perantaraan ialah tetrapirol yang dikelaskan sebagai porfirin secara kimia. Proses ini sangat dipelihara merentasi alam biologi. Dalam manusia, laluan ini berfungsi hampir khususnya untuk membentuk heme. Dalam bakteria, ia juga menghasilkan bahan yang lebih kompleks seperti kofaktor F430 dan kobalamin (vitamin B 12).[5]
Laluan ini dimulakan oleh sintesis asid δ-aminolevulinik (dALA atau δALA) daripada glisina dan suksinil-KoA daripada kitaran asid sitrik (kitaran Krebs). Enzim pengehad kadar yang bertanggungjawab bagi tindak balas ini, ALA sintase, dikawal secara negatif oleh glukosa dan kepekatan hem. Mekanisme perencatan ALA oleh hem atau hemin adalah dengan mengurangkan kestabilan sintesis mRNA dan mengurangkan pengambilan mRNA dalam mitokondria. Mekanisme ini mempunyai kepentingan terapeutik: penyerapan hem arginat atau hematin, dan glukosa boleh menghentikan serangan porfiria selaan akut pada pesakit dengan ralat metabolisme proses ini, dengan mengurangkan transkripsi ALA sintase.[6]
Organ-organ yang terlibat terutamanya dalam sintesis hem ialah hati (di mana kadar sintesis sangat berubah-ubah, bergantung kepada kumpulan hem sistemik) dan sumsum tulang (di mana kadar sintesis Heme secara relatifnya tetap dan bergantung kepada pengeluaran rantaian globin), walaupun setiap sel memerlukan hem untuk berfungsi dengan baik. Walau bagaimanapun, disebabkan sifat toksiknya, protein seperti hemopeksin (Hx) diperlukan untuk membantu mengekalkan simpanan fisiologi besi agar ia dapat digunakan dalam sintesis.[7] Hem dilihat sebagai molekul perantaraan dalam katabolisme hemoglobin dalam proses metabolisme bilirubin. Kecacatan dalam pelbagai enzim dalam sintesis heme boleh membawa kepada kumpulan gangguan yang dipanggil porfiria, termasuk porfiria selaan akut, porfiria eritropoesis kongenital, porfiria kutanea tarda, koproporfiria keturunan, porfiria variegat dan protoporfiria eritropoesis.[8]
Penguraian
[sunting | sunting sumber]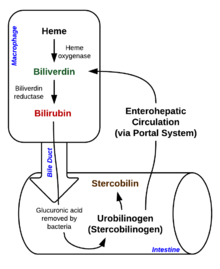
Degradasi bermula di dalam makrofaj limpa yang mengeluarkan eritrosit tua dan rosak daripada peredaran darah. Pada langkah pertama, heme ditukar kepada biliverdin oleh enzim heme oksigenase (HO).[9] NADPH digunakan sebagai agen penurunan, dan oksigen molekul memasuki tindak balas, membebaskan karbon monoksida (CO) serta besi sebagai ion ferus (Fe2+).[10] CO bertindak sebagai penghantar sel dan berfungsi dalam pengembangan salur darah.[11]
Di samping itu, degradasi hem nampaknya merupakan tindak balas yang dipelihara secara evolusi terhadap tekanan oksidatif. Secara ringkas, apabila sel terdedah kepada radikal bebas, terdapat induksi pantas bagi ekspresi isoenzim heme oksigenase 1 (HMOX1) responsif tekanan yang mengkatabolismekan heme.[12] Punca sel perlu meningkat secara eksponen keupayaan mereka untuk merendahkan heme sebagai tindak balas kepada tekanan oksidatif masih tidak jelas, tetapi ini nampaknya ialah sebahagian daripada tindak balas sitoprotektif yang mengelakkan kesan buruk hem bebas. Apabila sejumlah besar hem bebas terkumpul, sistem detoksifikasi/degradasi hem akan terbeban, membolehkan hem memaparkan kesan buruknya.[13]
Dalam tindak balas kedua, biliverdin ditukar kepada bilirubin oleh biliverdin reduktase (BVR).[14]
Bilirubin diangkut ke dalam hati melalui resapan berbantu yang terikat kepada protein (albumin serum), di mana ia berkonjugasi dengan asid glukuronik agar lebih larut dalam air. Tindak balas ini dimangkinkan oleh enzim UDP-glukuronosiltransferase.[15]
Bentuk bilirubin ini dikeluarkan dari hati dalam hempedu. Perkumuhan bilirubin dari hati ke kanalikuli hempedu ialah proses yang aktif, bergantung kepada tenaga dan pengehadan kadar. Bakteria usus menyahkonjugasi bilirubin diglukuronida dan menukar bilirubin kepada urobilinogen. Sesetengah urobilinogen diserap oleh sel-sel usus dan diangkut ke dalam buah pinggang dan dikumuhkan dengan air kencing (urobilin, yang merupakan hasil pengoksidaan urobilinogen, dan bertanggungjawab bagi warna kuning air kencing). Bakinya bergerak ke saluran pencernaan dan ditukar kepada sterkobilinogen. Ini dioksidakan kepada Sterkobilin yang dikumuhkan dan bertanggungjawab bagi warna coklat najis.[16]
Rujukan
[sunting | sunting sumber]- ^ Bloomer, Joseph R. (1998). "Liver metabolism of porphyrins and haem". Journal of Gastroenterology and Hepatology. 13 (3): 324–329. doi:10.1111/j.1440-1746.1998.01548.x. PMID 9570250. S2CID 25224821.
- ^ Paoli, M. (2002). "Structure-function relationships in heme-proteins" (PDF). DNA Cell Biol. 21 (4): 271–280. doi:10.1089/104454902753759690. PMID 12042067.
- ^ Alderton, W.K. (2001). "Nitric oxide synthases: structure, function and inhibition". Biochem. J. 357 (3): 593–615. doi:10.1042/bj3570593. PMC 1221991. PMID 11463332.
- ^ Yoshikawa, S. (2012). "Structural studies on bovine heart cytochrome c oxidase". Biochim. Biophys. Acta. 1817 (4): 579–589. doi:10.1016/j.bbabio.2011.12.012. PMID 22236806.
- ^ Battersby, Alan R. (2000). "Tetrapyrroles: The pigments of life". Natural Product Reports. 17 (6): 507–526. doi:10.1039/B002635M. PMID 11152419.
- ^ Sridevi, Kolluri (28 April 2018). Upregulation of Heme Pathway Enzyme ALA Synthase-1 by Glutethimide and 4,6-Dioxoheptanoic Acid and Downregulation by Glucose and Heme: A Dissertation (Tesis). University of Massachusetts Medical School. doi:10.13028/yyrz-qa79.
- ^ Kumar, Sanjay; Bandyopadhyay, Uday (July 2005). "Free heme toxicity and its detoxification systems in human". Toxicology Letters. 157 (3): 175–188. doi:10.1016/j.toxlet.2005.03.004. PMID 15917143.
- ^ Puy, Hervé; Gouya, Laurent; Deybach, Jean-Charles (March 2010). "Porphyrias". The Lancet (dalam bahasa Inggeris). 375 (9718): 924–937. doi:10.1016/S0140-6736(09)61925-5. PMID 20226990.
- ^ Maines, Mahin D. (July 1988). "Heme oxygenase: function, multiplicity, regulatory mechanisms, and clinical applications". The FASEB Journal (dalam bahasa Inggeris). 2 (10): 2557–2568. doi:10.1096/fasebj.2.10.3290025. ISSN 0892-6638. PMID 3290025.
- ^ Lehninger's Principles of Biochemistry (ed. 5th). New York: W. H. Freeman and Company. 2008. m/s. 876. ISBN 978-0-7167-7108-1.
- ^ Hanafy, K.A. (2013). "Carbon Monoxide and the brain: time to rethink the dogma". Curr. Pharm. Des. 19 (15): 2771–5. doi:10.2174/1381612811319150013. PMC 3672861. PMID 23092321.
- ^ Abraham, N.G.; Kappas, A. (2008). "Pharmacological and clinical aspects of heme oxygenase". Pharmacol. Rev. 60 (1): 79–127. doi:10.1124/pr.107.07104. PMID 18323402.
- ^ Kumar, Sanjay; Bandyopadhyay, Uday (July 2005). "Free heme toxicity and its detoxification systems in human". Toxicology Letters. 157 (3): 175–188. doi:10.1016/j.toxlet.2005.03.004. PMID 15917143.
- ^ Florczyk, U.M.; Jozkowicz, A.; Dulak, J. (January–February 2008). "Biliverdin reductase: new features of an old enzyme and its potential therapeutic significance". Pharmacological Reports. 60 (1): 38–48. PMC 5536200. PMID 18276984.
- ^ King, C.; Rios, G.; Green, M.; Tephly, T. (2000). "UDP-Glucuronosyltransferases". Current Drug Metabolism. 1 (2): 143–161. doi:10.2174/1389200003339171. PMID 11465080.
- ^ Helmenstine, Anne Marie. "The Chemicals Responsible for the Color of Urine and Feces". ThoughtCo (dalam bahasa Inggeris). Dicapai pada 2020-01-24.
