S-Adenosil metionina

| |

| |

| |
| Nama | |
|---|---|
| Nama IUPAC sistematik
(2S)-2-Amino-4-[(S)-{[(2S,3S,4R,5R)-5-(4-amino-9H-purin-9-il)-3,4-dihidroksioksolan-2-il]metil}metilsulfaniumil]butanoat | |
| Nama lain
S-Adenosil-L-metionina; SAM-e; SAMe, AdoMet, Heparab (India), ademetionina
| |
| Pengecam | |
Imej model 3D Jmol
|
|
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.045.391 |
| KEGG | |
| MeSH | S-Adenosylmethionine |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C15H22N6O5S | |
| Jisim molar | 398.44 g·mol−1 |
| Farmakologi | |
| Kod ATC | A16AA02 |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| | |
| Rujukan kotak info | |
S-Adenosil metionina (SAM), juga dikenali di bawah nama komersial SAMe, SAM-e, atau AdoMet, ialah kosubstrat biasa yang terlibat dalam pemindahan kumpulan metil, transpensulfuran dan aminopempropilan. Walaupun tindak balas anabolik ini berlaku di seluruh badan, kebanyakan SAM dihasilkan dan digunakan dalam hati.[1] Lebih daripada 40 pemindahan metil daripada SAM diketahui, kepada pelbagai substrat seperti asid nukleik, protein, lipid dan metabolit sekunder. Ia diperbuat daripada adenosina trifosfat (ATP) dan metionina oleh metionina adenosiltransferase. SAM pertama kali ditemui oleh Giulio Cantoni pada tahun 1952.[1]
Dalam bakteria, SAM terikat oleh ribosuis SAM yang mengawal gen yang terlibat dalam biosintesis metionina atau sisteina. Dalam sel eukariot, SAM berfungsi sebagai pengawal selia pelbagai proses termasuk metilasi DNA, tRNA dan rRNA; tindak balas imun;[2] metabolisme asid amino; transpensulfuran dan banyak lagi. Dalam tumbuhan, SAM adalah penting dalam biosintesis etilena, hormon yang dan molekul isyarat tumbuhan penting.[3]
Struktur[sunting | sunting sumber]
S-ametionina terdiri daripada kation adenosil yang melekat pada sulfur metionina. Ia disintesis daripada ATP dan metionina oleh enzim S-adenosilmetionina sintetase melalui tindak balas berikut:
- ATP + L-metionina + H2O fosfat + difosfat + S-adenosil-L-metionina
Kumpulan berfungsi sulfonium yang terdapat dalam S -adenosil metionina ialah pusat kereaktifan khususnya. Bergantung kepada enzim, S -adenosil metionina boleh ditukar menjadi salah satu daripada tiga produk:
- radikal adenosil yang bertukar kepada deoksiadenosina (AdO): tindak balas rSAM klasik, juga menghasilkan metionina secara bersama
- S-adenosil homosisteina, membebaskan radikal metil
- metiltioadenosina (SMT), radikal homoalanina
Biokimia[sunting | sunting sumber]
Kitaran SAM[sunting | sunting sumber]
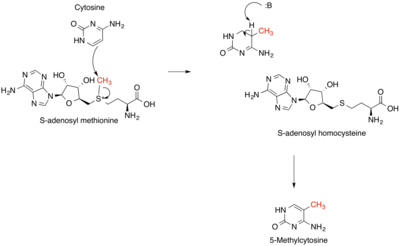
Tindak balas yang menghasilkan, memakan, dan menjana semula SAM dipanggil sebagai kitaran SAM. Dalam langkah pertama kitaran ini, metilase bergantungan SAM (EC 2.1.1) yang menggunakan SAM sebagai substrat menghasilkan S-adenosil homocysteine sebagai produk.[4] S-Adenosil homocysteine ialah pengawal atur negatif yang kuat bagi hampir semua metilasi yang bergantung kepada SAM walaupun kepelbagaian biologinya. Ini dihidrolisiskan kepada homosisteina dan adenosina oleh S-adenosilhomosisteina hidrolase EC 3.3.1.1 dan homosisteina dikitar semula kepada metionina melalui pemindahan kumpulan metil daripada 5-metiltetrahidrofolat, oleh salah satu daripada dua kelas metionina sintase (bergantungan kobalamin (EC 2.1.1.13) atau bebas kobalamin (EC 2.1.1.14). Metionina ini kemudiannya boleh ditukar kembali kepada SAM lalu melengkapkan kitaran.[5] Dalam langkah pengehad kadar kitaran SAM, MTHFR (metilenatetrahidrofolat reduktase) secara tak berbalik menurunkan 5,10-metilenatetrahidrofolat kepada 5-metiltetrahidrofolat.[6]
Enzim SAM radikal[sunting | sunting sumber]
Sebilangan besar enzim membelah SAM secara reduktif untuk menghasilkan radikal: 5'-deoksiadenosil 5'-radikal, metil radikal dan lain-lain. Enzim ini dipanggil SAM radikal. Kesemuanya mempunyai kelompok besi-sulfur di tapak aktif mereka.[7] Kebanyakan enzim dengan keupayaan ini berkongsi kawasan homologi jujukan yang merangkumi motif CxxxCxxC atau varian serupa. Urutan ini menyediakan tiga ligan sisteinil tiolat yang mengikat tiga daripada empat logam dalam kelompok 4Fe-4S. Fe keempat mengikat SAM.
Perantara radikal yang dihasilkan enzim ini melakukan pelbagai jenis tindak balas kimia luar biasa. Contoh enzim SAM radikal termasuk liase fotoproduk spora, pengaktifan piruvat format liase dan sulfatase anaerob, lisina 2,3-aminomutase dan pelbagai enzim biosintesis kofaktor, pengubahsuaian peptida, pembentukan kelompok metaloprotein, pengubahsuaian tRNA, metabolisme lipid, dsb. Enzim SAM menggunakan SAM kedua sebagai penderma metil. Enzim SAM radikal jauh lebih banyak dalam bakteria anaerob berbanding organisma aerob. Ia boleh ditemui dalam semua domain kehidupan, dan sebahagian besarnya belum diterokai. Kajian bioinformatik baru-baru ini menyimpulkan bahawa keluarga enzim ini merangkumi sekurang-kurangnya 114,000 jujukan dengan 65 tindak balas unik.[8]
Kekurangan enzim SAM radikal telah dikaitkan dengan pelbagai penyakit termasuk penyakit jantung kongenital, sklerosis lateral amiotrofik dan peningkatan kerentanan terhadap virus.[8]
Biosintesis poliamina[sunting | sunting sumber]
Satu lagi peranan utama SAM ialah dalam biosintesis poliamina. Dalam hal ini, SAM didekarboksilasi oleh adenosilmetionina dekarboksilase (EC 4.1.1.50) untuk membentuk S-adenosilmetioninamina. Kompaun ini kemudiannya mendermakan kumpulan n-propilamina dalam biosintesis poliamina seperti spermidina dan spermina daripada putresina.[9]
SAM diperlukan dalam pertumbuhan dan pembaikan selul. Ia juga terlibat dalam biosintesis beberapa hormon dan neurotransmiter yang mempengaruhi mood, seperti epinefrina. Metiltransferase juga bertanggungjawab dalam penambahan kumpulan metil kepada 2′ hidroksil nukleotida pertama dan kedua di sebelah pelindung 5′ dalam RNA pengutus.[10][11]
Kegunaan terapeutik[sunting | sunting sumber]
Sehingga 2012, bukti tidak dapat disimpulkan sama ada SAM boleh mengurangkan kesakitan osteoartritis; ujian klinikal yang telah dijalankan adalah terlalu kecil untuk dijadikan perihal keseluruhan.[12]
Kitaran SAM telah berkait rapat dengan hati sejak tahun 1947 kerana orang yang mengalami sirosis hati alkohol akan mengumpul sejumlah besar metionina dalam darah mereka.[13] Walaupun beberapa baris bukti daripada ujian makmal ke atas sel dan model haiwan menunjukkan bahawa SAM mungkin berguna untuk merawat pelbagai penyakit hati, setakat 2012, SAM tidak dikaji dalam mana-mana ujian klinikal terkawal plasebo rawak besar yang akan membenarkan penilaian keberkesanan dan keselamatan.[14][15]
Kemurungan[sunting | sunting sumber]
Kajian Cochrane 2016 menyimpulkan bahawa bagi gangguan kemurungan major, "memandangkan ketiadaan bukti berkualiti tinggi dan ketidakupayaan untuk membuat kesimpulan yang kukuh berdasarkan bukti itu, penggunaan SAMe bagi rawatan kemurungan pada orang dewasa perlu disiasat lebih lanjut."[16]
Kajian sistematik 2020 mendapati bahawa ia menunjukkan prestasi yang lebih baik daripada plasebo, dan mempunyai hasil yang serupa dengan antidepresan lain yang biasa digunakan (imipramina dan esitalopram).[17]
Rawatan antikanser[sunting | sunting sumber]
SAM baru-baru ini telah ditunjukkan memainkan peranan dalam kawal atur epigenetik. Pemetilan DNA ialah kawal atur utama dalam pengubahsuaian epigenetik semasa perkembangan dan pembezaan sel mamalia. Dalam model tikus, tahap SAM yang berlebihan telah terlibat dalam corak pemetilan yang salah yang dikaitkan dengan neuropati diabetes. SAM berfungsi sebagai penderma metil dalam pemetilan sitosina selaku proses kawal atur epigenetik utama.[18] Oleh kerana kesan ini terhadap peraturan epigenetik, SAM telah diuji sebagai rawatan antikanser. Dalam kebanyakan kanser, percambahan bergantung pada tahap pemetilan DNA yang rendah. Penambahan in vitro dalam kanser tersebut telah menunjukkan metilasi semula urutan promoter onkogen, dan mengurangkan pengeluaran protoonkogen.[19] Dalam kanser lain seperti kanser kolorektum, hipermetilasi global yang menyimpang boleh menghalang kawasan promoter gen penindas tumor.
Farmakokinetik[sunting | sunting sumber]
SAM oral mencapai kepekatan plasma puncak dalam masa tiga hingga lima jam selepas pengambilan tablet bersalut enterik (400–1000 mg). Separuh hayat adalah kira-kira 100 minit.[20]
Ketersediaan[sunting | sunting sumber]
Di Kanada, UK[21] dan Amerika Syarikat, SAM dijual sebagai makanan tambahan di bawah nama pemasaran SAM-e (juga dieja SAMA atau SAMA, disebut "Sammy").[22] Ia diperkenalkan di AS pada 1999, selepas Akta Kesihatan dan Pendidikan Makanan Tambahan diluluskan pada tahun 1994.[23]
Ia diperkenalkan sebagai ubat preskripsi di Itali pada 1979, di Sepanyol pada tahun 1985, dan di Jerman pada 1989.[23] Sehingga 2012, ia dijual sebagai ubat preskripsi di Rusia, India, China, Itali, Jerman, Vietnam dan Mexico.[15]
Kesan sampingan[sunting | sunting sumber]
Gangguan gastrousus, dispepsia dan kebimbangan boleh berlaku dengan penggunaan SAM.[20] Kesan jangka panjangnya tidak diketahui. SAM ialah agen pengalkilasi DNA yang lemah.[24]
Interaksi dan kontraindikasi[sunting | sunting sumber]
Mengambil SAM pada masa yang sama dengan sesetengah ubat boleh meningkatkan risiko sindrom serotonin, keadaan yang berpotensi berbahaya disebabkan oleh terlalu banyak serotonin. Ubat-ubatan ini termasuk dekstrometorfan (Robitussin), meperidina (Demerol), pentazosina (Talwin) dan tramadol (Ultram).[25]
SAM juga mungkin berinteraksi dengan ubat antidepresan—termasuk triptofan dan Hypericum perforatum—meningkatkan potensi sindrom serotonin atau kesan sampingan lain, dan mungkin mengurangkan keberkesanan levodopa untuk penyakit Parkinson.[26]
Orang yang mempunyai gangguan bipolar tidak boleh menggunakan SAM kerana ia meningkatkan risiko episod manik.[26]
Keracunan[sunting | sunting sumber]
Kajian 2022 menyimpulkan bahawa SAME boleh menjadi toksik. Jean-Michel Fustin dari Universiti Manchester berkata bahawa para penyelidik mendapati bahawa lebihan SAMe terurai kepada adenina dan metillioadenosina dalam badan, dengan kedua-duanya menghasilkan kesan paradoks yang menghalang pemetilan. Ini ditemui dalam tikus makmal, menyebabkan kemudaratan kepada kesihatan, dan ujian in vitro pada sel manusia.[27][21]
Rujukan[sunting | sunting sumber]
- ^ a b Cantoni, GL (1952). "The Nature of the Active Methyl Donor Formed Enzymatically from L-Methionine and Adenosinetriphosphate". J Am Chem Soc. 74 (11): 2942–3. doi:10.1021/ja01131a519.
- ^ Ding, Wei; Smulan, Lorissa J.; Hou, Nicole S.; Taubert, Stefan; Watts, Jennifer L.; Walker, Amy K. (2015-10-06). "S-Adenosylmethionine Levels Govern Innate Immunity through Distinct Methylation-Dependent Pathways". Cell Metabolism. 22 (4): 633–645. doi:10.1016/j.cmet.2015.07.013. PMC 4598287. PMID 26321661.
- ^ Wang, X.; Oh, M. W.; Komatsu, S. (2016-06-01). "Characterization of S-adenosylmethionine synthetases in soybean under flooding and drought stresses". Biologia Plantarum (dalam bahasa Inggeris). 60 (2): 269–278. doi:10.1007/s10535-016-0586-6. ISSN 0006-3134.
- ^ "Homocysteine". The International Journal of Biochemistry & Cell Biology. 32 (4): 385–9. 2000. doi:10.1016/S1357-2725(99)00138-7. PMID 10762063.
- ^ "Molecular biology of 5,10-methylenetetrahydrofolate reductase". J Nephrol. 13 (1): 20–33. Jan – Feb 2000. PMID 10720211. Check date values in:
|date=(bantuan) - ^ Goyette, P.; Sumner, J. S.; Milos, R.; Duncan, A. M.; Rosenblatt, D. S.; Matthews, R. G.; Rozen, R. (1994-06-01). "Human methylenetetrahydrofolate reductase: isolation of cDNA, mapping and mutation identification". Nature Genetics. 7 (2): 195–200. doi:10.1038/ng0694-195. ISSN 1061-4036. PMID 7920641.
- ^ Booker, SJ; Grove, TL (2010). "Mechanistic and functional versatility of radical SAM enzymes". F1000 Biology Reports. 2: 52. doi:10.3410/B2-52. PMC 2996862. PMID 21152342.
- ^ a b Landgraf, Bradley J.; McCarthy, Erin L.; Booker, Squire J. (2016-06-13). "Radical S-Adenosylmethionine Enzymes in Human Health and Disease". Annual Review of Biochemistry (dalam bahasa Inggeris). 85: 485–514. doi:10.1146/annurev-biochem-060713-035504. PMID 27145839.
- ^ Roje S (2006). "S-Adenosyl-L-methionine: beyond the universal methyl group donor". Phytochemistry. 67 (15): 1686–98. Bibcode:2006PChem..67.1686R. doi:10.1016/j.phytochem.2006.04.019. PMID 16766004.
- ^ Loenen W (2006). "S-Adenosylmethionine: jack of all trades and master of everything?". Biochem Soc Trans. 34 (Pt 2): 330–3. doi:10.1042/BST20060330. PMID 16545107.
- ^ "S-Adenosylmethionine and methylation". FASEB J. 10 (4): 471–80. 1996. doi:10.1096/fasebj.10.4.8647346. PMID 8647346.
- ^ Rutjes, AW; Nüesch, E; Reichenbach, S; Jüni, P (7 October 2009). "S-Adenosylmethionine for osteoarthritis of the knee or hip" (PDF). The Cochrane Database of Systematic Reviews. 2009 (4): CD007321. doi:10.1002/14651858.CD007321.pub2. PMC 7061276. PMID 19821403.
- ^ Mato, Jose M (1997). "S-adenosylmethionine synthesis: Molecular mechanisms and clinical implications". Pharmacology & Therapeutics. 73 (3): 265–280. doi:10.1016/s0163-7258(96)00197-0. PMID 9175157.
|hdl-access=requires|hdl=(bantuan) - ^ Anstee, QM; Day, CP (November 2012). "S-Adenosylmethionine (SAMe) therapy in liver disease: a review of current evidence and clinical utility". Journal of Hepatology. 57 (5): 1097–109. doi:10.1016/j.jhep.2012.04.041. PMID 22659519.
- ^ a b Lu, SC; Mato, JM (October 2012). "S-Adenosylmethionine in liver health, injury, and cancer". Physiological Reviews. 92 (4): 1515–42. doi:10.1152/physrev.00047.2011. PMC 3698976. PMID 23073625.
- ^ Galizia, I; Oldani, L; Macritchie, K; Amari, E; Dougall, D; Jones, TN; Lam, RW; Massei, GJ; Yatham, LN (10 October 2016). "S-Adenosyl methionine (SAMe) for depression in adults". The Cochrane Database of Systematic Reviews. 2016 (10): CD011286. doi:10.1002/14651858.CD011286.pub2. PMC 6457972. PMID 27727432.
- ^ Cuomo, Alessandro; Beccarini Crescenzi, Bruno; Bolognesi, Simone; Goracci, Arianna; Koukouna, Despoina; Rossi, Rodolfo; Fagiolini, Andrea (2020-09-05). "S-Adenosylmethionine (SAMe) in major depressive disorder (MDD): a clinician-oriented systematic review". Annals of General Psychiatry. Springer Science and Business Media LLC. 19 (1): 50. doi:10.1186/s12991-020-00298-z. ISSN 1744-859X. PMC 7487540. PMID 32939220.
- ^ Varela-Rey, Marta (2014). "S-Adenosylmethionine Levels Regulate the Schwann Cell DNA Methylome". Neuron. 81 (5): 1024–1039. doi:10.1016/j.neuron.2014.01.037. PMC 3960855. PMID 24607226.
- ^ Schmidt, Thomas; Leha, Andreas; Salinas-Riester, Gabriela (2016-12-31). "Treatment of prostate cancer cells with S-adenosylmethionine leads to genome-wide alterations in transcription profiles". Gene. 595 (2): 161–167. doi:10.1016/j.gene.2016.09.032. PMID 27688072.
- ^ a b "S-Adenosyl methionine (SAMe) versus celecoxib for the treatment of osteoarthritis symptoms: A double-blind cross-over trial. ISRCTN36233495". BMC Musculoskelet Disord. 5: 6. February 2004. doi:10.1186/1471-2474-5-6. PMC 387830. PMID 15102339.
- ^ a b McKie, Robin (10 April 2022). "Biologists warn against toxic SAMe 'health' supplement". The Observer.
- ^ Woolston, Chris (31 December 2020). "What is SAM-e?". HealthDay.
- ^ a b Bottiglieri, T (November 2002). "S-Adenosyl-L-methionine (SAMe): from the bench to the bedside--molecular basis of a pleiotrophic molecule". The American Journal of Clinical Nutrition. 76 (5): 1151S–1157S. doi:10.1093/ajcn/76.5.1151S. PMID 12418493.
- ^ "Nonenzymatic methylation of DNA by the intracellular methyl group donor S-adenosyl-L-methionine is a potentially mutagenic reaction". EMBO J. 1 (2): 211–6. 1982. doi:10.1002/j.1460-2075.1982.tb01149.x. PMC 553022. PMID 7188181.
- ^ "SAMe - Mayo Clinic". Mayo Clinic.
- ^ a b "S-Adenosyl-L-Methionine (SAMe): In Depth" (dalam bahasa Inggeris). National Center for Complementary and Integrative Health (NCCIH). January 11, 2017.
- ^ Fukumoto, Kazuki; Ito, Kakeru; Saer, Benjamin; Taylor, George; Ye, Shiqi; Yamano, Mayu; Toriba, Yuki; Hayes, Andrew; Okamura, Hitoshi (5 April 2022). "Excess S-adenosylmethionine inhibits methylation via catabolism to adenine". Communications Biology. Nature Publishing Group. 5 (1): 313. doi:10.1038/s42003-022-03280-5. ISSN 2399-3642. PMC 8983724 Check
|pmc=value (bantuan). PMID 35383287 Check|pmid=value (bantuan).|hdl-access=requires|hdl=(bantuan)
Pautan luar[sunting | sunting sumber]
- Nombor EINECS 249-946-8
- Shippy, R Andrew; Mendez, Douglas; Jones, Kristina; Cergnul, Irene; Karpiak, Stephen E (2004). "S-Adenosylmethionine (SAM-e) for the treatment of depression in people living with HIV/AIDS". BMC Psychiatry. 4: 38. doi:10.1186/1471-244X-4-38. PMC 535560. PMID 15538952.
- CS1 errors: param-access
- CS1 errors: PMC
- CS1 errors: PMID
- Rencana dengan pengecam EBI berubah
- ECHA InfoCard ID from Wikidata
- Rencana dengan pengecam KEGG berubah
- Articles containing unverified chemical infoboxes
- Penokok pemakanan
- Koenzim
- Asid alfa-amino
- Sebatian sulfonium
- Psikofarmakologi
- Biologi gangguan bipolar

