Glikosaminoglikan
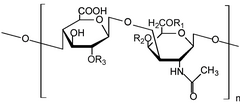
Glikosaminoglikan[1] (GAG) atau mukopolisakarida[2] ialah polisakarida linear panjang yang terdiri daripada unit disakarida berulang (iaitu unit dua gula). Unit dua gula berulang terdiri daripada gula uronik dan gula amino, kecuali dalam kes keratan glikosaminoglikan sulfat, di mana, sebagai ganti gula uronik, terdapat unit galaktosa.[3] GAG ditemui dalam vertebrat, invertebrat dan bakteria.[4] Oleh kerana GAG adalah molekul yang sangat berkutub dan menarik air, badan menggunakannya sebagai pelincir atau penyerap hentakan.
Mukopolisakaridosis ialah sekumpulan gangguan metabolisme di mana pengumpulan abnormal glikosaminoglikan berlaku disebabkan oleh kekurangan enzim.
Penghasilan[sunting | sunting sumber]
Glycosaminoglycan sangat pelbagai dalam jisim molekul, struktur disakarida dan sulfat. Ini kerana sintesis GAG tidak didorong oleh sebarang templat seperti protein atau asid nukleik, tetapi sentiasa diubah oleh enzim pemprosesan.[5]
GAG dikelaskan kepada empat kumpulan berdasarkan struktur teras disakarida mereka:[6]
- Heparin/heparan sulfat (HSGAG)
- Kondroitin sulfat/dermatan sulfat (CSGAG), disintesis dalam jasad Golgi bersama-sama HSGAG, di mana teras protein yang dihasilkan dalam retikulum endoplasma kasar diubah suai selepas terjemahan melalui pengglikosilan berikatan O oleh glikosiltransferase, dengan itu membentuk proteoglikan.
- Keratan sulfat yang boleh mengubah suai protein teras melalui pengglikosilan berikatan N atau O proteoglikan
- Asid hialuronik (juga dikenali sebagai hialuronan), yang disintesis oleh sintase membran integral yang serta-merta merembeskan rantai disakarida.
HSGAG dan CSGAG[sunting | sunting sumber]
Proteoglikan yang diubah suai HSGAG dan CSGAG mula-mula bermula dengan motif Ser-Gly/Ala-X-Gly konsensus dalam protein teras. Pembinaan penghubung tetrasakarida yang terdiri daripada -GlcAβ1–3Galβ1–3Galβ1–4Xylβ1-O-(Ser)-, di mana xilosiltransferase, β4-galaktosil transferase (GalTI), β3-galaktosil transferase (GalT-II) dan β3-GlcA transferase (GlcAT-I) memindahkan empat monosakarida, memulakan sintesis protein diubah suai GAG. Pengubahsuaian pertama penghubung tetrasakarida menentukan sama ada HSGAG atau CSGAG akan ditambah. Penambahan GlcNAc menggalakkan penambahan HSGAG manakala penambahan GalNAc pada penyambung tetrasakarida menggalakkan penghasilan CSGAG.[6] GlcNAcT-I memindahkan GlcNAc ke penyambung tetrasakarida yang berbeza daripada glikosiltransferase GlcNAcT-II, enzim yang digunakan untuk membina HSGAG. EXTL2 dan EXTL3, dua gen dalam keluarga penindas tumor EXT, telah ditunjukkan mempunyai aktiviti GlcNAcT-I. Sebaliknya, GalNAc dipindahkan ke penghubung oleh enzim GalNAcT untuk memulakan sintesis CSGAGs, enzim yang mungkin atau mungkin tidak mempunyai aktiviti yang berbeza berbanding dengan aktiviti pemindahan GalNAc bagi sintase kondroitin.[6]
Berkenaan HSGAG, enzim multimer yang dikodkan oleh EXT1 dan EXT2 daripada keluarga gen EXT memindahkan kedua-dua GlcNAc dan GlcA bagi pemanjangan rantai HSGAG. Semasa pemanjangan, HSGAG diubah suai secara dinamik, pertama oleh N-deasetilase, N-sulfotransferase (NDST1), iaitu enzim dwifungsi yang membelah kumpulan N-asetil daripada GlcNAc dan seterusnya mensulfatkan kedudukan N. Seterusnya, C-5 uronil epimerase menyelubungi d-GlcA kepada l-IdoA diikuti dengan pensulfatan 2-O gula asid uronik oleh 2- O sulfotransferase (heparan sulfat 2-O-sulfotransferase). Akhir sekali, kedudukan 6-O dan 3-O moiti GlcNAc disulfatkan oleh 6- O (heparan sulfat 6-O-sulfotransferase) dan 3-O (3-OST) sulfotransferase.
Kondroitin sulfat dan dermatan sulfat yang terdiri daripada CSGAG dibezakan antara satu sama lain dengan kehadiran epimer GlcA dan IdoA masing-masing. Sama seperti pengeluaran HSGAG, C-5 uronil epimerase menukarkan d-GlcA kepada l-IdoA untuk mensintesis dermatan sulfat. Tiga peristiwa pensulfatan rantai CSGAG berlaku: pensulfatan 4- O dan/atau 6-O GalNAc, dan pensulfatan 2-O asid uronik. Empat isobentuk bagi 4-O GalNAc sulfotransferase (C4ST-1, C4ST-2, C4ST-3, dan D4ST-1) dan tiga isobentuk GalNAc 6-O sulfotransferase (C6ST, C6ST-2, dan GalNAc4S-6ST) bertanggungjawab dalam pensulfatan GalNAc.[7]
Jenis keratan sulfat[sunting | sunting sumber]
Tidak seperti HSGAG dan CSGAG, kelas ketiga GAG yang tergolong dalam jenis keratan sulfat, didorong ke arah biosintesis melalui motif jujukan protein tertentu. Sebagai contoh, dalam kornea dan tulang rawan, agrekan, suatu domain keratan sulfat, terdiri daripada satu siri heksapeptida berulang serentak dengan urutan konsensus E(E/L)PFPS.[8] Selain itu, bagi tiga lagi proteoglikan keratan sulfat, lumikan, keratokan dan mimecan (OGN), jujukan konsensus NX(T/S) bersama-sama struktur sekunder protein ditentukan terlibat dalam lanjutan oligosakarida berikatan N dengan keratan sulfat.[8] Pemanjangan keratan sulfat bermula pada hujung bukan penurun tiga oligosakarida rantaian yang mentakrifkan tiga kelas keratan sulfat. Keratan sulfat I (KSI) terikat N melalui oligosakarida pelopor jenis manosa tinggi. Keratan sulfat II (KSII) dan keratan sulfat III (KSIII) berikatan O, dengan hubungan KSII sama dengan struktur teras musin, dan KSIII terikat dengan manosa 2-O. Pemanjangan polimer keratan sulfat berlaku melalui penambahan glikosiltransferase Gal dan GlcNAc. Penambahan galaktosa berlaku terutamanya melalui enzim β-1,4-galaktosiltransferase (β4Gal-T1), manakala enzim yang bertanggungjawab bagi β-3-nasetilglukosamina belum dikenal pasti dengan jelas. Akhirnya, sulfat polimer berlaku pada di 6 kedua-dua sisa gula. Enzim KS-Gal6ST (CHST1) memindahkan kumpulan sulfat kepada galaktosa manakala N-asetilglukosaminil-6-sulfotransferase (GlcNAc6ST) (CHST2) memindahkan kumpulan sulfat ke terminal GlcNAc dalam keratan sulfat.[9]
Kelas asid hialuronik[sunting | sunting sumber]

Kelas keempat GAG, asid hialuronik (HA), tidak bersulfat, dan disintesis oleh tiga protein sintase transmembran HAS1, HAS2, dan HAS3. HA, polisakarida linear, terdiri daripada unit disakarida berulang →4)GlcAβ(1→3)GlcNAcβ(1→, dan mempunyai jisim molekul yang sangat tinggi, iaitu antara 105 hingga 107 Da. Setiap enzim HAS mampu melakukan transpengglikosilan apabila dibekalkan dengan UDP-GlcA dan UDP-GlcNAc.[10][11] HAS2 bertanggungjawab bagi polimer asid hialuronik yang sangat besar, manakala saiz HA yang lebih kecil disintesis oleh HAS1 dan HAS3. Walaupun setiap isoform HAS memangkinkan tindak balas biosintetik yang sama, setiap isoform HAS aktif secara bebas. Isoform HAS juga telah ditunjukkan mempunyai nilai Km yang berbeza bagi UDP-GlcA dan UDPGlcNAc.[12] Ada pendapat bahawa melalui perbezaan dalam aktiviti dan ekspresi enzim, spektrum luas fungsi biologi yang dibantu oleh HA boleh dikawal seperti penglibatannya dengan peraturan sel tunjang saraf di zon subgranul otak.
Farmakodinamik[sunting | sunting sumber]
HSGAG[sunting | sunting sumber]
Heparin endogen disetempatkan dan disimpan dalam butiran rembesan sel masta. Histamin yang terdapat dalam butiran terproton (H2A2+) pada pH dalam butiran (5.2–6.0), dan oleh itu, dipercayai bahawa heparin yang bercas sangat negatif berfungsi untuk mengekalkan dan menyimpan histamin melalui elektrostatik.[13] Di klinik, heparin diberikan sebagai antipenggumpal, dan juga merupakan pilihan pertama untuk penyakit tromboembolisis.[14][15] Heparan sulfat (HS) mempunyai pelbagai aktiviti dan fungsi biologi, termasuk lekatan sel, pengawalan pertumbuhan dan percambahan sel, proses perkembangan, pengikatan permukaan sel lipoprotein lipase dan protein lain, angiogenesis, pencerobohan virus dan metastasis tumor.[13]
CSGAG berinteraksi dengan protein pengikat heparin; secara khusus, interaksi dermatan sulfat dengan faktor pertumbuhan fibroblas FGF-2 dan FGF-7 telah terlibat dalam percambahan sel dan pembaikan luka,[16] manakala interaksi dengan faktor pertumbuhan hati/faktor serakan (HGF/SF) mengaktifkan laluan isyarat HGF/SF (c-Met) melalui reseptornya. CSGAG adalah penting dalam memberikan sokongan dan pelekatan pada tulang, kulit dan rawan. Fungsi biologi lain yang disifatkan kritikal termasuk perencatan pertumbuhan akson dan penjanaan semula dalam pembangunan sistems saraf pusat, peranan dalam perkembangan otak, aktiviti neuritogenik dan jangkitan patogen.[17]
Keratan sulfat[sunting | sunting sumber]
Salah satu fungsi utama GAG kelas ketiga, keratan sulfat, adalah mengekalkan penghidratan tisu.[18] Keratan sulfat berada di dalam tulang, rawan dan kornea mata.[19] Dalam kornea biasa, dermatan sulfat terhidrat sepenuhnya manakala keratan sulfat hanya terhidrat sebahagiannya menunjukkan bahawa keratan sulfat mungkin berkelakuan sebagai penimbal terkawal secara dinamik untuk penghidratan.[18] Dalam keadaan penyakit seperti distrofi kornea makula, di mana paras GAG seperti KS berubah, kehilangan penghidratan dalam stroma kornea dipercayai menjadi punca pengkelabuan kornea, sekali gus menyokong hipotesis yang telah lama dipegang bahawa ketelusan kornea bergantung kepada yang tahap keratan sulfat yang baik. Keratan sulfat ditemui dalam banyak tisu lain selain kornea, di mana ia diketahui mengawal lekatan makrofaj, membentuk halangan kepada pertumbuhan neurit, mengawal implantasi embrio dalam lapisan rahim endometrium semasa kitaran haid, dan memberi kesan terhadap kemotilan sel endotelium kornea.[18] Secara, KS memainkan peranan antilekatan, yang mencadangkan fungsi KS yang sangat penting dalam kemotilan sel dan lekatan serta proses biologi berpotensi lain.
Dermatan sulfat[sunting | sunting sumber]
Dermatan sulfat berfungsi dalam kulit, tendon, saluran darah, dan injap jantung.[19]
Asid hialuronik[sunting | sunting sumber]
Asid hialuronik ialah komponen utama tisu dan cecair sinovia, serta bahan asas tisu penghubung lain. Asid hialuronik mengikat sel bersama-sama, melincirkan sendi, dan membantu mengekalkan bentuk bola mata.[19] Kelikatan asid hialuronik menjadikannya sesuai sebagai pelincir sendi dan permukaan yang bergerak antara satu sama lain seperti rawan. Larutan asid hialuronik di bawah tegasan ricih rendah mempunyai kelikatan yang lebih tinggi berbanding dalam tegasan ricih yang tinggi.[20] Hialuronidase, enzim yang dihasilkan oleh sel darah putih, sel sperma dan beberapa bakteria, memecahkan asid hialuronik, menyebabkan larutan menjadi lebih cair.[19]
Secara in vivo, asid hialuronik membentuk gegelung berbelit secara rawak yang terjerat untuk membentuk rangkaian hialuronan, dan membantu melambatkan resapan serta membentuk penghalang resapan yang mengawal pengangkutan bahan antara sel. Contohnya, hialuronan membantu membahagikan protein plasma antara ruang vaskular dan ekstravaskular yang menjejaskan keterlarutan makromolekul dalam interstitium, mengubah keseimbangan kimia dan menstabilkan struktur gentian kolagen.[20]
Fungsi lain termasuk interaksi matriks dengan protein pengikat hialuronan seperti hialuronektin, protein pengikat hialuronan glia, protein pengikat hialuronan diperkaya otak, kolagen VI, TSG-6 dan perencat antara alfa-trypsin. Interaksi permukaan sel yang melibatkan hialuronan ialah gandingannya dengan CD44, yang mungkin berkaitan dengan perkembangan tumor, dan juga dengan RHAMM (reseptor kemotilan berbantu hialuronan) yang terlibat dalam proses perkembangan, metastasis tumor dan proses pembaikan patologi. Fibroblas, sel mesotelium, dan jenis sel stem tertentu mengelilingi diri mereka dalam "sarung" perisel, sebahagian daripadanya dibina daripada hialuronan untuk melindungi diri mereka daripada bakteria, sel darah merah atau molekul matriks lain. Sebagai contoh, berkenaan sel tunjang, hialuronan bersama dengan kondroitin sulfat, membantu membentuk nic sel tunjang. Sel tunjang dilindungi daripada kesan faktor pertumbuhan oleh perisai hialuronan dan kondroitin sulfat bersulfat minimum. Semasa pembahagian sel pendahulu, sel anak bergerak di luar perisai perisel ini, di mana ia kemudiannya boleh dipengaruhi oleh faktor pertumbuhan bagi pembezaan sel lanjutan.
Pengelasan[sunting | sunting sumber]
Ahli keluarga glikosaminoglikan berbeza dalam jenis unit heksosamina, heksosa atau asid heksuronik yang terkandung di dalamnya (cth., asid glukuronik, asid iduronik, galaktosa, galaktosamina, glukosamina). Mereka juga berbeza dalam geometri ikatan glikosidik.
Contoh GAG termasuk:
| Nama | Asid heksuronik atau heksosa (untuk keratan) | Heksosamina | Geometri kaitan antara unit monomer dominan | Ciri-ciri lain |
|---|---|---|---|---|
| Kondroitin sulfat | GlcUA atau GlcUA(2S) |
GalNAc atau GalNAc(4S) atau GalNAc(6S) atau GalNAc(4S,6S) |
GlcUA β (1→3)GalNAc β (1→4) | GAG yang paling lazim |
| Dermatan sulfat | GlcUA atau IdoUA atau IdoUA(2S) |
GalNAc atau GalNAc(4S) atau GalNAc(6S) atau GalNAc(4S,6S) |
'IdoUAβ1-3' GalNAcβ1-4 | Dibezakan daripada kondroitin sulfat dengan kehadiran asid iduronik, walaupun sesetengah monosakarida asid heksuronik mungkin ialah asid glukuronik.[16] |
| Keratan sulfat | Gal atau Gal(6S) | GlcNAc atau GlcNAc(6S) |
-Gal(6S)β1-4GlcNAc(6S)β1-3 | Keratan sulfat jenis II boleh difukosilkan.[21] |
| Heparin | GlcUA atau IdoUA(2S) |
GlcNAc atau GlcNS atau GlcNAc(6S) atau GlcNS(6S) |
-IdoUA(2S)α1-4GlcNS(6S)α1-4 | Ketumpatan cas negatif tertinggi bagi mana-mana molekul biologi yang diketahui |
| Heparan sulfat | GlcUA atau IdoUA atau IdoUA(2S) |
GlcNAc atau GlcNS atau GlcNAc(6S) atau GlcNS(6S) |
- GlcUA β 1-4GlcNAc α 1-4 | Struktur sangat serupa dengan heparin, walau bagaimanapun, unit disakarida heparan sulfat disusun ke domain sulfat dan bukan bersulfat yang berbeza.[22] |
| Hialuronan | GlcUA | GlcNAc | -GlcUAβ1-3GlcNAcβ1-4 | Satu-satunya GAG yang tidak bersulfat secara eksklusif. |
Singkatan di atas adalah seperti yang berikut:
- GlcUA = asid β-D-glukuronik
- GlcUA(2S) = asid 2-O-sulfo-β-D-glukuronik
- IdoUA = asid α-L-iduronik
- IdoUA(2S) = asid 2-O-sulfo-α-L-iduronik
- Gal = β-D-galaktosa
- Gal(6S) = 6-O-sulfo-β-D-galaktosa
- GalNAc = β-D-N-asetilgalaktosamina
- GalNAc(4S) = β-D-N-asetilgalaktosamina-4-O-sulfat
- GalNAc(6S) = β-D-N-asetilgalaktosamina-6-O-sulfat
- GalNAc(4S,6S) = β-D-N-asetilgalaktosamina-4-O, 6-O-sulfat
- GlcNAc = α-D-N-asetolglukosamina
- GlcNS = α-D-N-sulfoglukosamina
- GlcNS(6S) = α-D-N-sulfoglukosamina-6-O-sulfat
Lihat juga[sunting | sunting sumber]
Rujukan[sunting | sunting sumber]
- ^ glycosaminoglycan di Kamus Perubatan Dorland
- ^ mucopolysaccharide di Kamus Perubatan Dorland
- ^ Esko, Jeffrey D; Kimata, Koji; Lindahl, Ulf (2009). "Chapter 16: Proteoglycans and Sulfated Glycosaminoglycans". Essentials of Glycobiology. Cold Spring Harbor Laboratory Press. ISBN 978-0879695590.
- ^ DeAngelis, Paul L. (2002-11-01). "Evolution of glycosaminoglycans and their glycosyltransferases: Implications for the extracellular matrices of animals and the capsules of pathogenic bacteria". The Anatomical Record (dalam bahasa Inggeris). 268 (3): 317–326. doi:10.1002/ar.10163. ISSN 0003-276X. PMID 12382327.
- ^ Caligur, Vicki (2008). "Glycosaminoglycan Sulfation and Signaling". Dicapai pada 25 November 2012.
- ^ a b c Sasisekharan, Ram; Raman, Rahul; Prabhakar, Vikas (August 2006). "Glycomics Approach to Structure-Function Relationships of Glycosaminoglycans". Annual Review of Biomedical Engineering. 8 (1): 181–231. doi:10.1146/annurev.bioeng.8.061505.095745. PMID 16834555.
- ^ "Sulfotransferases in glycosaminoglycan biosynthesis". Current Opinion in Structural Biology. 13 (5): 605–11. 2003. doi:10.1016/j.sbi.2003.08.002. PMID 14568616.
- ^ a b Funderburgh JL. (2002). "Keratan sulfate biosynthesis". IUBMB Life. 54 (4): 187–94. doi:10.1080/15216540214932. PMC 2874674. PMID 12512857.
- ^ "Purification and characterization of N-acetylglucosaminyl sulfotransferase from chick corneas". Archives of Biochemistry and Biophysics. 392 (1): 87–92. 2001. doi:10.1006/abbi.2001.2422. PMID 11469798.
- ^ "In vitro synthesis of hyaluronan by a single protein derived from mouse HAS1 gene and characterization of amino acid residues essential for the activity". The Journal of Biological Chemistry. 275 (1): 497–506. 2000. doi:10.1074/jbc.275.1.497. PMID 10617644.
- ^ "Immunochemical confirmation of the primary structure of streptococcal hyaluronan synthase and synthesis of high molecular weight product by the recombinant enzyme". Biochemistry. 33 (31): 9033–39. 1994. doi:10.1021/bi00197a001. PMID 8049203.
- ^ Itano N; Sawai T; Yoshida M; Lenas P; Yamada Y; Imagawa M; Shinomura T; Hamaguchi M; Yoshida Y (1999). "Three isoforms of mammalian hyaluronan synthases have distinct enzymatic properties". Journal of Biological Chemistry. 274 (35): 25085–92. doi:10.1074/jbc.274.35.25085. PMID 10455188.
- ^ a b Rabenstein DL. (2002). "Heparin and heparan sulfate: structure and function". Natural Product Reports. 19 (3): 312–31. doi:10.1039/B100916H. PMID 12137280.
- ^ "The anticoagulant activation of antithrombin by heparin". Proceedings of the National Academy of Sciences of the United States of America. 94 (26): 14683–88. 1997. Bibcode:1997PNAS...9414683J. doi:10.1073/pnas.94.26.14683. PMC 25092. PMID 9405673.
- ^ Rodén, L. (1989). Lane, DA (penyunting). Heparin: Chemical and Biological Properties, Clinical Applications. CRC Press, Inc. m/s. 1.
- ^ a b "Dermatan sulfate: new functions from an old glycosaminoglycan". Glycobiology. 12 (9): 117R–125R. 2002. doi:10.1093/glycob/cwf066. PMID 12213784.
- ^ "Recent advances in the structural biology of chondroitin sulfate and dermatan sulfate". Current Opinion in Structural Biology. 13 (5): 612–20. 2003. doi:10.1016/j.sbi.2003.09.011. PMID 14568617.
- ^ a b c Funderburgh, JL. (2000). "Keratan sulfate: structure, biosynthesis, and function". Glycobiology. 10 (10): 951–58. doi:10.1093/glycob/10.10.951. PMID 11030741.
- ^ a b c d Tortora, Gerard J. (2013-12-31). Principles of anatomy & physiology. Derrickson, Bryan (ed. 14th). Danvers, MA. ISBN 978-1-118-34500-9. OCLC 871018672.
- ^ a b "The structure and function of hyaluronan: An overview". Immunology and Cell Biology. 74 (2): A1-7. 1996. doi:10.1038/icb.1996.32. PMID 8724014.
- ^ Funderburgh JL. (2000). "Keratan sulfate: structure, biosynthesis, and function". Glycobiology. 10 (10): 951–58. doi:10.1093/glycob/10.10.951. PMID 11030741.
- ^ Gallagher, J.T., Lyon, M. (2000). "Molecular structure of Heparan Sulfate and interactions with growth factors and morphogens". Dalam Iozzo, M, V. (penyunting). Proteoglycans: structure, biology and molecular interactions. New York: Marcel Dekker Inc. m/s. 27–59. ISBN 978-0-8247-0334-9.CS1 maint: multiple names: authors list (link)
