Xenon tetrafluorida

| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Xenon tetrafluoride
| |||
| Pengecam | |||
Imej model 3D Jmol
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.033.858 | ||
PubChem CID
|
|||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| XeF4 | |||
| Jisim molar | 207.2836 g mol−1 | ||
| Rupa bentuk | Pepejal putih | ||
| Ketumpatan | 4.040 g cm−3, pepejal | ||
| Takat lebur | 117 °C memejalwap (390 K)[1] | ||
| Bertindak balas | |||
| Struktur | |||
| Geometri koordinasi |
D4h | ||
| Bentuk molekul | segi empat sama satah | ||
| Momen dwikutub | 0 D | ||
| Termokimia | |||
| Entropi molar piawai S |
146 J·mol−1·K−1[2] | ||
Entalpi pembentukan
piawai (ΔfH⦵298) |
−251 kJ·mol−1[2] | ||
| Bahaya | |||
| Takat kilat | ? °C | ||
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |||
| | |||
| Rujukan kotak info | |||
Xenon tetrafluorida ialah satu sebatian kimia dengan formula kimia XeF4. Ia merupakan sebatian dedua gas adi pertama yang ditemui.[3] Ia dihasilkan melalui tindak balas kimia gas xenon dengan fluorin, F2, seperti berikut:[4][5]
- Xe + 2 F2 → XeF4
Tindak balas ini bersifat eksoterma, melepaskan tenaga 251 kJ bagi setiap mol xenon.[3]
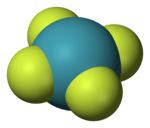
Xenon tetrafluorida ialah bahan kristal tidak berwarna dalam keadaan biasa. Struktur kristalnya ditentukan oleh spektroskopi NMR dan kristalografi sinar-x pada 1963.[6][7] Strukturnya adalah segi empat sama satah, seperti yang telah dibuktikan oleh kajian pembelauan neutron[8] dan diwajarkan oleh teori VSEPR kerana xenon mempunyai dua pasangan elektron tunggal di atas dan di bawah satah molekul itu.
Xenon tetrafluorida memejalwap pada suhu 115.7 °C (240.26 °F).
Seperti fluorida xenon yang lain, penghasilan xenon tetrafluorida adalah eksergonik. Ia stabil pada suhu dan tekanan normal. Kesemuanya boleh terus bertindak balas dengan air, melepaskan gas xenon asli, hidrogen fluorida dan oksigen molekul. Tindak balas ini berlaku dalam udara yang sedikit lembap; oleh itu, semua xenon fluorida perlu disimpan dalam atmosfera kontang.
Rujukan[sunting | sunting sumber]
- ^ Arnold F. Holleman; Egon Wiberg (2001). Nils Wiberg (penyunting). Inorganic chemistry. translated by Mary Eagleson, William Brewer. Academic Press. m/s. 394. ISBN 0-12-352651-5.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. m/s. A23. ISBN 0-618-94690-X.
- ^ a b Zumdahl (2007). Chemistry. Boston: Houghton Mifflin. m/s. 243. ISBN 0-618-52844-X.
- ^ Claassen, H. H.; Selig, H.; Malm, J. G. (1962). "Xenon Tetrafluoride". J. Am. Chem. Soc. 84 (18): 3593. doi:10.1021/ja00877a042.CS1 maint: multiple names: authors list (link)
- ^ C. L. Chernick, H. H. Claassen, P. R. Fields 1, H. H. Hyman, J. G. Malm, W. M. Manning, M. S. Matheson, L. A. Quarterman, F. Schreiner, H. H. Selig, I. Sheft, S. Siegel, E. N. Sloth, L. Stein, M. H. Studier, J. L. Weeks, and M. H. Zirin (1962). "Fluorine Compounds of Xenon and Radon". Science. 138 (3537): 136–138. Bibcode:1962Sci...138..136C. doi:10.1126/science.138.3537.136. PMID 17818399.CS1 maint: multiple names: authors list (link)
- ^ Thomas H. Brown, E. B. Whipple, and Peter H. Verdier (1963). "Xenon Tetrafluoride: Fluorine-19 High-Resolution Magnetic Resonance Spectrum". Science. 140 (3563): 178. Bibcode:1963Sci...140..178B. doi:10.1126/science.140.3563.178. PMID 17819836.CS1 maint: multiple names: authors list (link)
- ^ James A. Ibers and Walter C. Hamilton (1963). "Xenon Tetrafluoride: Crystal Structure". Science. 139 (3550): 106–107. Bibcode:1963Sci...139..106I. doi:10.1126/science.139.3550.106. PMID 17798707.
- ^ Burns, John H.; Agron, P. A.; Levy, Henri A (1963). "Xenon Tetrafluoride Molecule and Its Thermal Motion: A Neutron Diffraction Study". Science. 139 (3560): 1208–1209. Bibcode:1963Sci...139.1208B. doi:10.1126/science.139.3560.1208. PMID 17757912.
`