Fotosistem I

| Fotosistem I | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Fotosistem tumbuhan I dengan LHC I | |||||||||
| Pengenal pasti | |||||||||
| Nombor EC | 1.97.1.12 | ||||||||
| Pangkalan data | |||||||||
| IntEnz | Lihat IntEnz | ||||||||
| BRENDA | Entri BRENDA | ||||||||
| ExPASy | Lihat NiceZyme | ||||||||
| KEGG | Entri KEGG | ||||||||
| MetaCyc | Laluan metabolik | ||||||||
| PRIAM | Profil | ||||||||
| Struktur PDB | RCSB PDB PDBj PDBe PDBsum | ||||||||
| |||||||||

Fotosistem I (PSI, atau plastosianin–feredoksin oksidoreduktase) ialah satu daripada dua fotosistem dalam tindak balas cahaya fotosintesis alga, tumbuhan dan sianobakteria. Fotosistem I[1] ialah kompleks protein membran integral yang menggunakan tenaga cahaya untuk memangkinkan pemindahan elektron merentasi membran tilakoid daripada plastosianin ke feredoksin. Akhirnya, elektron yang dipindahkan oleh fotosistem I digunakan untuk menghasilkan pembawa hidrogen tenaga sederhana, NADPH.[2] Tenaga foton yang diserap oleh fotosistem I juga menghasilkan daya motif proton yang digunakan untuk menjana ATP. PSI terdiri daripada lebih daripada 110 kofaktor, lebih ketara daripada fotosistem II.[3]
Sejarah[sunting | sunting sumber]
Fotosistem ini dikenali sebagai PSI kerana ia ditemui sebelum fotosistem II, walaupun eksperimen mendatang menunjukkan bahawa fotosistem II sebenarnya ialah enzim pertama rantai pengangkutan elektron fotosintesis. Aspek PSI ditemui pada tahun 1950-an, tetapi kepentingan penemuan ini masih belum diiktiraf pada masa itu.[4] Louis Duysens mula-mula mencadangkan konsep fotosistem I dan II pada tahun 1960, dan, pada tahun yang sama, cadangan oleh Fay Bendall dan Robert Hill mengumpulkan penemuan-penemuan awal ke dalam teori koheren bagi tindak balas fotosintesis bersiri.[4] Hipotesis Hill dan Bendall kemudiannya disahkan dalam eksperimen yang dijalankan pada tahun 1961 oleh kumpulan Duysens dan Witt.[4]
Komponen dan tindakan[sunting | sunting sumber]
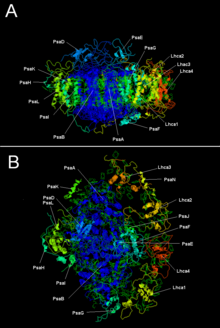
Dua subunit utama PSI, PsaA dan PsaB, ialah protein yang berkait rapat yang terlibat dalam pengikatan kofaktor pemindahan elektron penting, P700, Acc, A0, A1, dan Fx. PsaA dan PsaB kedua-duanya ialah protein membran integral 730 hingga 750 asid amino yang mengandungi 11 segmen transmembran. Satu gugusan besi-sulfur [4Fe-4S] dipanggil Fx diselaraskan oleh empat sisteina; dua sisteina disediakan setiap satu oleh PsaA dan PsaB. Kedua-dua sisteina dalam setiap subunit adalah proksimal, dan terletak dalam gelung di antara segmen transmembran kesembilan dan kesepuluh. Motif zip leusina nampaknya terdapat[5] di hilir sisteina, dan boleh menyumbang kepada pendimeran PsaA/PsaB. Penerima elektron terminal, FA and FB, juga gugusan besi-sulfur [4Fe-4S], terletak di dalam protein 9 kDa yang dipanggil PsaC yang mengikat kepada teras PsaA/PsaB berhampiran Fx.[6][7]
| Subunit protein | Keterangan |
|---|---|
| PsaA | Protein transmembran besar terlibat dalam pengikatan P700, A0, A1, and Fx. Sebahagian keluarga protein pusat tindak balas fotosintesis |
| PsaB | |
| PsaC | Pusat besi-sulfur; apoprotein Fa dan Fb |
| PsaD | Diperlukan bagi pemasangan, membantu mengikat feredoksin. InterPro: IPR003685 |
| PsaE | InterPro: IPR003375 |
| PsaI | Mungkin menstabilkan PsaL. Menstabilkan kompleks penuai cahaya II.[9] InterPro: IPR001302 |
| PsaJ | InterPro: IPR002615 |
| PsaK | InterPro: IPR035982 |
| PsaL | InterPro: IPR036592 |
| PsaM | InterPro: IPR010010 |
| PsaX | InterPro: IPR012986 |
| Kompleks sitokrom b6f | Protein larut |
| Fa | Daripada PsaC; dalam rantaian pengangkutan elektron (ETC) |
| Fb | Daripada PsaC; dalam ETC |
| Fx | Daripada PsaAB; dalam ETC |
| Feredoksin | Pembawa elektron dalam ETC |
| Plastocyanin | Protein larut |
| Lipid | Keterangan |
| MGDG II | Lipid monogalaktosildigliserida |
| PG I | Fosfolipid fosfatidilgliserol |
| PG III | Fosfolipid fosfatidilgliserol |
| PG IV | Fosfolipid fosfatidilgliserol |
| Pigment | Keterangan |
| Klorofil a | 90 molekul pigmen dalam sistem antena |
| Klorofil a | 5 molekul pigmen dalam ETC |
| Klorofil a0 | Penerima elektron awal bagi klorofil terubah suai dalam ETC |
| Klorofil a′ | 1 molekul pigmen dalam ETC |
| β-Karotene | 22 molekul pigmen karotenoid |
| Koenzim dan kofaktor | Keterangan |
| QK-A | Filokuinon vitamin K1 penerima elektron awal dalam ETC |
| QK-B | Filokuinon vitamin K1 penerima elektron awal dalam ETC |
| FNR | Feredoksin-NADP+ oksidoreduktase |
| Ca2+ | Ion kalsium |
| Mg2+ | Ion magnesium |
Foton[sunting | sunting sumber]
Fotopengujaan molekul pigmen dalam kompleks antena mendorong pemindahan elektron dan tenaga. [10]
Kompleks antena[sunting | sunting sumber]
Kompleks antena terdiri daripada molekul klorofil dan karotenoid yang dipasang di dua protein.[11] Molekul pigmen ini menghantar tenaga resonans daripada foton apabila mereka menjadi fototeruja. Molekul antena boleh menyerap semua panjang gelombang cahaya dalam spektrum tampak.[12] Bilangan molekul pigmen ini berbeza dari organisma ke organisma. Sebagai contoh, sianobakteria Synechococcus elongatus (Thermosynechococcus elongatus) mempunyai kira-kira 100 klorofil dan 20 karotenoid, manakala kloroplas bayam mempunyai sekitar 200 klorofil dan 50 karotenoid. [12] [3] Di dalam kompleks antena PSI ialah molekul klorofil yang dipanggil pusat tindak balas P700. Tenaga yang disalurkan oleh molekul antena diarahkan ke pusat tindak balas. Ada mungkin sebanyak 120 atau paling sedikit 25 molekul klorofil di dalam setiap P700.[13]
Pusat tindak balas P700[sunting | sunting sumber]
Pusat tindak balas P700 terdiri daripada klorofil a terubah suai yang paling baik menyerap cahaya pada panjang gelombang 700 nm.[14] P700 menerima tenaga daripada molekul antena, dan menggunakan tenaga daripada setiap foton untuk menaikkan elektron ke tahap tenaga yang lebih tinggi (P700*). Elektron ini digerakkan secara berpasangan dalam proses pengoksidaan/penurunan daripada P700* kepada penerima elektron, meninggalkan P700+. Pasangan P700*- P700+ mempunyai potensi elektrik kira-kira −1.2 volt. Pusat tindak balas diperbuat daripada dua molekul klorofil dan oleh itu dirujuk sebagai dimer.[11] Dimer dianggap terdiri daripada satu molekul klorofil a dan satu molekul klorofil a'. Walau bagaimanapun, jika P700 membentuk kompleks dengan molekul antena lain, ia tidak lagi boleh menjadi dimer.[13]
Klorofil A0 dan A1 terubah suai[sunting | sunting sumber]
Kedua-dua molekul klorofil yang diubah suai ialah penerima elektron awal dalam PSI. Mereka hadir satu per sisi PsaA/PsaB, membentuk dua cabang yang boleh diambil oleh elektron untuk mencapai Fx. A0 menerima elektron daripada P700*, menghantarnya ke A1 dari sisi yang sama, yang kemudiannya menghantar elektron ke kuinon pada sisi yang sama. Spesies yang berbeza nampaknya mempunyai keutamaan yang berbeza bagi sama ada cabang A/B. [15]
Filokuinon[sunting | sunting sumber]
Filokuinon, kadangkala dipanggil vitamin K1,[16] ialah penerima elektron awal seterusnya dalam PSI. Ia mengoksidakan A1 untuk menerima elektron, dan seterusnya dioksidakan semula oleh Fx, dari mana elektron dihantar ke Fb dan Fa.[16][17] Penurunan Fx nampaknya merupakan langkah pengehad kadar.[15]
Kompleks besi-sulfur[sunting | sunting sumber]
Tiga pusat tindak balas besi-sulfur berprotein ditemui dalam PSI. Berlabel Fx, Fa, dan Fb, ia berfungsi sebagai geganti elektron.[18] Fa dan Fb terikat di subunit protein kompleks PSI, dan Fx terikat di kompleks PSI.[18] Pelbagai eksperimen telah menunjukkan beberapa perbezaan antara teori orientasi kofaktor besi-sulfur dan susunan operasi.[18] Dalam satu model, Fx menghantar elektron kepada Fa, yang meneruskannya kepada Fb untuk mencapai feredoksin. [15]
Feredoksin[sunting | sunting sumber]
Feredoksin (Fd) ialah protein larut yang memudahkan pengurangan NADP+ kepada NADPH. [19] Fd bergerak untuk membawa elektron sama ada ke tilakoid tunggal atau enzim yang menurunkan NADP+.[19] Membran tilakoid mempunyai satu tapak pengikatan untuk setiap fungsi Fd.[19] Fungsi utama Fd adalah untuk membawa elektron dari kompleks besi-sulfur ke feredoksin-NADP+ reduktase.[19]
Ferredoksin–NADP+ reduktase[sunting | sunting sumber]
Enzim ini memindahkan elektron dari feredoksin diturunkan kepada NADP+ untuk melengkapkan penurunan kepada NADPH.[20] Enzim ini juga boleh menerima elektron daripada NADPH dengan mengikatnya.[20]
Plastosianin[sunting | sunting sumber]
Plastosianin ialah pembawa elektron yang memindahkan elektron daripada sitokrom b6f ke kofaktor P700 PSI dalam keadaan terionnya, P700+.[10][21]
Domain protein Ycf4[sunting | sunting sumber]
Domain protein Ycf4 yang terdapat pada membran tilakoid adalah penting buat fotosistem I. Protein transmembran tilakoid ini membantu memasang komponen fotosistem I. Tanpanya, fotosintesis akan menjadi tidak cekap. [22]
Evolusi[sunting | sunting sumber]
Data molekul menunjukkan bahawa PSI berkemungkinan berkembang daripada fotosistem bakteria sulfur hijau. Fotosistem bakteria sulfur hijau dan sianobakteria, alga, dan tumbuhan darjat tinggi adalah tidak sama, tetapi terdapat banyak fungsi analog dan struktur yang serupa. Tiga ciri utama adalah serupa antara fotosistem yang berbeza.[23] Pertama, potensi redoks cukup negatif untuk mengurangkan feredoksin.[23] Seterusnya, pusat tindak balas penerimaan elektron termasuk protein besi-sulfur.[23] Akhir sekali, pusat redoks dalam kompleks kedua-dua fotosistem dibina di atas dimer subunit protein.[23] Fotosistem bakteria sulfur hijau malah mengandungi semua kofaktor yang sama bagi rantaian pengangkutan elektron dalam PSI.[23] Bilangan dan tahap persamaan antara kedua-dua fotosistem menunjukkan bahawa PSI dan fotosistem analog bakteria sulfur hijau berkembang daripada fotosistem leluhur yang sama.
Rujukan[sunting | sunting sumber]
- ^ "Structure, function and organization of the Photosystem I reaction center complex". Biochimica et Biophysica Acta (BBA) - Reviews on Bioenergetics. 895 (3): 167–204. 1987. doi:10.1016/s0304-4173(87)80002-2. PMID 3333014.
- ^ "Physiological Functions of Cyclic Electron Transport Around Photosystem I in Sustaining Photosynthesis and Plant Growth". Annual Review of Plant Biology. 67: 81–106. April 2016. doi:10.1146/annurev-arplant-043015-112002. PMID 26927905.
- ^ a b "Structure and function of photosystems I and II". Annual Review of Plant Biology. 57: 521–65. 2006. doi:10.1146/annurev.arplant.57.032905.105350. PMID 16669773.
- ^ a b c "Unraveling the photosystem I reaction center: a history, or the sum of many efforts". Photosynthesis Research. 80 (1–3): 109–24. 2004. doi:10.1023/B:PRES.0000030657.88242.e1. PMID 16328814.
- ^ "Photosystem I reaction-centre proteins contain leucine zipper motifs. A proposed role in dimer formation". FEBS Letters. 264 (1): 1–4. May 1990. doi:10.1016/0014-5793(90)80749-9. PMID 2186925.
- ^ "Breaking biological symmetry in membrane proteins: the asymmetrical orientation of PsaC on the pseudo-C2 symmetric Photosystem I core". Cellular and Molecular Life Sciences. 66 (7): 1257–70. April 2009. doi:10.1007/s00018-009-8673-x. PMID 19132290.
- ^ "Understanding of the binding interface between PsaC and the PsaA/PsaB heterodimer in photosystem I". Biochemistry. 48 (23): 5405–16. June 2009. doi:10.1021/bi900243f. PMID 19432395.
- ^ "The assembly of protein subunits and cofactors in photosystem I". Current Opinion in Structural Biology. 12 (2): 244–54. April 2002. doi:10.1016/S0959-440X(02)00317-2. PMID 11959504.
- ^ Plöchinger, Magdalena; Torabi, Salar; Rantala, Marjaana; Tikkanen, Mikko; Suorsa, Marjaana; Jensen, Poul-Erik; Aro, Eva Mari; Meurer, Jörg (September 2016). "The Low Molecular Weight Protein PsaI Stabilizes the Light-Harvesting Complex II Docking Site of Photosystem I". Plant Physiology. 172 (1): 450–463. doi:10.1104/pp.16.00647. PMC 5074619. PMID 27406169.
- ^ a b Raven PH, Evert RF, Eichhorn SE (2005). "Photosynthesis, Light, and Life". Biology of Plants (ed. 7th). New York: W. H. Freeman. m/s. 121–127. ISBN 978-0-7167-1007-3.
- ^ a b Zeiger E, Taiz L (2006). "Ch. 7: Topic 7.8: Photosystem I". Plant Physiology (ed. 4th). Sunderland, MA: Sinauer Associates. ISBN 0-87893-856-7.
- ^ a b "The Photosynthetic Process". Diarkibkan daripada yang asal pada 2009-02-19.
- ^ a b "Molecular arrangement of pigment-protein complex of photosystem 1". Photosynthesis Research. 9 (1–2): 3–12. January 1986. doi:10.1007/BF00029726. PMID 24442279.
- ^ "Primary photochemistry in photosystem-I". Photosynthesis Research. 6 (4): 295–316. December 1985. doi:10.1007/BF00054105. PMID 24442951.
- ^ a b c Grotjohann, I; Fromme, P (2013). "Photosystem I". Encyclopedia of biological chemistry (ed. Second). London. m/s. 503–507. doi:10.1016/B978-0-12-378630-2.00287-5. ISBN 978-0-12-378630-2.
- ^ a b Itoh, Shigeru; Iwaki, Masayo (1989). "Vitamin K1 (Phylloquinone) Restores the Turnover of FeS centers of Ether-extracted Spinach PSI Particles". FEBS Letters. 243 (1): 47–52. doi:10.1016/0014-5793(89)81215-3.
- ^ "Is phylloquinone an obligate electron carrier in photosystem I?". FEBS Letters. 215 (1): 58–62. May 1987. doi:10.1016/0014-5793(87)80113-8. PMID 3552735.
- ^ a b c "Iron-sulfur clusters in type I reaction centers". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1507 (1–3): 139–60. October 2001. doi:10.1016/S0005-2728(01)00197-9. PMID 11687212.
- ^ a b c d Forti, Georgio; Maria, Paola; Grubas, Giovanna (1985). "Two Sites of Interaction of Ferredoxin with thylakoids". FEBS Letters. 186 (2): 149–152. doi:10.1016/0014-5793(85)80698-0.
- ^ a b "Investigation of the Diaphorase Reaction of Ferredoxin–NADP+ Reductase by Electrochemical Methods" (PDF). Bioelectrochemistry and Bioenergetics. 47 (1): 179–183. November 1998. doi:10.1016/S0302-4598(98)00175-5.
- ^ "Electron transfers amongst cytochrome f, plastocyanin and photosystem I: kinetics and mechanisms". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1456 (1): 5–26. January 2000. doi:10.1016/S0005-2728(99)00101-2. PMID 10611452.
- ^ "The chloroplast ycf3 and ycf4 open reading frames of Chlamydomonas reinhardtii are required for the accumulation of the photosystem I complex". The EMBO Journal. 16 (20): 6095–104. October 1997. doi:10.1093/emboj/16.20.6095. PMC 1326293. PMID 9321389.
- ^ a b c d e Lockau, Wolfgang; Nitschke, Wolfgang (1993). "Photosystem I and its Bacterial Counterparts". Physiologia Plantarum. 88 (2): 372–381. doi:10.1111/j.1399-3054.1993.tb05512.x.
