Kompleks piruvat dehidrogenase

Kompleks dehidrogenase piruvat (PDC) ialah kompleks tiga enzim yang menukarkan piruvat kepada asetil-KoA melalui proses yang dipanggil dekarboksilasi piruvat.[1] Acetyl-CoA kemudiannya boleh digunakan dalam kitaran asid sitrik untuk menjalankan respirasi selular, dan kompleks ini menghubungkan laluan metabolik glikolisis kepada kitaran asid sitrik. Dekarboksilasi piruvat juga dikenali sebagai "tindak balas piruvat dehidrogenase" kerana ia juga melibatkan pengoksidaan piruvat.[2]
Kompleks berbilang enzim ini memiliki hubung kait secara struktur dan berfungsi dengan kompleks berbilang oksoglutarat dehidrogenase dan dehidrogenase oksoasid rantai bercabang.
Tindak balas[sunting | sunting sumber]
Tindak balas yang dimangkinkan oleh kompleks piruvat dehidrogenase ialah:
| piruvat | kompleks piruvat dehidrogenase | asetil-KoA | |

|
|||
| CoA-SH + NAD+ | CO2 + NADH + H+ | ||

| |||
Struktur[sunting | sunting sumber]
Piruvat dehidrogenase (E1)[sunting | sunting sumber]

Subunit E1, dipanggil subunit piruvat dehidrogenase, mempunyai struktur yang terdiri daripada dua rantai (rantai "ɑ" dan "ꞵ"). Ion magnesium membentuk kompleks 4 koordinat dengan tiga sisa asid amino berkutub (Asp, Asn, dan Tyr) yang terletak di rantai alfa, dan kofaktor tiamina difosfat (TPP) yang terlibat secara langsung dalam penyahkarboksilan piruvat.[3][4]
Dihidrolipoil transasetilase (E2)[sunting | sunting sumber]
Subunit E2 atau dihidrolipoil asetiltransferase umumnya terdiri daripada tiga domain dalam kedua-dua prokariot dan eukariot. Domain terminal N (domain lipoil) terdiri daripada 1 hingga 3 kumpulan lipoil dengan kira-kira 80 asid amino setiap satu. Domain pengikat subunit persisian (PSBD) berfungsi sebagai tapak pengikatan terpilih bagi domain lain di subunit E1 dan E3. Akhir sekali, domain terminal C (mangkin) memangkinkan pemindahan kumpulan asetil dan sintesis asetil-KoA.[5]
Dihidrolipoil dehydrogenase (E3)[sunting | sunting sumber]

Subunit E3, enzim dihidrolipoil dehidrogenase, dicirikan sebagai protein homodimer di mana dua sisa sisteina dalam ikatan disulfida, dan kofaktor FAD dalam tapak aktif memudahkan tujuan utamanya sebagai pemangkin pengoksidaan. Satu contoh struktur E3 seperti yang terdapat dalam Pseudomonas putida dibentuk agar setiap subunit homodimer individu mengandungi dua domain ikatan yang bertanggungjawab untuk mengikat FAD dan NAD serta domain pusat dan domain antara muka.[6][7]
Protein pengikat dihidrolipoil dehidrogenase (E3BP)[sunting | sunting sumber]
Protein tambahan yang unik bagi kebanyakan eukariot ialah protein pengikat E3 (E3BP) yang berfungsi untuk mengikat subunit E3 ke kompleks PDC. Dalam kes E3BP manusia, sisa prolina hidrofobik dan leusina di protein pengikat berinteraksi dengan tapak pengecaman permukaan yang dibentuk oleh pengikatan dua monomer E3 yang serupa.[8]
Mekanisme[sunting | sunting sumber]
| Enzim | Singkatan | Kofaktor | # subunit prokariot | # subunit eukariot |
|---|---|---|---|---|
| piruvat dehidrogenase (EC 1.2.4.1) |
E1 | TPP (tiamina pirofosfat) magnesium | 24 | 30 |
| dihidrolipoil transasetilase (EC 2.3.1.12) |
E2 | asid alfa-lipoik (lipoat) koenzim A |
24 | 60 |
| dihidrolipoil dehidrogenase (EC 1.8.1.4) |
E3 | FAD NAD+ |
12 | 12 |
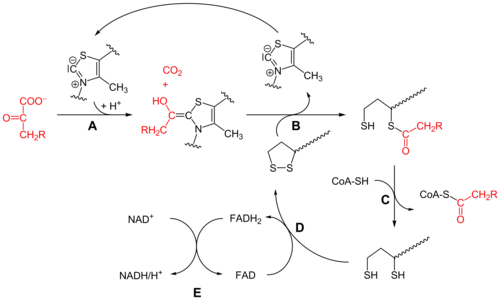
Piruvat dehidrogenase (E1)[sunting | sunting sumber]
Pada mulanya, piruvat dan tiamina pirofosfat (TPP atau vitamin B1) terikat oleh subunit piruvat dehidrogenase.[1] Cincin tiazolium TPP adalah dalam bentuk zwiterion, dan karbon C2 anionik melakukan serangan nukleofilik pada karbonil piruvat C2 (keton). Hemitioasetal yang terhasil mengalami dekarboksilasi untuk menghasilkan anion asil yang setara. Anion ini menyerang S1 spesies lipoat teroksida yang melekat di residu lisina. Dalam mekanisme seperti SN2 pembuka gelang, S2 disesarkan sebagai gugusan sulfida atau sulfhidril. Keruntuhan hemitioasetal tetrahedron seterusnya mengeluarkan tiazola, membebaskan kofaktor TPP dan menghasilkan tioasetat pada S1 lipoat. Proses bermangkin E1 ialah langkah pengehad kadar keseluruhan kompleks piruvat dehidrogenase.
Dihidrolipoil transasetilase (E2)[sunting | sunting sumber]
Pada ketika ini, kefungsian lipoat-tioester dialihkan ke dalam tapak aktif dihidrolipoil transasetilase (E2),[1] di mana tindak balas transpengasilan memindahkan asetil daripada "lengan berayun" lipoil kepada tiol koenzim A. Ini menghasilkan asetil-KoA yang dibebaskan daripada kompleks enzim dan seterusnya memasuki kitaran asid sitrik. E2 juga boleh dikenali sebagai lipoamida reduktase-transasetilase.
Dihidrolipoil dehidrogenase (E3)[sunting | sunting sumber]
Dihidrolipoat yang masih terikat dengan sisa lisina kompleks berpindah ke tapak aktif dihidrolipoil dehidrogenase (E3),[1] di mana ia mengalami pengoksidaan berperantara flavin, sama seperti di isomerase disulfida. Pertama, FAD mengoksidakan dihidrolipoat kembali kepada keadaan rehat lipoatnya lalu menghasilkan FADH2. Kemudian, kofaktor NAD+ mengoksidakan FADH2 kembali kepada keadaan rehatnya, FAD, menghasilkan NADH dan H.
Perbezaan struktur antara spesies[sunting | sunting sumber]
PDC ialah kompleks besar yang terdiri daripada berbilang salinan 3 atau 4 subunit, bergantung kepada spesies.
Bakteria negatif Gram[sunting | sunting sumber]
Dalam bakteria negatif Gram seperti Escherichia coli, PDC terdiri daripada teras padu pusat yang terdiri daripada 24 molekul E2. Sehingga 24 salinan E1 dan 12 molekul E3 terikat di bahagian luar teras E2.[9]
Bakteria positif Gram dan eukariot[sunting | sunting sumber]
Sebaliknya, dalam bakteria positif Gram (cth., Bacillus stearothermophilus) dan eukariot, teras PDC pusat mengandungi 60 molekul E2 yang disusun menjadi ikosahedron. "Teras" subunit E2 ini menyelaraskan 30 subunit E1 dan 12 salinan E3.
Eukariota juga mengandungi 12 salinan protein teras tambahan, protein pengikat E3 (E3BP) yang mengikat subunit E3 ke teras E2.[10] Lokasi sebenar E3BP tidak jelas sepenuhnya. Mikroskopi krioelektron telah membuktikan bahawa E3BP mengikat setiap muka ikosahedron dalam yis.[11] Walau bagaimanapun, ia telah dicadangkan bahawa ia menggantikan bilangan molekul E2 yang setara dalam teras PDC lembu.
Sehingga 60 molekul E1 atau E3 boleh berganding dengan teras E2 daripada bakteria positif Gram - pengikatan adalah saling eksklusif. Dalam eukariot, E1 secara khusus terikat oleh E2, manakala E3 dikaitkan dengan E3BP. ADa kepercayaan bahawa sehingga 30 enzim E1 dan 6 E3 hadir, walaupun bilangan molekul yang tepat boleh menjadi berbeza-beza ini vivo, dan selalunya mencerminkan keperluan metabolisme tisu berkenaan.
Kawal atur[sunting | sunting sumber]
Dalam eukariota PDC dikawal ketat oleh piruvat dehidrogenase kinase (PDK) dan piruvat dehidrogenase fosfatase (PDP), masing-masing menyahaktifkan dan mengaktifkannya.[12]
- PDK memfosforilasi tiga residu serina khusus di E1 dengan kadar pertalian yang berbeza. Fosforilasi mana-mana satu daripadanya (menggunakan ATP) menjadikan E1 (dan akibatnya keseluruhan kompleks) tidak aktif.[12]
- Defosforilasi E1 oleh PDP mengembalikan aktiviti kompleks.[12]
Produk tindak balas bertindak sebagai perencat alosterik PDC kerana ia mengaktifkan PDK. Substrat pula menghalang PDK, mengaktifkan semula PDC.
Penyetempatan penyahkarboksilan piruvat[sunting | sunting sumber]
Dalam sel eukariot, dekarboksilasi piruvat berlaku di dalam matriks mitokondria selepas pengangkutan substrat, yakni piruvat, dari sitosol. Pengangkutan piruvat ke dalam mitokondria dibuat melalui piruvat translokase sebagai protein pengangkut. Piruvat translokase mengangkut piruvat dalam cara simporter dengan proton (merentasi membran mitokondria dalam), yang mungkin dianggap sebagai satu bentuk pengangkutan aktif sekunder, tetapi pengesahan/sokongan lanjut mungkin diperlukan bagi penggunaan keterangan "pengangkutan aktif sekunder" di sini (Nota: kaedah pengangkutan piruvat melalui piruvat translokase nampaknya digandingkan dengan kecerunan proton menurut S. Papa et al., 1971, dan nampaknya sepadan dengan takrifan pengangkutan aktif sekunder).[13]
Sumber alternatif mengatakan "pengangkutan piruvat merentasi membran mitokondria luar nampaknya mudah dicapai melalui saluran bukan berpilih yang besar seperti saluran anion bergantungan voltan yang membolehkan resapan pasif" dan pengangkutan merentasi membran mitokondria dalam dimediasi oleh pembawa piruvat mitokondria 1 ( MPC1) dan pembawa piruvat mitokondria 2 (MPC2).[14]
Sejarah evolusi[sunting | sunting sumber]
Ada dapatan bahawa enzim piruvat dehidrogenase yang terdapat dalam mitokondria sel eukariot hampir menyerupai enzim daripada Geobacillus stearothermophilus, sejenis bakteria positif Gram. Walaupun terdapat persamaan kompleks piruvat dehidrogenase dengan bakteria positif, tidak ada banyak persamaan dengan bakteria negatif Gram. Persamaan struktur kuaterner antara piruvat dehidrogenase dan enzim dalam bakteria positif menunjukkan sejarah evolusi terkongsi tersendiri berbanding sejarah evolusi enzim sepadan dalam bakteria negatif Gram. Melalui peristiwa endosimbiosis, piruvat dehidrogenase di mitokondria eukariot menunjukkan hubungan nenek moyang sejak bakteria positif Gram.[15]
Kompleks piruvat dehidrogenase berkongsi banyak persamaan dengan dehidrogenase 2-oksoasid rantai bercabang (BCOADH), terutamanya dalam kekhususan substratnya terhadap asid alfa-keto. Secara khusus, BCOADH memangkinkan penguaraian asid amino, dan enzim ini berkemungkinan banyak semasa tempoh prasejarah Bumi dengan persekitaran limpahan asid amino. Subunit E2 daripada piruvat dehidrogenase berkembang daripada gen E2 yang terdapat dalam BCOADH manakala kedua-dua enzim mengandungi subunit E3 yang sama kerana kehadiran hanya satu gen E3. Oleh kerana subunit E1 mempunyai kekhususan tersendiri terhadap substrat tertentu, subunit E1 piruvat dehidrogenase dan BCOADH adalah berbeza-beza tetapi berkongsi persamaan genetik. Bakteria positif Gram dan sianobakteria yang kemudiannya akan menimbulkan mitokondria dan kloroplas yang ditemui dalam sel eukariot, mengekalkan subunit E1 yang berkaitan secara genetik dengan yang terdapat dalam enzim BCOADH.[16][17]
Kepentingan klinikal[sunting | sunting sumber]
Kekurangan piruvat dehidrogenase (PDCD) boleh berlaku disebabkan oleh mutasi dalam mana-mana enzim atau kofaktor yang digunakan untuk membina kompleks. Penemuan klinikal utamanya ialah asidosis laktik.[18] Mutasi PDCD sedemikian yang membawa kepada kekurangan seterusnya dalam pengeluaran NAD dan FAD menghalang proses fosforilasi oksidatif selaku kunci dalam respirasi aerob. Oleh itu, asetil-KoA sebaliknya diturunkan melalui mekanisme anaerob menjadi molekul lain seperti laktat, membawa kepada lebihan laktat badan dan patologi neurologi yang berkaitan.[19]
Walaupun kekurangan piruvat dehidrogenase jarang berlaku, terdapat pelbagai gen yang boleh menyebabkan kekurangan ini apabila bermutasi atau tidak berfungsi. Pertama, subunit E1 piruvat dehidrogenase mengandungi empat subunit berbeza: dua subunit alfa ditetapkan sebagai E1-alfa dan dua subunit beta ditetapkan sebagai E1-beta. Gen PDHA1 di subunit E1-alpha yang bermutasi menyebabkan 80% daripada kes kekurangan piruvat dehidrogenase kerana mutasi ini memendekkan protein E1-alfa. Penurunan kefungsian E1-alfa menghalang piruvat dehidrogenase daripada mengikat baik kepada piruvat, sekali gus mengurangkan aktiviti kompleks keseluruhan.[20] Apabila gen PDHB yang terdapat dalam subunit beta E1 kompleks bermutasi, ini juga membawa kepada kekurangan piruvat dehidrogenase.[21] Begitu juga, mutasi yang ditemui pada subunit kompleks lain seperti gen DLAT di subunit E2, gen PDHX di subunit E3, serta mutasi pada gen piruvat dehidrogenase fosfatase, PDP1, semuanya telah didapati membawa kepada kekurangan piruvat dehidrogenase, manakala peranan khusus mereka terhadap keadaan penyakit belum diketahui.[22][23][24]
Rujukan[sunting | sunting sumber]
- ^ a b c d DeBrosse, Suzanne D.; Kerr, Douglas S. (2016-01-01), Saneto, Russell P.; Parikh, Sumit; Cohen, Bruce H. (penyunting), "Chapter 12 - Pyruvate Dehydrogenase Complex Deficiency", Mitochondrial Case Studies (dalam bahasa Inggeris), Boston: Academic Press: 93–101, doi:10.1016/b978-0-12-800877-5.00012-7, ISBN 978-0-12-800877-5, dicapai pada 2020-11-16
- ^ J. M. Berg; J. L. Tymoczko; L. Stryer (2007). Biochemistry (ed. 6th). Freeman. ISBN 978-0-7167-8724-2.
- ^ Sgrignani, J.; Chen, J.; Alimonti, A. (2018). "How phosphorylation influences E1 subunit pyruvate dehydrogenase: A computational study". Scientific Reports. 8 (14683): 14683. Bibcode:2018NatSR...814683S. doi:10.1038/s41598-018-33048-z. PMC 6168537. PMID 30279533.
- ^ [PBD ID: 2QTC] Kale, S.; Arjunan, P.; Furey, W.; Jordan, F. (2007). "A dynamic loop at the active center of the Escherichia coli pyruvate dehydrogenase COMPLEX E1 component Modulates SUBSTRATE utilization and CHEMICAL communication with the E2 component". Journal of Biological Chemistry. 282 (38): 28106–28116. doi:10.1074/jbc.m704326200. PMID 17635929.
- ^ Patel, M. S.; Nemeria, N. S.; Furey, W.; Jordan, F. (2014). "The pyruvate dehydrogenase complexes: structure-based function and regulation". The Journal of Biological Chemistry. 289 (24): 16615–16623. doi:10.1074/jbc.R114.563148. PMC 4059105. PMID 24798336.
- ^ Billgren, E. S.; Cicchillo, R. M.; Nesbitt, N. M.; Booker, S. J. (2010). "Lipoic Acid Biosynthesis and Enzymology". Comprehensive Natural Products. 2 (7): 181–212. doi:10.1016/B978-008045382-8.00137-4.
- ^ [PDB ID: 1LVL] Mattevia, A.; Obmolova, G.; Sokatch, J. R.; Betzel, C.; Hol, W. G. (1992). "The refined crystal STRUCTURE of pseudomonas Putida LIPOAMIDE DEHYDROGENASE complexed with NAD+ at 2.45 Å resolution". Proteins: Structure, Function, and Genetics. 13 (4): 336–351. doi:10.1002/prot.340130406. PMID 1325638.
- ^ Ciszak, E. M.; Makal, A.; Hong, Y. S.; Vettaikkorumakankauv, A. K.; Korotchkina, L. G.; Patel, M. S. (2006). "How dihydrolipoamide dehydrogenase-binding protein binds dihydrolipoamide dehydrogenase in the human pyruvate dehydrogenase complex". Journal of Biological Chemistry. 281 (1): 648–655. doi:10.1074/jbc.m507850200. PMID 16263718.
- ^ "Principles of quasi-equivalence and Euclidean geometry govern the assembly of cubic and dodecahedral cores of pyruvate dehydrogenase complexes". Proc. Natl. Acad. Sci. USA. 96 (4): 1240–1245. 1999. Bibcode:1999PNAS...96.1240I. doi:10.1073/pnas.96.4.1240. PMC 15447. PMID 9990008.
- ^ Brautigam, C. A.; Wynn, R. M.; Chuang, J. L.; Machius, M.; Tomchick, D. R.; Chuang, D. T. (2006). "Structural insight into interactions between Dihydrolipoamide Dehydrogenase (E3) and E3 binding protein of Human pyruvate dehydrogenase complex". Structure. 14 (3): 611–621. doi:10.1016/j.str.2006.01.001. PMC 2879633. PMID 16442803.
- ^ Stoops, J.K., Cheng, R.H., Yazdi, M.A., Maeng, C.Y., Schroeter, J.P., Klueppelberg, U., Kolodziej, S.J., Baker, T.S., Reed, L.J. (1997) On the unique structural organization of the Saccharomyces cerevisiae pyruvate dehydrogenase complex. J. Biol. Chem. 272, 5757-5764.
- ^ a b c Pelley, John W. (2012-01-01), Pelley, John W. (penyunting), "6 - Glycolysis and Pyruvate Oxidation", Elsevier's Integrated Review Biochemistry (Second Edition) (dalam bahasa Inggeris), Philadelphia: W.B. Saunders: 49–55, doi:10.1016/b978-0-323-07446-9.00006-4, ISBN 978-0-323-07446-9, dicapai pada 2020-11-16
- ^ Papa, S (30 January 1971). "The transport of pyruvate in rat liver mitochondria". FEBS Lett. 12 (5): 285–288. doi:10.1016/0014-5793(71)80200-4. PMID 11945601.
- ^ Rutter, Jared (23 January 2013). "The long and winding road to the mitochondrial pyruvate carrier". Cancer & Metabolism. 1 (1): 6. doi:10.1186/2049-3002-1-6. PMC 3834494. PMID 24280073.
- ^ Henderson, Christopher E.; Perham, Richard N.; Finch, John T. (May 1979). "Structure and symmetry of B. stearothermophilus pyruvate dehydrogenase multienzyme complex and implications for eucaryote evolution". Cell. 17 (1): 85–93. doi:10.1016/0092-8674(79)90297-6. ISSN 0092-8674. PMID 455461.
- ^ Schreiner, Mark E.; Fiur, Diana; Holátko, Jiří; Pátek, Miroslav; Eikmanns, Bernhard J. (2005-09-01). "E1 Enzyme of the Pyruvate Dehydrogenase Complex in Corynebacterium glutamicum: Molecular Analysis of the Gene and Phylogenetic Aspects". Journal of Bacteriology. 187 (17): 6005–6018. doi:10.1128/jb.187.17.6005-6018.2005. ISSN 0021-9193. PMC 1196148. PMID 16109942.
- ^ Schnarrenberger, Claus; Martin, William (2002-02-01). "Evolution of the enzymes of the citric acid cycle and the glyoxylate cycle of higher plants". European Journal of Biochemistry. 269 (3): 868–883. doi:10.1046/j.0014-2956.2001.02722.x. ISSN 0014-2956. PMID 11846788.
- ^ "Pyruvate dehydrogenase deficiency". Genetics Home Reference. Dicapai pada March 17, 2013.
- ^ Gupta, N.; Rutledge, C. (2019). "Pyruvate Dehydrogenase Complex Deficiency: An Unusual Cause of Recurrent Lactic Acidosis in a Paediatric Critical Care Unit". The Journal of Critical Care Medicine. 5 (2): 71–75. doi:10.2478/jccm-2019-0012. PMC 6534940. PMID 31161145.
- ^ Lissens, Willy; De Meirleir, Linda; Seneca, Sara; Liebaers, Inge; Brown, Garry K.; Brown, Ruth M.; Ito, Michinori; Naito, Etsuo; Kuroda, Yasuhiro (March 2000). "Mutations in the X-linked pyruvate dehydrogenase (E1) ? subunit gene (PDHA1) in patients with a pyruvate dehydrogenase complex deficiency". Human Mutation. 15 (3): 209–219. doi:10.1002/(sici)1098-1004(200003)15:3<209::aid-humu1>3.0.co;2-k. ISSN 1059-7794. PMID 10679936.
- ^ Okajima, K.; Korotchkina, L.G.; Prasad, C.; Rupar, T.; Phillips III, J.A.; Ficicioglu, C.; Hertecant, J.; Patel, M.S.; Kerr, D.S. (April 2008). "Mutations of the E1β subunit gene (PDHB) in four families with pyruvate dehydrogenase deficiency". Molecular Genetics and Metabolism. 93 (4): 371–380. doi:10.1016/j.ymgme.2007.10.135. ISSN 1096-7192. PMID 18164639.
- ^ Head, Rosemary A.; Brown, Ruth M.; Zolkipli, Zarazuela; Shahdadpuri, Raveen; King, Mary D.; Clayton, Peter T.; Brown, Garry K. (2005-07-27). "Clinical and genetic spectrum of pyruvate dehydrogenase deficiency: Dihydrolipoamide acetyltransferase (E2) deficiency". Annals of Neurology. 58 (2): 234–241. doi:10.1002/ana.20550. ISSN 0364-5134. PMID 16049940.
- ^ Pavlu-Pereira, Hana; Silva, Maria João; Florindo, Cristina; Sequeira, Sílvia; Ferreira, Ana Cristina; Duarte, Sofia; Rodrigues, Ana Luísa; Janeiro, Patrícia; Oliveira, Anabela (December 2020). "Pyruvate dehydrogenase complex deficiency: updating the clinical, metabolic and mutational landscapes in a cohort of Portuguese patients". Orphanet Journal of Rare Diseases. 15 (1): 298. doi:10.1186/s13023-020-01586-3. PMC 7579914. PMID 33092611.
- ^ Heo, Hye Jin; Kim, Hyoung Kyu; Youm, Jae Boum; Cho, Sung Woo; Song, In-Sung; Lee, Sun Young; Ko, Tae Hee; Kim, Nari; Ko, Kyung Soo (August 2016). "Mitochondrial pyruvate dehydrogenase phosphatase 1 regulates the early differentiation of cardiomyocytes from mouse embryonic stem cells". Experimental & Molecular Medicine. 48 (8): e254. doi:10.1038/emm.2016.70. ISSN 2092-6413. PMC 5007642. PMID 27538372.
Pautan luar[sunting | sunting sumber]
- https://web.archive.org/web/20070405211049/http://www.dentistry.leeds.ac.uk/biochem/MBWeb/mb1/part2/krebs.htm#animat1 - animasi mekanisme umum PDC (pautan di sebelah kanan atas) di Universiti Leeds
- Pyruvate+Dehydrogenase+Complex dalam Tajuk Subjek Perubatan (MeSH) di Perpustakaan Perubatan Negara AS










