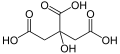
Asid sitrik
| |||

| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Asid 2-hidroksipropana-1,2,3-trikarboksilik
| |||
| Nama lain | |||
| Pengecam | |||
Imej model 3D Jmol
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.973 | ||
| Nombor EC |
| ||
| Nombor E | E330 (pengantioksida & pengawal keasidan) | ||
| KEGG | |||
PubChem CID
|
|||
| Nombor RTECS |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C6H8O7 | |||
| Jisim molar | 192.12 g·mol−1 | ||
| Rupa bentuk | pepejal berhablur putih | ||
| Bau | tak berbau | ||
| Ketumpatan | 1.665 g/cm3 (kontang) 1.542 g/cm3 (18 °C, monohidrat) | ||
| Takat lebur | 156 °C (313 °F; 429 K) | ||
| Takat didih | 310 °C (590 °F; 583 K) | ||
| 117.43 g/100 mL (10 °C) 147.76 g/100 mL (20 °C) 180.89 g/100 mL (30 °C) 220.19 g/100 mL (40 °C) 382.48 g/100 mL (80 °C) 547.79 g/100 mL (100 °C)[2] | |||
| Keterlarutan | larut dalam alkohol, eter, etil asetat, dimetil sulfoksida tidak larut dalam C6H6, CHCl3, CS2, toluena[3] | ||
| Keterlarutan dalam etanol | 62 g/100 g (25 °C) | ||
| Keterlarutan dalam amil asetat | 4.41 g/100 g (25 °C)[3] | ||
| Keterlarutan dalam dietil eter | 1.05 g/100 g (25 °C)[3] | ||
| Keterlarutan dalam 1,4-Dioksana | 35.9 g/100 g (25 °C)[3] | ||
| log P | -1.64 | ||
| Keasidan (pKa) | 1 = 3.13 2 = 4.76 3 = 6.39,[4] 6.40[5] | ||
Indeks biasan (nD)
|
1.493 - 1.509 (20 °C)[2] 1.46 (150 °C)[3] | ||
| Kelikatan | 6.5 cP (50% aq. sol.)[2] | ||
| Struktur | |||
| Struktur kristal | Monoklinik | ||
| Termokimia | |||
| Muatan haba tentu, C | 226.51 J/mol·K (26.85 °C)[6] | ||
| Entropi molar piawai S |
252.1 J/mol·K[6] | ||
Entalpi pembentukan
piawai (ΔfH⦵298) |
-1548.8 kJ/mol[2] | ||
Entalpi pembakaran
piawai (ΔcH⦵298) |
-1960.6 kJ/mol[6] -1972.34 kJ/mol (monohydrate)[2] | ||
| Bahaya | |||
| Bahaya-bahaya utama | kerengsaan kulit dan mata | ||
| Piktogram GHS |  [7] [7]
| ||
| Perkataan isyarat GHS | Warning | ||
| H319[7] | |||
| P305+351+338[7] | |||
| NFPA 704 (berlian api) | |||
| Takat kilat | 155 °C (311 °F; 428 K) | ||
| 345 °C (653 °F; 618 K) | |||
| Had letupan | 8% | ||
| Dos maut (LD) atau kepekatan dos maut (LC) | |||
LD50 (median dos)
|
3000 mg/kg (rats, oral) | ||
| Sebatian berkaitan | |||
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |||
| | |||
| Rujukan kotak info | |||
Asid sitrik merupakan asid organik lemah dengan formula C6H8O7. Ia merupakan pengawet semula jadi yang wujud secara semula jadi dalam buah sitrus dan juga digunakan untuk menambah rasa berasid atau masam kepada makanan dan minuman. Dalam biokimia, bes konjugat bagi asid sitrik, sitrat, adalah penting sebagai perantara dalam kitaran asid sitrik, yang berlaku dalam proses metabolisme bagi seluruh organisma aerobik. Ia terdiri daripada 3 kumpulan karboksil (R-COOH).
Asid sitrik merupakan bahan kimia komoditi, dan lebih daripada satu juta tan dihasilkan setiap tahun melalui kaedah penapaian. Sebahagian besarnya ia digunakan sebagai pengasid, perisa, dan sebagai agen pengelat.
Ciri-ciri[sunting | sunting sumber]

| Kepekatan | pH |
|---|---|
| 1M | ≈1.57 |
| 0.5M | ≈1.72 |
| 0.1M | ≈2.57 |
Pada suhu bilik, asid sitrik merupakan serbuk putih higroskopik berhablur. Ia boleh wujud dalam bentuk kontang (bebas air) atau sebagai monohidrat. Bentuk kontang terhablur dari air panas, manakala monohidrat terbentuk apabila asid sitrik dihablurkan dari air sejuk. Monohidrat boleh ditukar kepada bentuk yang kontang dengan pemanasan melebihi 78 °C. Asid sitrik juga terlarut dalam pelarut etanol kontang (76 bahagian asid sitrik per 100 bahagian etanol) pada suhu 15 °C.
Dalam struktur kimia, asid sitrik berkongsi sifat sebahagian besar asid karboksilik. Apabila ia dipanaskan melebihi 175 °C, ia terurai melalui proses kehilangan karbon dioksida dan air (lihat pengdekarboksilan).
Asid sitrik adalah asid lebih kuat sedikit daripada asid karboksilik biasa kerana anion boleh distabilkan oleh ikatan hidrogen intramolekul dari kumpulan protik lain pada asid sitrik.
Dalam biokimia[sunting | sunting sumber]
Sitrat ialah perantaraan dalam kitaran asid sitrik, juga dikenali sebagai kitaran asid trikarboksilik atau kitaran Krebs, laluan metabolik pusat haiwan, tumbuhan dan bakteria. Sitrat sintase memangkinkan pemeluwapan oksaloasetat dengan asetil-KoA untuk membentuk sitrat. Sitrat kemudian bertindak sebagai substrat kepada akonitase, dan ditukar kepada asid akonitik. Kitaran ini berakhir dengan penjanaan semula oksaloasetat. Siri tindak balas kimia ini adalah sumber dua pertiga daripada tenaga yang diperolehi makanan dalam organisma darjat tinggi. Hans Adolf Krebs menerima Hadiah Nobel dalam Fisiologi atau Perubatan pada 1953 sempena penemuannya itu.
Sesetengah bakteria (terutamanya E. coli) boleh menghasilkan dan mengambil sitrat secara dalaman sebagai sebahagian daripada kitaran TCA mereka, tetapi tidak dapat menggunakannya sebagai makanan kerana ketiadaan enzim yang diperlukan untuk mengimportnya ke dalam sel. Selepas berpuluh-puluh ribu evolusi dalam medium glukosa minimum yang juga mengandungi sitrat semasa Percubaan Evolusi Jangka Panjang oleh Richard Lenski, varian E. coli berevolusi dengan keupayaan untuk berkembang secara aerobik dengan sitrat. Zachary Blount, pelajar Lenski dan rakan sekerja mengkaji E. coli "Cit+" ini[8][9] sebagai sebuah model cara sifat baharu berkembang. Mereka menemui bukti bahawa dalam kes ini, perkembangan itu disebabkan oleh mutasi penggandaan yang jarang berlaku disebabkan pengumpulan beberapa mutasi "pengupaya" sebelum ini, dengan identiti dan kesannya masih dalam kajian.
Rujukan[sunting | sunting sumber]
- ^ David R. Lide, penyunting (2005). "Physical Constants of Organic Compounds". CRC Handbook of Chemistry and Physics (ed. Internet Version). Boca Raton, FL: CRC Press.
- ^ a b c d e CID 311 daripada PubChem
- ^ a b c d e "Asid sitrik". chemister.ru. Diarkibkan daripada yang asal pada 29 November 2014. Dicapai pada 1 Jun 2014.
- ^ "Data for Biochemical Research". ZirChrom Separations, Inc. Dicapai pada January 11, 2012.
- ^ "Ionization Constants of Organic Acids". Michigan State University. Dicapai pada January 11, 2012.
- ^ a b c Citric acid dalam Linstrom, Peter J.; Mallard, William G. (penyunting); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD) (dicapai pada 2014-06-02)
- ^ a b c http://www.sigmaaldrich.com/catalog/product/sial/251275 Citric acid
- ^ Powell, Alvin (February 14, 2014). "59,000 generations of bacteria, plus freezer, yield startling results". phys.org. Dicapai pada April 13, 2017.
- ^ Blount, Z. D.; Borland, C. Z.; Lenski, R. E. (4 June 2008). "Historical contingency and the evolution of a key innovation in an experimental population of Escherichia coli". Proceedings of the National Academy of Sciences. 105 (23): 7899–7906. Bibcode:2008PNAS..105.7899B. doi:10.1073/pnas.0803151105. PMC 2430337. PMID 18524956.
Pautan luar[sunting | sunting sumber]
| Wikimedia Commons mempunyai media berkaitan Asid sitrik |
- Citric acid MS Spectrum
- The European Citric Acid Manufacturers Association Diarkibkan 2018-11-26 di Wayback Machine
- NextBio Citric Acid Entry
- Citric acid analysis – free spreadsheet for titration of acids and pH calculation
- Applications of Citric Acid Diarkibkan 2009-11-22 di Wayback Machine
- National Institutes of Health Household Products Database