Sitrat sintase
| CS | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Pengecam | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | CS, citrate synthase | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Pengecam-pengecam luaran | OMIM: 118950 MGI: 88529 HomoloGene: 56073 GeneCards: CS | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Enzim sitrat sintase EC 2.3.3.1 (sebelum ini 4.1.3.7)] wujud dalam hampir semua sel hidup, dan merupakan enzim yang bertanggungjawab dalam langkah pertama kitaran asid sitrik (atau kitaran Krebs).[4] Sintase sitrat disetempat dalam sel eukariot dalam matriks mitokondrion, tetapi dikodkan oleh DNA nukleus dan bukannya mitokondrion. Ia disintesis menggunakan ribosom sitoplasma, dan kemudiannya diangkut ke dalam matriks mitokondrion.
Sitrat sintase biasanya digunakan sebagai penanda enzim kuantitatif untuk menentukan kehadiran mitokondria yang utuh. Aktiviti maksimum sitrat sintase menunjukkan kandungan mitokondria otot rangka.[5] Aktiviti maksimum boleh ditingkatkan dengan latihan daya tahan atau latihan selang intensiti tinggi,[5] tetapi aktiviti maksimum ditingkatkan lagi dengan latihan selang intensiti tinggi.[6]
Sintase sintase memangkinkan tindak balas pemeluwapan sisa dua karbon asetat daripada asetil koenzim A dan molekul empat karbon oksaloasetat untuk membentuk enam karbon sitrat:[4]
- asetil-KoA + oksaloasetat + H2O → sitrat + KoA-SH
Oksaloasetat dijana semula selepas selesai satu pusingan kitaran Krebs.
Oksaloasetat ialah substrat pertama yang mengikat enzim. Ini mendorong enzim untuk mengubah bentuknya, dan mewujudkan tapak pengikat asetil-KoA. Hanya apabila sitril-KoA ini terbentuk, barulah satu lagi perubahan konformasi, menyebabkan hidrolisis tioester dan membebaskan koenzim A. Ini memastikan tenaga yang dibebaskan daripada belahan ikatan tioester akan memacu pemeluwapan.
Struktur[sunting | sunting sumber]
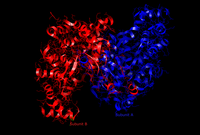
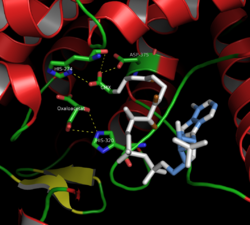
437 asid amino sitrat sintase disusun menjadi dua subunit utama, setiap satu terdiri daripada 20 alfa-heliks. Heliks alfa ini membentuk kira-kira 75% struktur tertier sitrat sintase, manakala baki selebihnya secara utamanya menyusun lanjutan struktur yang tidak sekata, menyimpan satu helaian beta daripada 13 sisa. Di antara kedua-dua subunit ini, satu celah wujud yang mengandungi tapak aktif. Dua tapak pengikat boleh didapati di dalamnya: satu dikhaskan untuk sitrat atau oksaloasetat, dan satu lagi untuk koenzim A. Tapak aktif mengandungi tiga sisa utama: His274, His320 dan Asp375, yang sangat selektif dalam interaksinya dengan substrat.[7] Imej bersebelahan memaparkan struktur tertier sintase sitrat dalam bentuk terbuka dan tertutup. Enzim berubah daripada terbuka kepada tertutup dengan penambahan salah satu substratnya (seperti oksaloasetat).[8]
Fungsi[sunting | sunting sumber]
| Sitrat (Si)-sintase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Pengenal pasti | |||||||||
| Nombor EC | 2.3.3.1 | ||||||||
| Nombor CAS | 9027-96-7 | ||||||||
| Pangkalan data | |||||||||
| IntEnz | Lihat IntEnz | ||||||||
| BRENDA | Entri BRENDA | ||||||||
| ExPASy | Lihat NiceZyme | ||||||||
| KEGG | Entri KEGG | ||||||||
| MetaCyc | Laluan metabolik | ||||||||
| PRIAM | Profil | ||||||||
| Struktur PDB | RCSB PDB PDBj PDBe PDBsum | ||||||||
| Ontologi gen | AmiGO / EGO | ||||||||
| |||||||||
Mekanisme[sunting | sunting sumber]
Sintase sitrat mempunyai tiga asid amino utama dalam tapak aktifnya (dikenali sebagai triad pemangkin) yang memangkinkan penukaran asetil-KoA [H3CC(=O)−SCoA] dan oksaloasetat [−O2CCH2C(=O)CO2−] menjadi sitrat [−O2CCH2C(OH)(CO2−)CH2CO2−] dan H−SCoA dalam tindak balas pemeluwapan aldol. Produk sitrat dikatakan prokiral.[9] Penukaran ini bermula dengan atom oksigen rantai sisi karboksilat bercas negatif Asp-375 menyahproton asetil CoA atom karbon alfa untuk membentuk anion enolat yang seterusnya dineutralkan oleh pemprotonan oleh His-274 untuk membentuk perantaraan enol, [H2C=C(OH)−SCoA]. Pada ketika ini, pasangan elektron bebas epsilon nitrogen di His-274 yang terbentuk dalam langkah terakhir mengabstrak proton hidroksil enol untuk mengubah anion enolat yang memulakan serangan nukleofil di karbon karbonil oksaloasetat [-O2CCH2C(=O)CO2−], yang seterusnya menyahproton atom nitrogen epsilon His-320. Penambahan nukleofilik ini menghasilkan pembentukan sitroil−KoA [−O2CCH2CH(CO2−)CH2C(=O)−SCoA]. Pada ketika ini, molekul air dinyahproton oleh atom nitrogen epsilon His-320, dan hidrolisis dimulakan. Salah satu pasangan tunggal oksigen secara nukleofilik menyerang karbon karbonil sitroil−KoA. Ini membentuk perantaraan tetrahedral dan menghasilkan pelepasan −SKoA sebagai reformasi karbonil. −SKoA diprotonkan untuk membentuk HSCoA. Akhir sekali, hidroksil yang ditambahkan pada karbonil dalam langkah sebelumnya dinyahproton, dan sitrat [−O2CCH2C(OH)(CO2−)CH2CO2−] terbentuk.[10]

Perencatan[sunting | sunting sumber]
Enzim ini dihalang oleh nisbah tinggi ATP:ADP dan NADH:NAD kerana kepekatan tinggi ATP dan NADH menunjukkan bahawa bekalan tenaga adalah tinggi terhadap sel. Ia juga dihalang oleh suksinil-KoA dan propionil-KoA yang menyerupai asetil-KoA, dan bertindak sebagai perencat berpersaingan kepada asetil-KoA dan perencat tidak berpersaingan kepada oksaloasetat.[11] Sitrat menghalang tindak balas, dan merupakan contoh perencatan produk. Perencatan sitrat sintase oleh analog asetil-KoA juga telah didokumenkan dengan baik dan telah digunakan untuk membuktikan kewujudan tapak aktif tunggal. Eksperimen ini telah mendedahkan bahawa tapak tunggal ini silih berganti antara dua bentuk, dan masing-masing mengambil bahagian dalam aktiviti ligase dan hidrolase.[8] Protein ini mungkin menggunakan model morfein bagi kawal atur alosterik.[12]
Rujukan[sunting | sunting sumber]
- ^ a b c GRCh38: Ensembl release 89: ENSG00000062485 - Ensembl, May 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b "Citrate synthase: structure, control, and mechanism". Annual Review of Biophysics and Biophysical Chemistry. 15: 97–117. 1986. doi:10.1146/annurev.bb.15.060186.000525. PMID 3013232.
- ^ a b "Twelve Weeks of Sprint Interval Training Improves Indices of Cardiometabolic Health Similar to Traditional Endurance Training despite a Five-Fold Lower Exercise Volume and Time Commitment". PLOS One. 11 (4): e0154075. 2016. Bibcode:2016PLoSO..1154075G. doi:10.1371/journal.pone.0154075. PMC 4846072. PMID 27115137.
- ^ "Superior mitochondrial adaptations in human skeletal muscle after interval compared to continuous single-leg cycling matched for total work". The Journal of Physiology. 595 (9): 2955–2968. 2017. doi:10.1113/JP272570. PMC 5407978. PMID 27396440.
- ^ "Citrate Synthase". Molecule of the Month. RCSB Protein Data Bank. 1 September 2007. doi:10.2210/rcsb_pdb/mom_2007_9.
- ^ a b "Evidence from inhibitor studies for conformational changes of citrate synthase". European Journal of Biochemistry. 120 (1): 155–60. Nov 1981. doi:10.1111/j.1432-1033.1981.tb05683.x. PMID 7308213.
- ^ "Enantioselective reduction of prochiral ketones by engineered bifunctional fusion proteins". Biotechnology and Applied Biochemistry. 56 (4): 131–140. August 2010. doi:10.1042/BA20100143. PMID 20590527.
- ^ Cox DL, Nelson MM (2005). Lehninger Principles of Biochemistry (ed. 4th). New York: W.H. Freeman. m/s. 608−9. ISBN 978-0-7167-4339-2.
- ^ "Inhibition of citrate synthase by succinyl-CoA and other metabolites". FEBS Letters. 18 (1): 35–38. October 1971. doi:10.1016/0014-5793(71)80400-3. PMID 11946076.
- ^ "Dynamic dissociating homo-oligomers and the control of protein function". Archives of Biochemistry and Biophysics. 519 (2): 131–43. Mar 2012. doi:10.1016/j.abb.2011.11.020. PMC 3298769. PMID 22182754.
Pautan luar[sunting | sunting sumber]
- Citrate+synthase dalam Tajuk Subjek Perubatan (MeSH) di Perpustakaan Perubatan Negara AS
- PDBe-KB memberikan pandangan kesemua maklumat struktur tersedia dalam PDB bagi sitrat sintase manusia, mitokondrion