Asid fluorosulfurik
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Asid sulfurofluoridik
| |||
| Nama IUPAC sistematik
Asid fluorosulfurik | |||
| Nama lain
Asid fluorosulfonik,
Asid fluorinsulfonik, Asid fluoridosulfonik, Sulfurik fluorohidrin, Epoksisulfonil fluorida | |||
| Pengecam | |||
Imej model 3D Jmol
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.029.227 | ||
| Nombor EC |
| ||
| MeSH | Fluorosulfonic+acid | ||
PubChem CID
|
|||
| Nombor RTECS |
| ||
| Nombor PBB | 1777 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| HFO3S | |||
| Jisim molar | 100.06 g·mol−1 | ||
| Rupa bentuk | Cecair jernih | ||
| Ketumpatan | 1.84 g cm-3 | ||
| Takat lebur | −87.5 °C; −125.4 °F; 185.7 K | ||
| Takat didih | 165.4 °C; 329.6 °F; 438.5 K | ||
| Keasidan (pKa) | -10 | ||
| Kebesan (pKb) | 24 | ||
| Struktur | |||
| Geometri koordinasi |
Tetragon (pejal) | ||
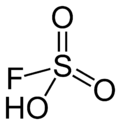
| Bentuk molekul | Tetrahedral (pejal) | ||
| Bahaya | |||
| Pengelasan EU | {{{value}}} | ||
| Frasa R | Templat:R20, R35 | ||
| Frasa S | S1/2, S26, S45 | ||
| Sebatian berkaitan | |||
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |||
| | |||
| Rujukan kotak info | |||
Asid fluorosulfurik (nama IUPAC: asid sulfurofluoridik) ialah sebatian tidak organik dengan formula HSO3F. Ia adalah sejenis superasid dan salah satu asid terkuat yang boleh didapati secara komersial. Formula HSO3F menekankan hubungannya dengan asid sulfurik, H2SO4; HSO3F ialah molekul tetrahedra.
Ciri-ciri kimia[sunting | sunting sumber]
Asid fluorosulfurik ialah cecair jernih yang mudah mengalir. Ia boleh dilarut dalam pelarut organik berkutub (seperti nitrobenzena, asid asetik dan etil asetat), tetapi tidak begitu larut dalam pelarut tidak berkutub seperti alkana. Disebabkan keasidannya yang tinggi, ia terlarut dalam hampie semua sebatian organik, malahan juga sebatian organik yang merupakan penerima proton yang lemah.[1] HSO3F menghidrolisis secara perlahan kepada HF dan asid sulfurik. Asid triflik (CF3SO3H) yang berkaitan mengekalkan keasidan tinggi HSO3F tetapi juga stabil dari segi hidrolisis. Pengionan sendiri asid fluorosulfurik juga berlaku:
- 2HSO3F
 [H2SO3F]+ + [SO3F]- K = 4.0 × 10-8 (pada 298 K)
[H2SO3F]+ + [SO3F]- K = 4.0 × 10-8 (pada 298 K)
Penghasilan[sunting | sunting sumber]
Asid fluorosulfurik disediakan melalui tindak balas HF dan SO3:
- SO3 + HF → HSO3F
Dengan kaedah lain, KHF2 atau CaF2 boleh dirawat dengan oleum pada suhu 250 °C. Setelah dibebaskan daripada HF menggunakan gas adi, HSO3F boleh disuling dalam perkakas kaca.[2]
Asid super[sunting | sunting sumber]
HSO3F ialah salah satu asid Brønsted ringkas terkuat yang diketahui, walaupun kajian terbaru berkenaan asid berasaskan karborana membawa kepada asid yang lebih kuat.[3] Ia mempunyai nilai H0 -15.1 berbanding dengan -12 bagi asid sulfurik. Gabungan HSO3F dan sejenis asid Lewis, antimoni pentafluorida hasilkan "asid ajaib" yang merupakan agen pemprotonan yang lebih kuat. Asid-asid ini berada dalam kategori "superasid", iaitu asid-asid yang lebih kuat daripada 100% asid sulfurik.
Kegunaan[sunting | sunting sumber]
HSO3F digunakan untuk menghasilkan semula campuran HF dan H2SO4 untuk punaran kaca plumbum.
HSO3F mengisomerkan alkana dan pengalkilan hidrokarbon dengan alkena,[4] walaupun tidak jelas sama ada kegunaan ini mempunyai kepentingan komersial. Ia juga boleh digunakan sebagai agen pemfluorinan dalam makmal.[2]
Keselamatan[sunting | sunting sumber]
Asid fluorosulfurik dianggap sangat bertoksik dan mengikis. Ia menghidrolisis untuk melepaskan HF. Penambahan air kepada HSO3F boleh jadi ganas, seperti penambahan air kepada asid sulfurik, tetapi prosesnya lebih ganas daripada penambahan air kepada asid sulfurik.
Lihat juga[sunting | sunting sumber]
Rujukan[sunting | sunting sumber]
- ^ Olah, G. A.; Prakash, G. K.; Wang, Q.; Li, X.-Y. (2001). "Fluorosulfuric Acid". Encyclopedia of Reagents for Synthesis. John Wiley & Sons. doi:10.1002/047084289X.rf014.CS1 maint: multiple names: authors list (link)
- ^ a b Cotton, F. A.; Wilkinson, G. (1980). Advanced Inorganic Chemistry (ed. 4th). New York: Wiley. m/s. 246. ISBN 0-471-02775-8.CS1 maint: multiple names: authors list (link)
- ^ Juhasz, M.; Hoffmann, S.; Stoyanov, E.; Kim, K. C.; Reed, C. A. (2004). "The Strongest Isolable Acid". Angewandte Chemie International Edition. 43 (40): 5352–5355. doi:10.1002/anie.200460005. PMID 15468064.CS1 maint: multiple names: authors list (link)
- ^ Olah, G.; Farooq, O.; Husain, A.; Ding, N.; Trivedi, N.; Olah, J. (1991). "Superacid HSO3F/HF-Catalyzed Butane Isomerisation". Catalysis Letters. 10 (3–4): 239–247. doi:10.1007/BF00772077.CS1 maint: multiple names: authors list (link)