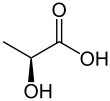
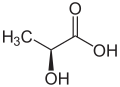
Asid laktik
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC pilihan
Asid 2-hidroksipropanoik 2-Hydroxypropanoic acid | |||
| Nama lain
Asid susu
Milk acid | |||
| Pengecam | |||
| |||
Imej model 3D Jmol
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.017 | ||
| Nombor E | E270 (bahan pengawet) | ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C3H6O3 | |||
| Jisim molar | 90.08 g·mol−1 | ||
| Takat lebur | 53°C | ||
| Takat didih | 122 °C (252 °F; 395 K) @ 15 mmHg | ||
| Larut campur[1] | |||
| Keasidan (pKa) | 3.86,[2] 15.1[3] | ||
| Termokimia | |||
Entalpi pembakaran
piawai (ΔcH⦵298) |
1361.9 kJ/mol, 325.5 kcal/mol, 15.1 kJ/g, 3.61 kcal/g | ||
| Farmakologi | |||
| Kod ATC | G01AD01 QP53AG02 (WHO) | ||
| Bahaya | |||
| Piktogram GHS | Templat:GHSp[4] | ||
| H315, H318[4] | |||
| P280, P305+351+338[4] | |||
| Sebatian berkaitan | |||
Anion lain
|
laktat | ||
asid karboksilik berkaitan
|
asid asetik asid glikolik asid propionik asid 3-hidroksipropanoik asid malonik asid butirik asid hidroksibutirik | ||
Sebatian berkaitan
|
1-propanol 2-propanol propionaldehid akrolein natrium laktat | ||
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |||
| Rujukan kotak info | |||
Asid laktik adalah sebatian organik dengan formula CH3CH(OH)COOH. Ia berwarna putih dan larut dalam air dalam bentuk pejalnya manakala cecair, kelihatan tidak berwarna. Ia dihasilkan secara semulajadi mahupun secara sintetik. Kedudukan kumpulan hidroksilnya yang bersebelahan dengan kumpulan karboksil menjadikan asid ini dikelaskan sebagai sebuah asid alfa-hidroksi (AHA). Bentuk bes konjugatnya, iaitu laktat, memainkan peranan dalam beberapa proses biokimia.
Bentuk larutannnya boleh mengionkan satu proton dari kumpulan karboksil, menghasilkan ion laktat CH3CH(OH)CO−
2. Dibandingkan dengan asid asetik, pKanya bernilai kurang 1 unit. Hal ini bermakna asid laktik dinyahprotonkan sepuluh kali lebih mudah daripada asid asetik. Tahap keasidan yang lebih tinggi ini disebabkan ikatan hidrogen dalam molekul antara kumpulan-kumpulan hidroksil dan karboksilat.
Sifat kimia
[sunting | sunting sumber]Asid laktik adalah larut dalam air, etanol, dietil eter serta pelarut-pelarut organik lain yang larut campur dengan air, tetapi tidak larut dalam benzena dan kloroform.
Nilai takat lebur asid laktik campuran ialah kira-kira 17 °C manakala asid laktik enantiomer tulen memiliki takat lebur pada nilai hampir 53 °C.[5]
Molekul
[sunting | sunting sumber]Asid laktik terdiri daripada dua buah molekul stereoisomer, iaitu asid (S)-laktik/asid L-(+)-laktik dan asid (R)-laktik/asid D-(-)-laktik. Campuran kedua-dua stereoisomer dipanggil sebagai asid DL-lakitik atau asid laktik rasem. Asid laktik rasem boleh dipisahkan melalui penghabluran semula dengan larutan dietil eter dan diisopropil eter.
-
Struktur molekul asid (S)-laktik.
-
Struktur molekul asid (R)-laktik.
Tindak balas kimia
[sunting | sunting sumber]Asid laktik terurai apabila bertindak balas dengan agen pengoksidaan. Dengan hidrogen iodida, asid laktik boleh diturunkan menjadi asid propionik.[6] Asid laktik boleh mengalami pendehidratan menjadi asid akrilik dan mengalami penghidrogenan menjadi propilena glikol.[7][8]
Sejarah
[sunting | sunting sumber]Asid laktik pertama kali diasingkan oleh ahli kimia Sweden, Carl Wilhelm Scheele pada 1780 daripada susu masam.[9] Penemuan ini memberi nama kepada asid ini; nama asid ini berasal daripada lac, perkataan Latin bagi susu. Pada 1808, Jöns Jacob Berzelius mendapati bahawa asid laktik boleh terhasil di otot.[10] Pada 1813, Henri Braconnot mendapati bahawa asid laktik dapat terhasil dalam proses penapaian.[9] Struktur molekul asid laktik dikemukakan oleh Johannes Wislicenus pada 1873.
Asid laktik mula dihasilkan secara industri pada 1881 di Amerika Syarikat, dan 1930 di Kesatuan Soviet.[11]
Kewujudan
[sunting | sunting sumber]Makanan
[sunting | sunting sumber]Asid laktik wujud dalam tenusu-tenusu masam seperti yogurt. Asid ini tidak biasanya wujud dalam buah, tetapi buah akebia dari Asia Timur mempunyai asid laktik yang merangkumi 2.12% jumlah asid organik.[12]
Penghasilan
[sunting | sunting sumber]Asid laktik dihasilkan secara industrinya melalui penapaian karbohidrat (gula, tepung) bakteria atau secara sintesis bahan kimia sintesis daripada asetaldehid yang boleh didapati daripada arang batu atau minyak mentah.[13] Sebanyak 70-90%[14] asid laktik ini yang dihasilkan datangnya daripada proses penapaian. Pengeluaran asid laktik rasemik yang terdiri daripada 1:1 campuran stereoisomer D dan L atau campuran dengan 99.9% asid (L)-laktik diperolehi melalui penapaian mikrob. Pengeluaran asid laktik L berskala industri boleh dilakukan namun lebih mencabar pelaksanaannya.
Secara penapaian
Produk tapaian susu diperolehi secara industri melalui penapaian susu atau whey oleh spesies Lactobacillius: Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus delbrueckii subsp. bulgaricus (Lactobacillus bulgaricus), Lactobacillus helveticus, Streptococcus salivarius subsp. thermophilus (Streptococcus thermophilus) dan Lactococcus lactis.
Hampir sebarang sumber karbohidrat sumber yang mengandungi gula C5/C6 boleh digunakan sebagai bahan mentah untuk industri pengeluaran laktat kimia yang digunakan untuk sintesis kimia. Sukrosa tulen, glukosa dari kanji dan jus bit gula mentah sering digunakan.[15] Bakteri yang menghasilkan asid laktik boleh dibahagikan kepada dua kelas: bakteri homofermentatif seperti Lactobacillus casei dan Lactococcus lactis yang menghasilkan dua mol laktat dari satu mol glukosa, dan spesies heterofermentatif yang mengeluarkan satu mol laktat dari satu mol glukosa serta karbon dioksida dan asid asetik/etanol.[16]
Secara campuran kimia
Asid laktik dihasilkan dalam industri melalui penambahan hidrogen sianida kepada asetaldehid serta hidrolisis yang berikutan untuk menghasilkan laktonitril. Hidrolisis dilakukan asid hidroklorik dengan amonium klorida sebagai produk sampingannya. Sintesis asid laktik rasemik juga boleh dilakukan daripada bahan mentah yang lain (vinil asetat, gliserol, dan sebagainya) melalui prosedur pemangkin.[17]
Kegunaan
[sunting | sunting sumber]Makanan
[sunting | sunting sumber]Asid laktik digunakan sebagai penambah makanan dengan nombor E ialah E270. Asid laktik dijadikan sebagai pengawet, perisa dan pematang makanan.[18] Asid laktik digunakan sebagai bahan nyahcemar dalam pemprosesan daging.[19] Dalam hal ini, asid laktik lazimnya dihasilkan daripada penapaian karbohidrat atau tindak balas kimia.[18]
Polimer
[sunting | sunting sumber]Dalam bidang industri polimer, asid laktik digunakan dalam penghasilan laktida yang boleh diproses melalui pempolimeran untuk menghasilkan asid poliaktik. Selain itu, asid laktik boleh diproses terus menjadi asid poliaktik melalui kondensasi.

Biokimia
[sunting | sunting sumber]
Dalam respirasi anaerob, lazimnya ketika senaman dan sukan berintensiti tinggi seperti lari pecut, badan manusia menghasilkan piruvat daripada glukosa melalui glikolisis seperti biasa, tetapi ditukarkan terus menjadi laktat melalui enzim laktat dehidrogenase, dan kadar penghasilan laktat adalah lebih tinggi daripada kadar proses laktat, menyebabkan kepekatan laktat meningkat. Dalam tindak balas ini, satu molekul NADH ditukar menjadi NAD+. Dalam respirasi ini, hanya asid (S)-laktik yang terhasil.
Laktat boleh ditukar semula menjadi piruvat lalu digunakan dalam kitaran Krebs. Selain itu, laktat boleh bertukar menjadi glukosa di hati melalui kitaran Cori.[20]
Selain itu, asid laktik dihasilkan oleh sel darah merah yang tidak memiliki mitokondrion serta terhasil akibat had dalam aktiviti enzim yang berlaku di gentian otot dengan muatan glikolisis tinggi.[20]
Asid laktik dan laktat ialah agonis endogen bagi protein reseptor asid hidroksikarboksilik 1, HCA1 yang menghalang lipolisis dalam sel lemak.[21][22]
Kepentingan klinikal
[sunting | sunting sumber]Laktat digunakan dalam larutan Ringer terlaktat yang lazim digunakan dalam resusitasi selepas kehilangan darah.
Ujian darah
[sunting | sunting sumber]Ujian kepekatan laktat dalam darah dilakukan untuk menentukan taraf homeostatis asid-bes dalam badan.
| Had atasan | Had bawahan | Unit | |
| Vena | 4.5[23] | 19.8[23] | mg/dL |
| 0.5[24] | 2.2[24] | mmol/L | |
| Arteri | 4.5[23] | 14.4[23] | mg/dL |
| 0.5[24] | 1.6[24] | mmol/L |
Masalah kesihatan
[sunting | sunting sumber]Asidosis laktat, sejenis asidosis metabolisme, ialah sejenis keadaan kesihatan apabila laktat terkumpul secara berlebihan di dalam badan. Penyakit ini sering berlaku akibat masalah kesihatan lain, faktor genetik atau pengambilan ubat-ubat tertentu. Selain manusia, asidosis ini juga boleh berlaku pada reptilia seperti buaya dan ruminan.[25][26]
Dalam pergigian, asid laktik yang dihasilkan oleh bakteria-bakteria melalui penapaian di mulut seperti Streptococcus mutans dan bakteria spesies Lactobacillus boleh membawa kepada kerosakan gigi.[27][28]
Keselamatan
[sunting | sunting sumber]Asid laktik ialah sejenis asid karboksilik organik dan secara umumnya selamat, tetapi mempunyai risiko merengsa sekiranya terkena mata atau kulit yang tercedera. Dos maut bagi asid ini terhadap tikus ialah 3.73 g/kg.[29]
Rujukan
[sunting | sunting sumber]- ^ Templat:GESTIS
- ^ Dawson, R. M. C. (1959). Data for Biochemical Research. Oxford: Clarendon Press. Unknown parameter
|displayauthors=ignored (bantuan) - ^ Silva, A. M.; Kong, X.; Hider, R. C. (2009). "Determination of the pKa value of the hydroxyl group in the alpha-hydroxycarboxylates citrate, malate and lactate by 13C NMR: implications for metal coordination in biological systems". Biometals. 22 (5): 771–778. doi:10.1007/s10534-009-9224-5. PMID 19288211.
- ^ a b c Sigma-Aldrich Co., DL-Lactic acid. Dicapai pada 2013-07-20.
- ^ Ullmann 2014, m/s. 1.
- ^ Knunyants, Ivan (1992). "Молочная кислота". Химическая энциклопедия (dalam bahasa Rusia). Moscow. m/s. 130–131. ISBN 5-85270-039-8.
- ^ Michael Aida, Taku (2009). "Dehydration of lactic acid to acrylic acid in high temperature water at high pressures". The Journal of Supercritical Fluids (dalam bahasa Inggeris). 50: 257–264. doi:10.1016/j.supflu.2009.06.006 – melalui Elsevier Science Direct.
- ^ Jang, Hyuk (2013). "Hydrogenation of lactic acid to propylene glycol over a carbon-supported ruthenium catalyst". Journal of Molecular Catalysis A: Chemical (dalam bahasa Inggeris). 380: 57–60. doi:10.1016/j.molcata.2013.09.006 – melalui Elsevier Science Direct.
- ^ a b Surinder P. Chahal, John N. Starr: Lactic Acids. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2012, DOI:10.1002/14356007.a15_097.pub2.
- ^ Roth, Stephen M. "Why does lactic acid build up in muscles? And why does it cause soreness?". Scientific American (dalam bahasa Inggeris). Dicapai pada 23 Januari 2006. Unknown parameter
|name-list-format=ignored (bantuan) - ^ Butkevich, Vladimir Stepanovich (1932). Лимонная кислота, как продукт технического производства (dalam bahasa Rusia). Snabtekhizdat.
- ^ Li Li, Xiaohong Yao, Caihong Zhong and Xuzhong Chen (January 2010). "Akebia: A Potential New Fruit Crop in China". HortScience. 45 (1): 4–10. doi:10.21273/HORTSCI.45.1.4.CS1 maint: multiple names: authors list (link)
- ^ H. Benninga (1990): "A History of Lactic Acid Making: A Chapter in the History of Biotechnology". Volume 11 of Chemists and Chemistry. Springer, ISBN 0792306252, 9780792306252
- ^ Endres, Hans-Josef (2009). Technische Biopolymere. München: Hanser-Verlag. m/s. 103. ISBN 978-3-446-41683-3.
- ^ Groot, Wim; van Krieken, Jan; Slekersl, Olav; de Vos, Sicco. Auras, Rafael; Lim, Long-Tak; Selke, Susan E. M.; Tsuji, Hideto (penyunting). Chemistry and production of lactic acid, lactide and poly(lactic acid) in Poly(Lactic acid). Hoboken: Wiley. m/s. 3. ISBN 978-0-470-29366-9.
- ^ König, Helmut; Fröhlich, Jürgen (2009). Lactic acid bacteria in Biology of Microorganisms on Grapes, in Must and in Wine. Springer-Verlag. m/s. 3. ISBN 978-3-540-85462-3.
- ^ Shuklov, Ivan A.; Dubrovina, Natalia V.; Kühlein, Klaus; Börner, Armin (2016). "Chemo-Catalyzed Pathways to Lactic Acid and Lactates". Advanced Synthesis and Catalysis. 358 (24): 3910–3931. doi:10.1002/adsc.201600768.
- ^ a b "Listing of Specific Substances Affirmed as GRAS:Lactic Acid" (dalam bahasa Inggeris). US FDA. Dicapai pada 20 Mei 2013.
- ^ "Purac Carcass Applications" (dalam bahasa Inggeris). Purac. Dicapai pada 20 Mei 2013.
- ^ a b McArdle WD, Katch FI, Katch VL (2010). Exercise Physiology: Energy, Nutrition, and Human Performance. Wolters Kluwer/Lippincott Williams & Wilkins Health. ISBN 978-0-683-05731-7.
- ^ Offermanns S, Colletti SL, Lovenberg TW, Semple G, Wise A, IJzerman AP (June 2011). "International Union of Basic and Clinical Pharmacology. LXXXII: Nomenclature and Classification of Hydroxy-carboxylic Acid Receptors (GPR81, GPR109A, and GPR109B)". Pharmacological Reviews. 63 (2): 269–90. doi:10.1124/pr.110.003301. PMID 21454438.
- ^ S Offermanns, SL Colletti, AP IJzerman, TW Lovenberg, G Semple, A Wise, MG Waters. "Hydroxycarboxylic acid receptors". IUPHAR/BPS Guide to Pharmacology. International Union of Basic and Clinical Pharmacology. Dicapai pada 13 July 2018.CS1 maint: multiple names: authors list (link)
- ^ a b c d Blood Test Results – Normal Ranges Diarkibkan 2 November 2012 di Wayback Machine Bloodbook.Com
- ^ a b c d Derived from mass values using molar mass of 90.08 g/mol
- ^ [1] Diarkibkan 2009-05-02 di Wayback Machine. Accessed 31 January 2009.
- ^ Kimberling, C. V. 1988. Jensen and Swift's diseases of sheep. 3rd Ed. Lea & Fibiger, Philadelphia. 394 pp.
- ^ "Dental Researchers to Mouth Bacteria: Don't Get too Attached". 2010-12-08.
- ^ Badet C, Thebaud NB (2008). "Ecology of lactobacilli in the oral cavity: a review of literature". The Open Microbiology Journal. 2: 38–48. doi:10.2174/1874285800802010038. PMC 2593047. PMID 19088910.
- ^ Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2014. m/s. 7. doi:10.1002/14356007.a15_097.pub3.
Pautan luar
[sunting | sunting sumber] Kategori berkenaan asid laktik di Wikimedia Commons
Kategori berkenaan asid laktik di Wikimedia Commons- (Inggeris) Lactic Acid: Information and Resources
- (Inggeris) Lactic Acid Is Not Muscles' Foe, It's Fuel