Fruktosa 1,6-bisfosfatase
| Fruktosa 1,6-bisfosfatase 1 | |||||||
|---|---|---|---|---|---|---|---|
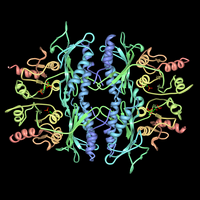 Fruktosa 1,6-bisfosfatase sebagai kompleks dengan fruktosa 1,6-bisfosfat. Terbitan PDB 3FBP. | |||||||
| Pengenal pasti | |||||||
| Simbol | FBP1 | ||||||
| Simbol alternatif | FBP | ||||||
| Gen NCBI | 2203 | ||||||
| HGNC | 3606 | ||||||
| OMIM | 229700 | ||||||
| RefSeq | NM_000507 | ||||||
| UniProt | P09467 | ||||||
| Other data | |||||||
| Nombor EC | 3.1.3.11 | ||||||
| Lokus | Kromosom 9 q22.3 | ||||||
| |||||||
| Fruktosa 1,6-bisfosfatase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktur hablur fruktosa 1,6-bisfosfatase hati arnab; resolusi 2.3 Angstrom | |||||||||
| Pengenal pasti | |||||||||
| Simbol | FBPase | ||||||||
| Pfam | PF00316 | ||||||||
| Klan Pfam | CL0171 | ||||||||
| InterPro | IPR000146 | ||||||||
| PROSITE | PDOC00114 | ||||||||
| SCOP | 1frp | ||||||||
| SUPERFAMILY | 1frp | ||||||||
| |||||||||
| Fruktosa 1,6-bisfosfatase firmikut | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Pengenal pasti | |||||||||
| Simbol | FBPase_2 | ||||||||
| Pfam | PF06874 | ||||||||
| Klan Pfam | CL0163 | ||||||||
| InterPro | IPR009164 | ||||||||
| |||||||||
| Fruktosa 1,6-bisfosfatase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktur hablur fruktosa 1,6-bisfosfatase | |||||||||
| Pengenal pasti | |||||||||
| Simbol | FBPase_3 | ||||||||
| Pfam | PF01950 | ||||||||
| InterPro | IPR002803 | ||||||||
| SCOP | 1umg | ||||||||
| SUPERFAMILY | 1umg | ||||||||
| |||||||||
Enzim fruktosa bifosfatase (EC 3.1.3.11; nama sistematik D-fruktosa-1,6-bifosfat 1-fosfohidrolase) memangkinkan penukaran fruktosa-1,6-bifosfat kepada fruktosa 6-fosfat dalam glukoneogenesis dan kitaran Calvin, kedua-duanya laluan anabolik:[1][2]
- D-fruktosa 1,6-bifosfat + H2O =D-fruktosa 6-fosfat + fosfat
Fosfofruktokinase (EC 2.7.1.11) memangkinkan penukaran fruktosa 6-fosfat kepada fruktosa-1,6-bifosfat yang terbalik, tetapi ini bukan sahaja tindak balas terbalik kerana substrat bersama adalah berbeza (dan oleh itu keperluan termodinamik tidak dilanggar). Kedua-dua enzim itu masing-masing memangkinkan penukaran dalam satu arah sahaja, dan dikawal oleh metabolit seperti fruktosa 2,6-bisfosfat supaya aktiviti tinggi salah satu daripadanya disertai dengan aktiviti rendah yang lain. Lebih khusus lagi, fruktosa 2,6-bisfosfat secara alosterik menghalang fruktosa 1,6-bisfosfatase, tetapi mengaktifkan fosfofruktokinase I. Fruktosa 1,6-bisfosfatase terlibat dalam banyak laluan metabolik yang berbeza, dan ditemui dalam kebanyakan organisma. FBPase memerlukan ion logam untuk pemangkinan (Mg2+ dan Mn2+ diutamakan) dan enzim dihalang dengan kuat oleh Li+.
Struktur[sunting | sunting sumber]
Lipatan fruktosa-1,6-bisfosfatase daripada khinzir diperhatikan adalah sama dengan inositol-1-fosfatase (IMPase).[3] Inositol polifosfat 1-fosfatase (IPPase), IMPase dan FBPase berkongsi motif jujukan (Asp-Pro-Ile/Leu-Asp-Gly/Ser-Thr/Ser) yang telah ditunjukkan untuk mengikat ion logam dan mengambil bahagian dalam pemangkinan. Motif ini juga terdapat dalam homolog IMPase kulat, bakteria dan yis yang berkaitan jauh. Ada cadangan bahawa protein ini mentakrifkan keluarga purba yang dipelihara secara struktur yang terlibat dalam laluan metabolisme yang pelbagai, termasuk isyarat inositol, glukoneogenesis, asimilasi sulfat dan mungkin metabolisme kuinon.[4]
Taburan spesies[sunting | sunting sumber]
Tiga kumpulan FBPase yang berbeza telah dikenal pasti dalam eukariot dan bakteria (FBPase I-III).[5] Tiada satu pun daripada kumpulan ini telah ditemui dalam arkea setakat ini walaupun kumpulan FBPase baharu (FBPase IV) yang juga menunjukkan aktiviti inositol monofosfatase baru-baru ini telah dikenal pasti dalam arkea.[6]
Satu kumpulan baru FBPase (FBPase V) ditemui dalam arkea termofil dan bakteria hipertermofil Aquifex aeolicus.[7] Ahli berciri kumpulan ini menunjukkan kekhususan substrat yang ketat terhadap FBP, dan dicadangkan untuk menjadi FBPase sebenar dalam organisma ini.[7][8] Kajian struktur mencadangkan bahawa FBPase V mempunyai lipatan baru fosfatase gula, membentuk sandwic alfa-beta-beta-alfa empat lapisan, tidak seperti susunan alfa-beta-alfa-beta-alfa lima lapis yang lebih lazim.[8] Susunan rantai sisi pemangkin dan ligan logam didapati konsisten dengan mekanisme pemangkinan berbantukan ion tiga logam yang dicadangkan untuk FBPase lain.
Fruktosa 1,6-bisfosfatase yang terdapat dalam Bacillota (bakteria positif Gram GC rendah) tidak menunjukkan sebarang persamaan jujukan yang ketara dengan enzim daripada organisma lain. Enzim Bacillus subtilis dihalang oleh AMP, walaupun ini boleh diatasi oleh fosfoenolpiruvat, dan bergantung kepada Mn(2+).[9][10] Mutan yang kekurangan enzim ini nampaknya masih boleh tumbuh pada substrat pertumbuhan glukoneogenesis seperti malat dan gliserol.
Hibernasi dan penyesuaian sejuk[sunting | sunting sumber]
Fruktosa 1,6-bisfosfatase juga memainkan peranan penting dalam hibernasi yang memerlukan pengawalan ketat proses metabolik untuk memudahkan permulaan hibernasi, penyelenggaraan, rangsangan daripada hibernasi, dan pelarasan untuk membolehkan kependaman jangka panjang.[11][12][13] Semasa hibernasi, kadar metabolisme haiwan mungkin berkurangan kepada sekitar 1/25 daripada kadar metabolisme rehat eutermiknya.[12][13][14] FBPase diubah suai dalam hibernasi haiwan untuk menjadi lebih sensitif suhu berbanding haiwan eutermik.[11][13][14] FBPase dalam hati kelawar berhibernasi menunjukkan penurunan 75% Km bagi substratnya dalam 5 °C berbanding 37 °C.[11] Walau bagaimanapun, dalam kelawar eutermik, penurunan ini hanya sebanyak 25%, menunjukkan perbezaan sensitiviti suhu antara kelawar hibernasi dan eutermik.[11] Apabila kepekaan terhadap perencat alosterik seperti AMP, ADP, fosfat tak organik dan fruktosa-2,6-bisfosfat diperiksa, FBPase daripada kelawar berhibernasi adalah lebih sensitif kepada perencat dalam suhu rendah berbanding kelawar eutermik.[11][15][16]
Semasa hibernasi, pernafasan juga berkurangan secara mendadak, mengakibatkan keadaan anoksia relatif dalam tisu. Keadaan anoksia menghalang glukoneogenesis, dan oleh itu FBPase, sambil merangsang glikolisis, dan ini adalah satu lagi sebab untuk mengurangkan aktiviti FBPase dalam haiwan hibernasi.[17] Substrat FBPase, fruktosa 1,6-bifosfat, juga telah ditunjukkan untuk mengaktifkan piruvat kinase dalam glikolisis, menghubungkan peningkatan glikolisis kepada penurunan glukoneogenesis apabila aktiviti FBPase berkurangan semasa hibernasi.[13]
Selain hibernasi, terdapat bukti bahawa aktiviti FBPase berbeza dengan ketara antara musim panas dan sejuk walaupun dalam kalangan haiwan yang tidak berhibernasi.[18] Dalam arnab yang terdedah kepada suhu sejuk, aktiviti FBPase berkurangan sepanjang tempoh pendedahan sejuk, dan meningkat apabila suhu menjadi lebih panas semula.[18] Mekanisme perencatan FBPase ini dianggap sebagai pencernaan FBPase oleh protease lisosom yang dikeluarkan pada tahap yang lebih tinggi semasa tempoh yang lebih sejuk.[18] Perencatan FBPase melalui pencernaan proteolisis mengurangkan glukoneogenesis berbanding glikolisis semasa tempoh sejuk, sama seperti hibernasi.[18]
Fruktosa 1,6-bifosfat aldolase ialah satu lagi enzim yang bergantung kepada suhu yang memainkan peranan penting dalam pengawalan glikolisis dan glukoneogenesis semasa hibernasi.[14] Peranan utamanya adalah dalam glikolisis dan bukannya glukoneogenesis, tetapi substratnya adalah sama dengan FBPase, jadi aktivitinya mempengaruhi FBPase dalam glukoneogenesis. Aldolase menunjukkan perubahan yang serupa dalam aktiviti terhadap FBPase pada suhu yang lebih sejuk, seperti peralihan ke atas dalam pH optimum pada suhu yang lebih sejuk. Penyesuaian ini membolehkan enzim seperti FBPase dan fruktosa-1,6-bifosfat aldolase menjejaki perubahan pH intrasel dalam haiwan berhibernasi, dan memadankan julat aktiviti mereka dengan anjakan ini.[14] Aldolase juga melengkapkan aktiviti FBPase dalam keadaan anoksia (dibincangkan di atas) dengan meningkatkan pengeluaran glikolisis, manakala perencatan FBPase mengurangkan aktiviti glukoneogenesis.[19]
Dalam diabetes[sunting | sunting sumber]
Fruktosa 1,6-bisfosfatase juga merupakan pemain utama dalam merawat diabetes jenis 2. Dalam penyakit ini, hiperglisemia menyebabkan banyak masalah yang serius, dan rawatan sering menumpukan pada menurunkan paras gula dalam darah.[20][21][22] Glukoneogenesis dalam hati adalah punca utama pengeluaran glukosa yang berlebihan dalam pesakit ini, dan oleh itu, perencatan glukoneogenesis menjadi cara yang munasabah untuk merawat diabetes jenis 2. FBPase ialah enzim yang baik untuk disasarkan dalam laluan glukoneogenesis kerana ia merupakan langkah pengehad kadar, dan mengawal penggabungan ketiga-tiga substrat karbon ke dalam glukosa, tetapi tidak terlibat dalam pecahan glikogen, dan dikeluarkan daripada langkah mitokondrion dalam laluan.[20][21][22] Ini bermakna mengubah aktivitinya boleh memberi kesan besar terhadap glukoneogenesis sambil mengurangkan risiko hipoglisemia dan kesan sampingan lain yang berpotensi daripada mengubah enzim lain dalam glukoneogenesis.[20][21]
Calon ubat telah dibangunkan yang meniru aktiviti perencatan AMP terhadap FBPase.[20][22] Usaha telah dibuat untuk meniru kesan perencatan alosterik AMP sambil menjadikan ubat itu berbeza dari segi struktur yang mungkin.[22] Perencat FBPase generasi kedua kini telah dibangunkan, dan mempunyai keputusan yang baik dalam ujian klinikal dengan mamalia bukan manusia dan serta manusia.[20][23]
Rujukan[sunting | sunting sumber]
- ^ "Amino acid sequence of spinach chloroplast fructose-1,6-bisphosphatase". Archives of Biochemistry and Biophysics. 279 (1): 151–7. May 1990. doi:10.1016/0003-9861(90)90475-E. PMID 2159755.
- ^ "Amino acid sequence homology among fructose-1,6-bisphosphatases". Biochemical and Biophysical Research Communications. 135 (2): 374–81. Mar 1986. doi:10.1016/0006-291X(86)90005-7. PMID 3008716.
- ^ "Structural similarities between fructose-1,6-bisphosphatase and inositol monophosphatase". Biochemical and Biophysical Research Communications. 190 (3): 1080–3. Feb 1993. doi:10.1006/bbrc.1993.1159. PMID 8382485.
- ^ "Definition of a metal-dependent/Li+-inhibited phosphomonoesterase protein family based upon a conserved three-dimensional core structure". Proceedings of the National Academy of Sciences of the United States of America. 92 (11): 5149–53. May 1995. Bibcode:1995PNAS...92.5149Y. doi:10.1073/pnas.92.11.5149. PMC 41866. PMID 7761465.
- ^ "Purification and characterization of glpX-encoded fructose 1, 6-bisphosphatase, a new enzyme of the glycerol 3-phosphate regulon of Escherichia coli". Journal of Bacteriology. 182 (19): 5624–7. Oct 2000. doi:10.1128/jb.182.19.5624-5627.2000. PMC 111013. PMID 10986273.
- ^ "MJ0109 is an enzyme that is both an inositol monophosphatase and the 'missing' archaeal fructose-1,6-bisphosphatase". Nature Structural Biology. 7 (11): 1046–50. Nov 2000. doi:10.1038/80968. PMID 11062561.
- ^ a b "A novel candidate for the true fructose-1,6-bisphosphatase in archaea". The Journal of Biological Chemistry. 277 (34): 30649–55. Aug 2002. doi:10.1074/jbc.M202868200. PMID 12065581.
- ^ a b "The first crystal structure of the novel class of fructose-1,6-bisphosphatase present in thermophilic archaea". Structure. 12 (6): 949–59. Jun 2004. doi:10.1016/j.str.2004.03.026. PMID 15274916.
- ^ "Purification and properties of fructose-1,6-bisphosphatase of Bacillus subtilis". The Journal of Biological Chemistry. 254 (12): 5340–9. Jun 1979. doi:10.1016/S0021-9258(18)50601-3. PMID 221467.
- ^ "Identification and expression of the Bacillus subtilis fructose-1, 6-bisphosphatase gene (fbp)". Journal of Bacteriology. 180 (16): 4309–13. Aug 1998. doi:10.1128/JB.180.16.4309-4313.1998. PMC 107433. PMID 9696785.
- ^ a b c d e "Metabolic regulation in mammalian hibernation: enzyme and protein adaptations". Comparative Biochemistry and Physiology A. 118 (4): 1115–24. December 1997. doi:10.1016/S0300-9629(97)00238-7. PMID 9505421.
- ^ a b "Natural hypometabolism during hibernation and daily torpor in mammals". Respiratory Physiology & Neurobiology. 141 (3): 317–29. August 2004. doi:10.1016/j.resp.2004.03.014. PMID 15288602.
- ^ a b c d Brooks, Stephen P.J.; Storey, Kenneth B. (January 1992). "Mechanisms of glycolytic control during hibernation in the ground squirrel Spermophilus lateralis". Journal of Comparative Physiology B. 162 (1): 23–28. doi:10.1007/BF00257932.
- ^ a b c d "Purification and characterization of fructose bisphosphate aldolase from the ground squirrel, Spermophilus lateralis: enzyme role in mammalian hibernation". Archives of Biochemistry and Biophysics. 408 (2): 279–85. December 2002. doi:10.1016/S0003-9861(02)00579-9. PMID 12464282.
- ^ "The effect of fructose 2,6-bisphosphate and AMP on the activity of phosphorylated and unphosphorylated fructose-1,6-bisphosphatase from rat liver". FEBS Letters. 167 (2): 203–9. February 1984. doi:10.1016/0014-5793(84)80127-1. PMID 6321241.
- ^ "Allosteric Inhibition of Rat Liver Fructose 1,6-Diphosphatase by Adenosine 5'-Monophosphate". The Journal of Biological Chemistry. 240 (2): 651–62. February 1965. doi:10.1016/S0021-9258(17)45224-0. PMID 14275118.
- ^ "Control of glycolysis and gluconeogenesis in rat kidney cortex slices". The Biochemical Journal. 104 (1): 300–5. July 1967. doi:10.1042/bj1040300. PMC 1270577. PMID 4292000.
- ^ a b c d Fischer EH, Krebs EG, Neurath H, Stadtman ER, penyunting (1974). Metabolic Interconversion of Enzymes 1973 Third International Symposium held in Seattle, June 5-8, 1973. Berlin, Heidelberg: Springer. ISBN 978-3-642-80817-3.
- ^ "Characterization of fructose-1,6-bisphosphate aldolase during anoxia in the tolerant turtle, Trachemys scripta elegans: an assessment of enzyme activity, expression and structure". PLOS ONE. 8 (7): e68830. 2013. Bibcode:2013PLoSO...868830D. doi:10.1371/journal.pone.0068830. PMC 3715522. PMID 23874782.
- ^ a b c d e Dang Q, Van Poelje PD, Erion MD (2012). "Chapter 11: The Discovery and Development of MB07803, a Second-Generation Fructose-1,6-bisphosphatase Inhibitor with Improved Pharmacokinetic Properties, as a Potential Treatment of Type 2 Diabetes". Dalam Jones RM (penyunting). New Therapeutic Strategies for Type 2 Diabetes: Small Molecule Approaches. Cambridge: The Royal Society of Chemistry. doi:10.1039/9781849735322-00306. ISBN 978-1-84973-414-1.
- ^ a b c Arch JR (2011). "Thermogenesis and Related Metabolic Targets in Anti-Diabetic Therapy". Dalam Schwanstecher M (penyunting). Diabetes - Perspectives in Drug Therapy (ed. 1st). Berlin, Heidelberg: Springer. m/s. 203. ISBN 978-3-642-17214-4.
- ^ a b c d "Inhibition of fructose 1,6-bisphosphatase reduces excessive endogenous glucose production and attenuates hyperglycemia in Zucker diabetic fatty rats". Diabetes. 55 (6): 1747–54. June 2006. doi:10.2337/db05-1443. PMID 16731838.
- ^ "Fructose-1,6-bisphosphatase inhibitors: A new valid approach for management of type 2 diabetes mellitus". European Journal of Medicinal Chemistry. 141: 473–505. December 2017. doi:10.1016/j.ejmech.2017.09.029. PMID 29055870.
Pautan luar[sunting | sunting sumber]
- Fructose-1,6-Biphosphatase dalam Tajuk Subjek Perubatan (MeSH) di Perpustakaan Perubatan Negara AS