Penyakit Alzheimer
| Penyakit Alzheimer | |
|---|---|
Nama lain | Penyakit Alzheimer, Alzheimer |
 | |
| Gambaran perbandingan otak berumur normal (kiri) dan otak seseorang dengan Alzheimer (kanan). Ciri-ciri yang memisahkan keduanya ditunjukkan. | |
| Sebutan |
|
| Pengkhususan | Neurologi |
| Gejala | Kesukaran untuk mengingati peristiwa baru-baru ini, masalah dengan bahasa, disorientasi, perubahan emosis[1][2] |
Permulaan biasa | Lebih 65 tahun[3] |
| Tempoh | Jangka panjang[2] |
| Punca | Kurang difahami[1] |
| Genetik, kecederaan kepala, kemurungan, hipertensi[1][4] | |
| Berdasarkan simptom dan ujian kognitif setelah menolak kemungkinan penyebab lain[5] | |
| Penuaan normal[1] | |
Rawatan perubatan | Perencat asetilkolinesterase, reseptopr antagonis NMDA (kesan kecil)[6] |
| Prognosis | Jangka hayat 3-9 tahun[7] |
| Kekerapan | 29.8 juta (2015)[8] |
| Kematian | 1.9 juta untuk semua penyakit demensia (2015)[9] |
| sunting | |
Penyakit Alzheimer, juga dikenali sebagai Alzheimer (atau sebutannya alz-zhai-me), ialah penyakit neurodegeneratif yang biasanya bermula secara perlahan-lahan dan memburuk secara berperingkat dari masa ke masa.[2] Ini adalah penyebab 60-70% kes demensia.[2] Gejala awal yang paling biasa adalah kesukaran untuk mengingati kejadian baru-baru ini. Ketika penyakit ini berkembang, gejala dapat meliputi masalah dengan bahasa, disorientasi (termasuk mudah hilang), perubahan mood, kehilangan motivasi, pengabaian diri sendiri, dan masalah tingkah laku.[1][2] Apabila keadaan seseorang merosot, mereka sering mengelak diri dari keluarga dan masyarakat.[1] Secara beransur-ansur, fungsi tubuh hilang, akhirnya menyebabkan kematian.[10] Walaupun kelajuan perkembangannya boleh berbeza-beza, jangka hayat biasa setelah diagnosis adalah tiga hingga sembilan tahun.[7][11]
Punca penyakit Alzheimer kurang difahami.[1] Terdapat banyak faktor persekitaran dan genetik yang menyumbang kepada perkembangannya. Faktor risiko genetik yang paling kuat ialah dari alel APOE.[12][13] Faktor risiko lain termasuk sejarah kecederaan kepala, kemurungan klinikal, dan tekanan darah tinggi.[1] Proses penyakit ini banyak dikaitkan dengan plak, kekusut neurofibrilari dan kehilangan sambungan neuron di otak manusia.[10] Diagnosis yang mungkin berdasarkan sejarah penyakit dan ujian kognitif dengan pengimejan perubatan dan ujian darah untuk memastikan kemungkinan penyebab lain.[5] Gejala awal sering disalah anggap sebagai penuaan normal.[1] Pemeriksaan tisu otak diperlukan untuk diagnosis yang pasti tetapi ini hanya boleh dilakukan selepas kematian.[10] Nutrisi yang baik, aktiviti fizikal dan penglibatan dalam kemasyarakatan (sosial) diketahui bermanfaat secara umum dalam penuaan, dan ini dapat membantu mengurangkan risiko penurunan kognitif dan ujian klinikal Alzheimer pada 2019 sedang dijalankan untuk melihat kemungkinan ini.[10] Tidak ada ubat atau makanan tambahan yang terbukti dapat mengurangkan risiko.[14]
Tidak ada rawatan yang menghentikan atau membalikkan perkembangannya, walaupun ada yang sementara dapat memperbaiki simptom.[2] Individu yang terjejas semakin bergantung pada orang lain untuk meminta bantuan, sering kali membebankan pengasuh.[15] Tekanan tersebut boleh merangkumi elemen sosial, psikologi, fizikal, dan ekonomi.[15] Program senaman mungkin bermanfaat sehubungan dengan aktiviti kehidupan seharian dan berpotensi meningkatkan hasil.[16] Masalah tingkah laku atau psikosis akibat demensia sering dirawat dengan antipsikotik, tetapi ini biasanya tidak disarankan, kerana terdapat sedikit manfaat dan peningkatan risiko kematian awal.[17][18]
Sejak tahun 2015, terdapat kira-kira 29.8 juta orang di seluruh dunia menghidap Alzheimer[8][8] dengan kira-kira 50 juta dari semua bentuk demensia pada tahun 2020.[2] Selalunya ia bermula pada orang yang berusia lebih dari 65 tahun, walaupun sehingga 10 peratus kes adalah kes adalah peringkat awal Alzheimer mempengaruhi mereka yang berumur 30-an hingga 60-an.[10][3] Ia mempengaruhi kira-kira 6% orang yang berumur 65 tahun ke atas.[1] Pada tahun 2015, semua jenis demensia mengakibatkan kira-kira 1.9 juta kematian.[9] Penyakit ini dinamakan sempena nama ahli psikiatri dan patologi Jerman Alois Alzheimer, yang pertama kali menggambarkan penyakit ini pada tahun 1906.[19] Di negara maju, Alzheimer adalah salah satu penyakit yang paling mahal dari segi kewangan.[20][21]
Tanda dan gejala[sunting | sunting sumber]
- Kesan penuaan pada ingatan tetapi bukan Alzheimer
- Kelupaan perkara sekali-sekala
- Kadang-kadang salah meletakkan barang
- Kehilangan memori jangka pendek minor
- Tidak ingat perincian yang tepat
- Alzheimer peringkat awal
- Tidak mengingati episod pelupa
- Melupakan nama keluarga atau rakan
- Perubahan hanya dapat diperhatikan oleh rakan atau saudara terdekat
- Beberapa kekeliruan dalam situasi di luar yang biasa
- Alzheimer peringkat pertengahan
- Kesukaran yang lebih besar untuk mengingat maklumat yang baru dipelajari
- Memperdalam kekeliruan dalam banyak keadaan
- Masalah dengan tidur
- Masalah menentukan lokasi mereka
- Alzheimer peringkat akhir
- Keupayaan berfikir yang lemah
- Masalah bercakap
- Mengulangi perbualan yang sama
- Lebih kasar, cemas, atau paranoid
Penyakit ini dibahagikan kepada empat peringkat, dengan corak progresif gangguan kognitif dan fungsi.
Pra-demensia[sunting | sunting sumber]
Gejala pertama sering disalah anggap sebagai penuaan atau tekanan.[23] Ujian neuropsikologi terperinci dapat mendedahkan kesukaran kognitif ringan sehingga lapan tahun sebelum seseorang memenuhi kriteria klinikal untuk diagnosis Alzheimer.[24] Gejala awal ini boleh mempengaruhi aktiviti kehidupan seharian yang paling kompleks.[25] Defisit yang paling ketara adalah kehilangan ingatan jangka pendek yang muncul iaitu kesukaran untuk mengingat fakta yang baru dipelajari dan ketidakupayaan untuk memperoleh maklumat baru.[24][26]
Masalah sinis dengan fungsi eksekutif perhatian, perancangan, fleksibiliti, dan pemikiran abstrak, atau gangguan dalam memori semantik (ingatan makna, dan hubungan konsep) juga boleh menjadi gejala pada peringkat awal Alzheimer.[24] Apati dapat dilihat pada peringkat ini, dan tetap menjadi gejala neuropsikiatrik yang paling berterusan dalam penyakit ini.[27] Gejala kemurungan, kerengsaan dan kesedaran yang kurang mengenai kesukaran ingatan yang sinis juga biasa berlaku.[28] Tahap praklinikal penyakit ini juga disebut gangguan kognitif ringan (MCI).[26] Ini sering didapati sebagai tahap peralihan antara penuaan normal dan demensia. MCI dapat muncul dengan berbagai gejala, dan ketika kehilangan ingatan adalah gejala yang dominan, ia disebut "amnestik MCI" dan sering dilihat sebagai tahap prodromal penyakit Alzheimer.[29]
Awal[sunting | sunting sumber]
Individu dengan Alzheimer mengalami kemerosotan dalam pembelajaran dan ingatan. Dalam peratusan yang kecil, kesukaran dengan bahasa, fungsi eksekutif, persepsi (agnosia), atau pelaksanaan pergerakan (apraksia) lebih menonjol daripada masalah ingatan.[30] Penyakit Alzheimer tidak mempengaruhi semua kapasiti memori secara sama. Kenangan lama mengenai kehidupan seseorang (ingatan episodik), fakta yang dipelajari (ingatan semantik), dan ingatan tersirat (memori tubuh mengenai cara melakukan sesuatu, seperti menggunakan garpu untuk makan atau cara minum menggunakan gelas) terjejas ke tahap yang lebih rendah daripada fakta baru atau kenangan.[31][32]
Masalah bahasa terutamanya dicirikan oleh perbendaharaan kata yang menyusut dan penurunan kefasihan kata, yang menyebabkan kemerosotan bahasa lisan dan tulisan secara umum.[30][33] Pada peringkat ini, individu yang menghidap Alzheimer biasanya mampu menuturkan idea asas yang terhad.[30][33][34] Semasa melakukan tugas motor halus seperti menulis, menggambar, atau berpakaian, kesukaran koordinasi pergerakan dan perancangan tertentu (apraksia) mungkin ada, tetapi biasanya tidak disedari.[30] Semasa penyakit ini berkembang, individu dengan Alzheimer sering dapat secara terus melakukan banyak tugas secara mandiri, tetapi mungkin memerlukan bantuan atau pengawasan dengan banyak aktiviti tuntutan kognitif.[30]
Sederhana[sunting | sunting sumber]
Kemerosotan progresif akhirnya menghalang kemandirian, dengan subjek tidak dapat melakukan aktiviti kehidupan seharian yang paling biasa.[30] Kesukaran bercakap menjadi jelas kerana ketidakmampuan mengingat kosa kata, yang menyebabkan penggantian kata (paraphasias) sering salah. Kemahiran membaca dan menulis juga semakin hilang.[30][34] Urutan motor yang kompleks menjadi kurang terkoordinasi seiring berjalannya waktu dan Alzheimer semakin meningkat, sehingga risiko jatuh meningkat.[30] Selama fasa ini, masalah ingatan bertambah buruk, dan individu tersebut mungkin gagal mengenali saudara terdekat.[30] Ingatan jangka panjang, yang sebelumnya utuh, menjadi lemah.[30]
Perubahan tingkah laku dan neuropsikiatrik menjadi lebih lazim. Manifestasi umum adalah merayau, kerengsaan dan pengaruh yang lemah, menyebabkan individu kerap menangis, ledakan sifat agresif yang tidak dapat dijangka, atau penolakan terhadap penjagaan.[30] Sindrom matahari terbenam juga boleh muncul.[35] Kira-kira 30% orang dengan Alzheimer mengalami salah pengenalpastian ilusi dan gejala khayalan lain.[30] Subjek juga kehilangan pengetahuan mengenai proses dan batasan penyakit mereka (anosognosia).[30] Inkontinens urin juga boleh berkembang.[30] Gejala-gejala ini menimbulkan tekanan kepada saudara-mara dan penjaga, yang dapat dikurangkan dengan memindahkan individu tersebut dari rumah ke kemudahan penjagaan jangka panjang yang lain.[30][36]
Lanjutan[sunting | sunting sumber]
Pada peringkat akhir, pesakit bergantung sepenuhnya kepada penjaga.[30] Bahasa dikurangkan menjadi frasa sederhana atau bahkan satu kata, akhirnya menyebabkan hilangnya pertuturan.[30][34] Walaupun kehilangan kemampuan bahasa lisan, individu sering dapat memahami dan mengembalikan isyarat emosi. Walaupun keagresifan masih ada, sikap tidak peduli dan keletihan yang melampau adalah gejala yang lebih biasa. Individu yang menghidap penyakit Alzheimer pada akhirnya tidak akan dapat melakukan tugas paling sederhana secara bebas; jisim otot dan mobiliti merosot sehingga mereka terbaring di tempat tidur dan tidak dapat makan sendiri. Penyebab kematian biasanya adalah faktor luaran, seperti jangkitan bisul atau radang paru-paru, bukan penyakit itu sendiri.[30]
Punca[sunting | sunting sumber]
Punca bagi kebanyakan kes Alzheimer masih belum diketahui kecuali 1% hingga 5% kes iaitu perbezaan genetik telah dikenal pasti.[37][38] Beberapa hipotesis yang bersaing ada yang cuba menjelaskan penyebab penyakit ini.
Genetik[sunting | sunting sumber]
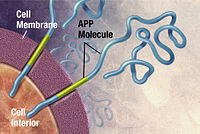
Pewarisan genetik penyakit Alzheimer (dan komponen ingatannya), berdasarkan ulasan kajian kembar dan keluarga, berkisar antara 49% hingga 79%.[39] Kira-kira 0.1% kes adalah bentuk warisan dominan autosomal (bukan berkaitan seks), yang mempunyai permulaan sebelum usia 65 tahun.[40] Bentuk penyakit ini dikenali sebagai penyakit awal Alzheimer familial. Sebilangan besar Alzheimer familial dominan autosomal boleh dikaitkan dengan mutasi pada salah satu daripada tiga gen: gen yang mengekodkan protein prekursor amiloid (APP) dan presenilin 1 dan 2.[41] Sebilangan besar mutasi pada gen APP dan presenilin meningkatkan pengeluaran protein kecil yang disebut Aβ42, yang merupakan komponen utama plak senil.[42] Sebilangan mutasi hanya mengubah nisbah antara Aβ42 dan bentuk utama yang lain - terutamanya Aβ40 - tanpa meningkatkan tahap Aβ42.[43] Dua gen lain yang berkaitan dengan penyakit Alzheimer dominan autosomal adalah ABCA7 dan SORL1.[44]
Sebilangan besar kes penyakit Alzheimer tidak menunjukkan pewarisan autosomal-dominan dan disebut Alzheimer sporadik, iaitu perbezaan persekitaran dan genetik boleh bertindak sebagai faktor risiko. Faktor risiko genetik yang paling terkenal adalah pewarisan alel ε4 apolipoprotein E (APOE).[45][46] Antara 40 dan 80% orang dengan Alzheimer mempunyai sekurang-kurangnya satu alel APOEε4.[46] Alel APOEε4 meningkatkan risiko penyakit sebanyak tiga kali pada heterozigot dan sebanyak 15 kali pada homozigot.[40] Seperti kebanyakan penyakit manusia, kesan persekitaran dan pengubah genetik mengakibatkan penembusan yang tidak lengkap. Sebagai contoh, populasi Nigeria tertentu tidak menunjukkan hubungan antara dos APOEε4 dan kejadian atau usia permulaan penyakit Alzheimer yang dilihat pada populasi manusia lain.[47][48] Percubaan awal untuk menyaring hingga 400 gen calon untuk dikaitkan dengan Alzheimer sporadik akhir (LOAD) menghasilkan hasil yang rendah.[40][41] Kajian perkaitan seluruh genom (GWAS) baru-baru ini telah menemui 19 kawasan dalam gen yang nampaknya mempengaruhi risiko.[49] Gen ini merangkumi: CASS4, CELF1, FERMT2, HLA-DRB5, INPP5D, MEF2C, NME8, PTK2B, SORL1, ZCWPW1, SLC24A4, CLU, PICALM, CR1, BIN1, MS4A, ABCA7, EPHA1, dan CD2AP.[49]
Alel dalam gen TREM2 telah dikaitkan dengan risiko 3 hingga 5 kali lebih tinggi terkena penyakit Alzheimer.[50][51] Mekanisme tindakan yang disarankan adalah bahawa dalam beberapa varian sel darah putih TREM2 di otak tidak lagi dapat mengawal jumlah beta amiloid yang ada. Banyak SNP dikaitkan dengan Alzheimer dengan kajian 2018 yang menambah 30 SNP dengan membezakan Alzheimer menjadi 6 kategori, termasuk memori, bahasa, visuospatial, dan fungsi eksekutif.[52]
Hipotesis kolinergik[sunting | sunting sumber]
Hipotesis tertua, yang berdasarkan terapi ubat yang ada sekarang, adalah hipotesis kolinergik,[53] yang mencadangkan Alzheimer disebabkan oleh penurunan sintesis neurotransmiter asetilkolin. Hipotesis kolinergik tidak mengekalkan sokongan yang meluas, terutamanya kerana ubat-ubatan yang bertujuan untuk mengatasi kekurangan asetilkolin tidak begitu berkesan.[54]
Hipotesis amiloid[sunting | sunting sumber]
Pada tahun 1991, hipotesis amiloid berpendapat bahawa deposit ekstraselular beta amiloid (Aβ) adalah penyebab utama penyakit ini.[55][56] Sokongan untuk postulat ini berasal dari lokasi gen untuk protein prekursor amiloid (APP) pada kromosom 21, bersama dengan fakta bahawa orang dengan trisomi 21 (Sindrom Down) yang mempunyai salinan gen tambahan hampir secara universal menunjukkan sekurang-kurangnya gejala Alzheimer paling awal pada usia 40 tahun.[57][58] Juga, isoform spesifik apolipoprotein, APOE4, adalah faktor risiko genetik utama untuk Alzheimer. Walaupun apolipoprotein meningkatkan pemecahan beta amiloid, beberapa protein tidak begitu berkesan dalam tugas ini (seperti APOE4), yang menyebabkan penumpukan amiloid berlebihan di otak.[59] Bukti lebih lanjut datang dari penemuan bahawa tikus transgenik yang mengekspresikan bentuk mutan gen APP manusia mengembangkan plak amiloid fibrillar dan patologi otak seperti Alzheimer dengan defisit pembelajaran spatial.[60]
Vaksin eksperimen didapati membersihkan plak amiloid pada percubaan awal manusia, tetapi tidak memberi kesan yang signifikan pada demensia.[61] Para penyelidik telah mengesyaki oligomer Aβ bukan plak (agregat banyak monomer) sebagai bentuk patogen utama Aβ. Oligomer bertoksik ini, juga disebut sebagai ligan boleh larut terbitan amiloid (ADDL), mengikat reseptor permukaan pada neuron dan mengubah struktur sinaps, sehingga mengganggu komunikasi neuron.[62] Salah satu reseptor untuk oligomer Aβ mungkin protein prion, protein yang sama yang dikaitkan dengan penyakit lembu gila dan keadaan manusia yang berkaitan, penyakit Creutzfeldt-Jakob, sehingga berpotensi menghubungkan mekanisme yang mendasari gangguan neurodegeneratif ini dengan penyakit Alzheimer.[63]
Pada tahun 2009, hipotesis ini dikemaskini, menunjukkan bahawa saudara terdekat protein beta-amiloid, dan tidak semestinya beta-amiloid itu sendiri, mungkin merupakan penyebab utama penyakit ini. Hipotesis berpendapat bahawa mekanisme yang berkaitan dengan amiloid yang memangkas sambungan neuronal di otak pada fasa pertumbuhan awal kehidupan yang cepat mungkin dipicu oleh proses yang berkaitan dengan penuaan di kemudian hari sehingga menyebabkan neuron layu penyakit Alzheimer.[64] N-APP, serpihan APP dari terminus-N peptida, bersebelahan dengan beta-amiloid dan dibelah dari APP oleh salah satu enzim yang sama. N-APP mencetuskan laluan penghancuran diri dengan mengikat reseptor neuron yang disebut kematian reseptor 6 (DR6, juga dikenali sebagai TNFRSF21).[64] DR6 sangat diekspresikan di kawasan otak manusia yang paling banyak terkena penyakit Alzheimer, jadi kemungkinan jalan N-APP/DR6 mungkin dirampas di otak penuaan sehingga menyebabkan kerosakan. Dalam model ini, beta-amiloid memainkan peranan pelengkap, dengan menekan fungsi sinaptik.
Mutasi Osaka[sunting | sunting sumber]
Keturunan Jepun yang menghidap penyakit Alzheimer didapati dikaitkan dengan mutasi penghapusan kodon 693 APP.[65] Mutasi ini dan perkaitannya dengan penyakit Alzheimer pertama kali dilaporkan pada tahun 2008.[66] Mutasi ini dikenali sebagai mutasi Osaka. Hanya homozigot dengan mutasi ini yang menghidap penyakit Alzheimer. Mutasi ini mempercepat oligomerisasi Aβ tetapi protein tidak membentuk fibril amiloid yang menunjukkan bahawa ia adalah oligomerisasi Aβ daripada fibril yang mungkin menjadi penyebab penyakit ini. Tikus yang menyatakan mutasi ini mempunyai semua patologi biasa penyakit Alzheimer.
Hipotesis Tau[sunting | sunting sumber]

Hipotesis tau menunjukkan bahawa keabnormalan protein tau memulakan penyakit ini.[56] Dalam model ini, tau hiperfosforilasi mula berpasangan dengan bebenang tau yang lain. Akhirnya, mereka membentuk neurofibrilari kusut di dalam badan sel saraf.[67] Apabila ini berlaku, mikrotubul hancur, menghancurkan struktur sitoskeleton sel yang runtuh sistem pengangkutan neuron.[68] Ini boleh mengakibatkan kerosakan pertama dalam komunikasi biokimia antara neuron dan kemudian kematian sel.[69]
Hipotesis lain[sunting | sunting sumber]
Hipotesis keradangan adalah bahawa Alzheimer disebabkan oleh keradangan progresif yang berterusan di otak yang memuncak pada neurodegenerasi.[70] Kemungkinan peranan jangkitan periodontal kronik[70] dan mikrobiota usus telah dicadangkan.[71]
Hipotesis neurovaskular telah dicadangkan yang menyatakan bahawa fungsi penghadang darah-otak yang lemah mungkin terlibat.[72] Jangkitan Spirochete juga dikaitkan dengan demensia.[73][74]
Homeostasis selular biometal seperti tembaga ionik, besi, dan zink adalah terganggu dalam individu dengan penyakit Alzheimer, walaupun masih belum jelas sama ada ia dihasilkan oleh atau menyebabkan perubahan protein. Ion-ion ini mempengaruhi dan dipengaruhi oleh tau, APP, dan APOE,[75] dan disregulasi ion-ion ini boleh menyebabkan tekanan oksidatif yang boleh menyumbang kepada patologi.[76][77][78][79][80] Kualiti beberapa kajian ini telah dikritik,[81][82] dan perkaitannya masih kontroversial.[83] Majoriti penyelidik tidak menyokong hubungan kausal dengan aluminium.[82]
Merokok adalah faktor risiko Alzheimer yang signifikan.[84] Penanda sistemik sistem imun bawaan adalah faktor risiko untuk Alzheimer yang lewat.[85]
Terdapat bukti sementara bahawa pendedahan kepada pencemaran udara mungkin menjadi faktor penyumbang kepada perkembangan penyakit Alzheimer.[86]
Satu hipotesis menunjukkan bahawa disfungsi oligodendrosit dan mielin yang berkaitan semasa penuaan menyumbang kepada kerosakan akson, yang kemudian menyebabkan pengeluaran amiloid dan tau-fosforilasi tau sebagai kesan sampingan.[87][88]
Retrogenesis adalah hipotesis perubatan mengenai perkembangan dan kemajuan penyakit Alzheimer yang dikemukakan oleh Barry Reisberg pada tahun 1980-an.[89] Hipotesisnya adalah bahawa sama seperti janin melalui proses perkembangan saraf yang bermula dengan neurulasi dan berakhir dengan mielinasi, otak manusia dengan Alzheimer mengalami proses neurodegenerasi terbalik bermula dengan demielinasi dan kematian akson (jirim putih) dan berakhir dengan kematian daripada jirim kelabu.[90] Begitu juga hipotesisnya, bahawa ketika bayi melalui tahap perkembangan kognitif, individu yang mengalami Alzheimer mengalami proses penurunan kognitif progresif.[89] Reisberg mengembangkan alat penilaian pengasuhan yang dikenali sebagai "FAST" (Functional Assessment Staging Tool) yang menurutnya membolehkan mereka yang merawat individu dengan Alzheimer dengan mengenal pasti tahap perkembangan penyakit dan yang memberikan nasihat mengenai jenis perawatan yang diperlukan pada setiap tahap.[89][91]
Hubungan dengan penyakit seliak tidak jelas, dengan kajian pada tahun 2019 mendapati tidak ada peningkatan demensia secara keseluruhan pada mereka yang menderita seliak, sementara tinjauan tahun 2018 mendapati hubungan dengan beberapa jenis demensia termasuk Alzheimer.[92][93]
Patofisiologi[sunting | sunting sumber]

Neuropatologi[sunting | sunting sumber]
Penyakit Alzheimer dicirikan oleh kehilangan neuron dan sinapsis di korteks serebrum dan kawasan subkortikal tertentu. Kehilangan ini mengakibatkan atrofi kasar pada kawasan yang terjejas, termasuk degenerasi pada lobus temporal dan lobus parietal, dan bahagian korteks frontal dan girus singulat.[94] Degenerasi juga terdapat dalam inti batang otak seperti lokus coeruleus.[95] Kajian menggunakan MRI dan PET telah mendokumentasikan pengurangan ukuran kawasan otak tertentu pada individu dengan Alzheimer ketika mereka berkembang dari gangguan kognitif ringan hingga penyakit Alzheimer, dan dibandingkan dengan gambar serupa dari orang dewasa yang lebih tua yang sihat.[96][97]
Kedua-dua plak amiloid dan kekusutan neurofibrilari dapat dilihat dengan jelas oleh mikroskopi pada otak yang mengalami Alzheimer.[98] Plak padat, kebanyakannya tidak larut peptida beta-amiloid dan bahan selular di luar dan di sekitar neuron. Kekusutan (kekusustan neurofibrilari) adalah agregat dari protein yang berkaitan dengan mikrotubul yang telah menjadi hiperfosforilasi dan terkumpul di dalam sel itu sendiri. Walaupun banyak individu yang lebih tua mengembangkan beberapa plak dan kekusutan akibat penuaan, otak individu dengan Alzheimer mempunyai lebih banyak dari mereka di kawasan otak tertentu seperti lobus temporal.[99] Jasad Lewy tidak jarang berlaku di otak individu yang menghidap Alzheimer.[100]
Biokimia[sunting | sunting sumber]
Penyakit Alzheimer telah dikenal pasti sebagai penyakit salah gulung protein (proteopati), yang disebabkan oleh pengumpulan plak protein beta amiloid dan protein tau yang dilipat secara tidak normal di otak.[101] Plak terdiri daripada peptida kecil, panjang 39–43 asid amino, disebut amiloid beta (Aβ). Aβ adalah serpihan dari protein prekursor amiloid yang lebih besar (APP). APP adalah protein transmembran yang menembusi membran neuron. APP sangat penting untuk pertumbuhan, kelangsungan hidup, dan pembaikan selepas kecederaan.[102][103] Dalam penyakit Alzheimer, gamma secretase dan beta secretase bertindak bersama dalam proses proteolitik yang menyebabkan APP terbahagi kepada serpihan yang lebih kecil.[104] Salah satu daripada serpihan ini menimbulkan fibril amiloid beta, yang kemudian membentuk gumpalan yang mendapan luar neuron dalam formasi padat yang dikenali sebagai plak senil.[98][105]
Penyakit Alzheimer juga dianggap sebagai tauopati kerana pengumpulan protein tau yang tidak normal. Setiap neuron mempunyai sitoskeleton, struktur sokongan dalaman yang sebahagiannya terdiri daripada struktur yang disebut mikrotubul. Mikrotubul ini bertindak seperti laluan, membimbing nutrien dan molekul dari sel badan ke hujung akson dan belakang. Protein yang disebut tau menstabilkan mikrotubulus ketika difosforilasi, dan oleh itu disebut protein yang berkaitan dengan mikrotubul. Dalam penyakit Alzheimer, tau mengalami perubahan kimia, menjadi hiperfosforilasi; ia kemudian mula berpasangan dengan benang lain, mewujudkan kekusutan neurofibrilari dan menguraikan sistem pengangkutan neuron.[106] Patogenik tau juga boleh menyebabkan kematian neuron melalui disregulasi unsur transposisi.[107]
Mekanisme penyakit[sunting | sunting sumber]
Secara tepat berkenaan gangguan pengeluaran dan pengumpulan peptida beta-amiloid yang menimbulkan patologi penyakit Alzheimer masih tidak diketahui.[108][109] Hipotesis amiloid secara tradisional menunjukkan pengumpulan peptida beta-amiloid sebagai lokasi pusat yang mencetuskan degenerasi neuron. Pengumpulan fibril amiloid agregat, yang dipercayai sebagai bentuk toksik protein yang bertanggungjawab mengganggu homeostasis ion kalsium sel, menyebabkan kematian sel yang diprogramkan (apoptosis).[110] Juga diketahui bahawa Aβ secara selektif terbentuk di mitokondria dalam sel-sel otak yang terjejas dengan Alzheimer, dan juga merencatkan fungsi enzim tertentu dan penggunaan glukosa oleh neuron.[111]
Pelbagai proses keradangan dan sitokin juga mungkin berperanan dalam patologi penyakit Alzheimer. Keradangan adalah penanda umum kerosakan tisu pada sebarang penyakit, dan mungkin penyebab sekunder disebabkan oleh kerosakan tisu dalam individu yang terjejas penyakit Alzheimer atau penanda tindak balas imunologi.[112] Terdapat bukti yang semakin meningkat mengenai interaksi yang kuat antara neuron dan mekanisme imunologi di otak. Obesiti dan keradangan sistemik boleh mengganggu proses imunologi yang mendorong perkembangan penyakit.[113]
Perubahan dalam pembahagian faktor neurotropik yang berbeza dan ekspresi reseptornya seperti faktor neurotropik terbitan otak (BDNF) telah dijelaskan dalam penyakit Alzheimer.[114][115]
Diagnosis[sunting | sunting sumber]

Penyakit Alzheimer biasanya didiagnosis berdasarkan sejarah perubatan seseorang, sejarah dari saudara-mara, dan pemerhatian tingkah laku. Kehadiran ciri-ciri neurologi dan neuropsikologi dan ketiadaan keadaan alternatif sangat menyokong.[116][117] Pengimejan perubatan lanjutan melalui pengiraan tomografi (CT) atau pengimejan resonans magnet (MRI), dan dengan tomografi pengiraan pancaran foton tunggal (SPECT) atau tomografi pancaran positron (PET) dapat digunakan untuk membantu mengecualikan patologi otak atau subjenis demensia lain.[118] Lebih-lebih lagi, ia dapat meramalkan penukaran dari tahap prodromal (gangguan kognitif ringan) kepada penyakit Alzheimer.[119]
Penilaian fungsi intelektual termasuk ujian ingatan yang dapat mencirikan keadaan penyakit.[23] Organisasi perubatan telah membuat kriteria diagnostik untuk memudahkan dan menyeragamkan proses diagnostik untuk pakar perubatan terlatih. Diagnosis dapat disahkan dengan ketepatan post-mortem yang sangat tinggi apabila bahan otak tersedia dan dapat diperiksa secara histologi.[120]
Kriteria[sunting | sunting sumber]
Institut Nasional Gangguan Neurologi dan Komunikatif dan Strok (NINCDS) dan Persatuan Penyakit Alzheimer dan Gangguan Berkaitan (ADRDA, kini dikenali sebagai Persatuan Alzheimer) menubuhkan Kriteria Alzheimer NINCDS-ADRDA yang paling biasa digunakan pada tahun 1984,[120] secara meluas dikemas kini pada tahun 2007.[121] Kriteria ini memerlukan kehadiran gangguan kognitif, dan suspek sindrom demensia, disahkan oleh ujian neuropsikologi untuk diagnosis klinikal yang ia mungkin atau kemungkinan penyakit Alzheimer. Pengesahan histopatologi termasuk pemeriksaan mikroskopik tisu otak diperlukan untuk diagnosis pasti. Kebolehpercayaan dan kesahan statistik yang baik telah ditunjukkan antara kriteria diagnostik dan pengesahan histopatologi yang sah[122] Lapan domain intelektual paling sering terganggu dalam penyakit Alzheimer - memori, bahasa, kemahiran persepsi, perhatian, kemahiran motor, orientasi, penyelesaian masalah dan kemampuan fungsional eksekutif. Domain ini setara dengan Kriteria Alzheimer NINCDS-ADRDA seperti yang disenaraikan dalam Manual Diagnostik dan Statistik Gangguan Mental (DSM-IV-TR) yang diterbitkan oleh Persatuan Psikiatri Amerika.[123][124]
Teknik[sunting | sunting sumber]

Ujian neuropsikologi seperti pemeriksaan keadaan mental-mini (MMSE) digunakan secara meluas untuk menilai gangguan kognitif yang diperlukan untuk diagnosis. Susunan ujian yang lebih komprehensif diperlukan untuk kebolehpercayaan hasil yang tinggi, terutama pada peringkat awal penyakit.[125][126] Pemeriksaan neurologi pada penyakit Alzheimer awal biasanya akan memberikan hasil yang normal, kecuali gangguan kognitif yang jelas, yang mungkin tidak berbeza dengan yang disebabkan oleh proses penyakit lain, termasuk penyebab demensia yang lain.
Pemeriksaan neurologi lebih lanjut sangat penting dalam diagnosis pembezaan penyakit Alzheimer dan penyakit lain.[23] Temu ramah dengan ahli keluarga juga digunakan dalam penilaian penyakit. Pengasuh dapat memberikan maklumat penting mengenai kemampuan hidup seharian, serta penurunan, dari masa ke masa, fungsi mental seseorang.[127] Pandangan pengasuh sangat penting, kerana seseorang dengan penyakit Alzheimer biasanya tidak menyedari kemerosotannya sendiri.[128] Sering kali, keluarga juga mengalami kesukaran dalam mengesan gejala demensia awal dan mungkin tidak menyampaikan maklumat yang tepat kepada pakar perubatan.[129]
Ujian tambahan memberikan maklumat tambahan mengenai beberapa ciri penyakit atau digunakan untuk mengesampingkan diagnosis lain. Ujian darah dapat mengenal pasti penyebab demensia lain daripada penyakit Alzheimer[23]- penyebab yang, dalam kes yang jarang berlaku, dapat dipulihkan.[130] Adalah biasa untuk melakukan ujian fungsi tiroid, menilai B12, mengesampingkan sifilis, mengesampingkan masalah metabolik (termasuk ujian untuk fungsi buah pinggang, tahap elektrolit dan untuk diabetes), menilai tahap logam berat (misalnya, plumbum, merkuri) dan anemia. (juga perlu untuk mengesampingkan delirium).
Ujian psikologi untuk kemurungan digunakan, kerana kemurungan boleh bersamaan dengan penyakit Alzheimer (lihat Kemurungan penyakit Alzheimer), tanda awal gangguan kognitif,[131] atau bahkan penyebabnya.[132][133]
Oleh kerana ketepatan rendah, imbasan C-PIB-PET tidak digalakkan digunakan sebagai alat diagnostik awal atau untuk meramalkan perkembangan penyakit Alzheimer ketika individu menunjukkan tanda-tanda gangguan kognitif ringan (MCI).[134] Penggunaan imbasan PET ¹⁸F-FDG, sebagai satu ujian, untuk mengenal pasti individu yang mungkin menghidap penyakit Alzheimer juga tidak disokong oleh bukti.[135]
Pencegahan[sunting | sunting sumber]

Tidak ada bukti pasti untuk menyokong bahawa tindakan tertentu berkesan dalam mencegah penyakit Alzheimer.[136] Kajian global mengenai langkah-langkah untuk mencegah atau menunda permulaan penyakit Alzheimer sering membuahkan hasil yang tidak konsisten. Kajian epidemiologi telah mencadangkan hubungan antara faktor tertentu yang dapat diubah, seperti diet, risiko kardiovaskular, produk farmaseutikal, atau aktiviti intelektual antara lain, dan kemungkinan penduduk mengembangkan penyakit Alzheimer. Hanya penyelidikan lebih lanjut, termasuk ujian klinikal, yang akan mendedahkan sama ada faktor-faktor ini dapat membantu mencegah penyakit Alzheimer.[136]
Ubatan[sunting | sunting sumber]
Faktor risiko kardiovaskular, seperti hiperkolesterolaemia, hipertensi, diabetes, dan merokok, dikaitkan dengan risiko permulaan dan peningkatan penyakit Alzheimer yang lebih tinggi.[137][138] Ubat tekanan darah boleh mengurangkan risiko.[139] Statin, yang menurunkan kolesterol, namun tidak berkesan dalam mencegah atau memperbaiki perjalanan penyakit ini.[140][141][142] Penggunaan jangka panjang ubat-ubatan anti-radang bukan steroid (NSAID) dianggap pada tahun 2007 dikaitkan dengan kemungkinan penurunan penyakit Alzheimer.[143] Bukti juga menunjukkan anggapan bahawa NSAID dapat mengurangkan keradangan yang berkaitan dengan plak amiloid, tetapi percubaan ditangguhkan kerana kejadian buruk yang tinggi.[136] Tidak ada percubaan pencegahan yang selesai.[136] Mereka nampaknya tidak berguna sebagai rawatan, tetapi pada tahun 2011 dianggap sebagai calon pencegahan prasimptomatik.[144] Terapi penggantian hormon pada menopaus, walaupun pernah digunakan sebelumnya, boleh meningkatkan risiko demensia.[145]
Gaya hidup[sunting | sunting sumber]
Individu yang terlibat dalam aktiviti intelektual seperti membaca, bermain permainan papan, menyelesaikan teka-teki silang kata, bermain alat muzik, atau interaksi sosial biasa menunjukkan penurunan risiko penyakit Alzheimer.[146] Ini sesuai dengan teori rizab kognitif, yang menyatakan bahawa beberapa pengalaman hidup mengakibatkan fungsi saraf yang lebih cekap memberikan individu rizab kognitif yang menunda permulaan manifestasi demensia.[146] Pendidikan menunda permulaan sindrom penyakit Alzheimer tanpa mengubah jangka masa penyakit ini.[147] Mempelajari bahasa kedua walaupun di kemudian hari nampaknya menunda permulaan penyakit Alzheimer.[148] Aktiviti fizikal juga dikaitkan dengan penurunan risiko penyakit Alzheimer.[147] Latihan fizikal dikaitkan dengan penurunan kadar demensia.[149] Latihan fizikal juga berkesan untuk mengurangkan keparahan gejala pada mereka yang menderita penyakit Alzheimer.[150]
Diet[sunting | sunting sumber]
Individu yang mengekalkan diet Jepun, atau Mediterranean yang sihat mempunyai risiko penurunan penyakit Alzheimer.[151] Diet Mediterranean boleh meningkatkan hasil bagi mereka yang menghidap penyakit ini.[152] Mereka yang makan diet tinggi lemak tepu dan karbohidrat ringkas (mono- dan disakarida) mempunyai risiko yang lebih tinggi.[153] Manfaat diet Mediterranean untuk kesan kardiovaskular telah dicadangkan sebagai mekanisme tindakan.[154] Kesimpulan mengenai komponen makanan kadang-kadang sukar dipastikan kerana hasilnya berbeza antara kajian berdasarkan populasi dan percubaan terkawal secara rawak.[151] Terdapat bukti terhad bahawa penggunaan alkohol ringan hingga sederhana, terutamanya wain merah, dikaitkan dengan risiko penyakit Alzheimer yang lebih rendah.[151] Terdapat bukti sementara bahawa kafein boleh melindungi daripada penyakit ini.[155] Sejumlah makanan yang kaya akan flavonoid seperti koko, wain merah, dan teh boleh mengurangkan risiko penyakit Alzheimer.[156][157] Ulasan mengenai penggunaan vitamin dan mineral tidak menemui bukti yang konsisten untuk mengesyorkannya. Ini termasuk vitamin A,[158][159] C,[160][161] bentuk alpha-tokoferol vitamin E,[162] selenium,[163] zink,[164][165] dan asid folik dengan atau tanpa vitamin B12.[166] Bukti dari satu percubaan terkawal secara rawak menunjukkan bahawa bentuk alpha-tokoferol vitamin E dapat memperlambat penurunan kognitif, bukti ini dinilai sebagai "sederhana" dari segi kualiti.[162] Percubaan yang memeriksa asid folik (B9) dan vitamin B lain gagal menunjukkan hubungan yang signifikan dengan penurunan kognitif.[167] Makanan tambahan asid lemak omega-3 dari tumbuhan dan ikan, dan diet asid dokosaheksaenoik (DHA), nampaknya tidak memberi manfaat kepada individu dengan penyakit Alzheimer ringan hingga sederhana.[168][169] Curcumin setakat 2010[kemas kini] tidak menunjukkan manfaat pada individu walaupun terdapat bukti tentatif pada haiwan.[170] Terdapat bukti yang tidak konsisten dan tidak meyakinkan bahawa ginkgo mempunyai kesan positif terhadap gangguan kognitif dan demensia.[171] Setakat 2008[kemas kini] tidak ada bukti konkrit bahawa kanabinoid berkesan dalam memperbaiki gejala penyakit Alzheimer atau demensia;[172] namun, beberapa penyelidikan mengenai endokanabinoid kelihatan menjanjikan.[173]
Pengurusan[sunting | sunting sumber]
Tidak ada penawar untuk penyakit Alzheimer; rawatan yang ada menawarkan faedah simptomatik yang agak kecil tetapi tetap bersifat paliatif. Rawatan semasa boleh dibahagikan kepada farmaseutikal, psikososial dan penjagaan.
Ubatan[sunting | sunting sumber]
Lima ubat kini digunakan untuk merawat masalah kognitif penyakit Alzheimer: empat adalah perencat asetilkolinesterase (tacrine, rivastigmina, galantamina dan donepezil) dan yang lain (memantina) adalah antagonis reseptor NMDA. Manfaat penggunaannya adalah kecil.[174][175][176] Tidak ada ubat yang jelas ditunjukkan untuk menunda atau menghentikan perkembangan penyakit ini.
Pengurangan aktiviti neuron kolinergik adalah ciri terkenal penyakit Alzheimer.[177] Perencat asetilkolinesterase digunakan untuk mengurangkan kadar asetilkolin (ACh) yang dipecah, sehingga meningkatkan kepekatan ACh di otak dan memerangi kehilangan ACh yang disebabkan oleh kematian neuron kolinergik.[178] Terdapat bukti keberkesanan ubat-ubatan ini pada penyakit Alzheimer ringan hingga sederhana,[174][175][179] dan beberapa bukti penggunaannya pada tahap lanjut.[174] Penggunaan ubat-ubatan ini dalam kemerosotan kognitif ringan tidak menunjukkan kesan dalam kelewatan permulaan penyakit Alzheimer.[180] Kesan sampingan yang paling biasa adalah mual dan muntah, kedua-duanya berkaitan dengan kolinergik berlebihan. Kesan sampingan ini timbul pada sekitar 10-20% pengguna, tahap keparahan ringan hingga sederhana, dan dapat diatasi dengan perlahan-lahan menyesuaikan dos ubat.[181] Kesan sekunder yang kurang biasa termasuk kekejangan otot, penurunan degupan jantung (bradikardia), penurunan selera makan dan berat badan, dan peningkatan pengeluaran asid gastrik.[179]
Glutamat adalah neurotransmiter sistem saraf, walaupun jumlah yang berlebihan di otak dapat menyebabkan kematian sel melalui proses yang disebut eksitotoksisiti yang terdiri daripada stimulasi yang berlebihan terhadap reseptor glutamat. Eksitotoksisiti berlaku bukan sahaja pada penyakit Alzheimer, tetapi juga pada penyakit neurologi lain seperti penyakit Parkinson dan sklerosis berbilang.[182] Memantina adalah antagonis reseptor NMDA yang tidak kompetitif yang pertama kali digunakan sebagai agen anti-influenza. Ia bertindak pada sistem glutamatergik dengan menyekat reseptor NMDA dan menghalang stimulasi yang berlebihan oleh glutamat.[182][183] Memantina telah terbukti mempunyai manfaat kecil dalam rawatan penyakit Alzheimer sederhana hingga teruk.[184] Kejadian buruk yang dilaporkan dengan memantina jarang dan ringan, termasuk halusinasi, kekeliruan, pening, sakit kepala dan keletihan.[185] Gabungan memantina dan donepezil telah terbukti "mempunyai keberkesanan yang signifikan secara statistik tetapi secara klinikal marginal".[186]
Antipsikotik tak tipikal sangat berguna dalam mengurangkan keagresifandan psikosis pada individu dengan penyakit Alzheimer, tetapi jika berlebihan ia diimbangi oleh kesan buruk yang serius, seperti strok, kesukaran pergerakan atau penurunan kognitif.[187] Apabila digunakan dalam jangka masa panjang, ia terbukti berkait dengan peningkatan kematian.[188] Menghentikan penggunaan antipsikotik dalam kumpulan individu ini kelihatan lebih selamat.[189]
Huperzina A mungkin menjanjikan keberkesanan, memerlukan bukti lebih lanjut sebelum penggunaannya dapat disarankan.[190]
Intervensi psikososial[sunting | sunting sumber]
Intervensi psikososial digunakan sebagai tambahan kepada rawatan farmasi dan dapat diklasifikasikan dalam pendekatan berorientasikan tingkah laku, emosi, kognisi atau rangsangan. Penyelidikan mengenai keberkesanan tidak tersedia dan jarang spesifik untuk penyakit Alzheimer, dengan fokus pada demensia pada umumnya.[191]
Intervensi tingkah laku cuba mengenal pasti dan mengurangkan anteseden dan akibat dari tingkah laku masalah. Pendekatan ini tidak menunjukkan kejayaan dalam meningkatkan fungsi keseluruhan,[192] tetapi dapat membantu mengurangkan beberapa tingkah laku masalah tertentu, seperti inkontinens.[193] Terdapat kekurangan data berkualiti tinggi mengenai keberkesanan teknik ini dalam masalah tingkah laku lain seperti merayau.[194][195] Terapi muzik berkesan untuk mengurangkan gejala tingkah laku dan psikologi.[196]
Intervensi berorientasikan emosi merangkumi terapi ingatan, terapi pengesahan, psikoterapi sokongan, terapi integrasi deria, juga disebut snoezelen, dan terapi kehadiran simulasi. Kajian Cochrane tidak menemui bukti bahawa ini berkesan.[197] Psikoterapi sokongan telah mendapat sedikit atau tidak ada kajian ilmiah formal, tetapi beberapa doktor menganggapnya berguna dalam membantu orang yang mengalami masalah ringan untuk menyesuaikan diri dengan penyakit mereka.[191] Terapi ingatan (RT) melibatkan perbincangan pengalaman masa lalu secara individu atau berkumpulan, berkali-kali dengan bantuan gambar, barang-barang rumah tangga, muzik dan rakaman suara, atau barang-barang lain yang biasa dari masa lalu. Tinjauan 2018 mengenai keberkesanan RT mendapati bahawa kesannya tidak konsisten, saiznya kecil dan mempunyai kepentingan klinikal yang diragukan, dan berbeza mengikut tetapan.[198] Terapi kehadiran simulasi (SPT) berdasarkan teori lampiran dan melibatkan bermain rakaman dengan suara saudara terdekat dengan individu yang menghidap penyakit Alzheimer. Terdapat sebahagian bukti yang menunjukkan bahawa SPT dapat mengurangkan tingkah laku yang mencabar.[199] Akhirnya, terapi pengesahan didasarkan pada penerimaan realiti dan kebenaran peribadi pengalaman orang lain, sementara integrasi deria berdasarkan latihan yang bertujuan untuk merangsang deria. Tidak ada bukti yang menyokong kegunaan terapi ini.[200][201]
Tujuan rawatan berorientasikan kognisi, yang merangkumi orientasi realiti dan latihan semula kognitif, adalah pengurangan defisit kognitif. Orientasi realiti terdiri daripada penyampaian maklumat mengenai masa, tempat atau individu untuk memudahkan pemahaman seseorang tentang persekitarannya dan tempatnya di dalamnya. Sebaliknya, latihan semula kognitif cuba meningkatkan keupayaan yang terganggu dengan menggunakan kemampuan mental. Kedua-duanya telah menunjukkan beberapa keberkesanan meningkatkan keupayaan kognitif,[202] walaupun dalam beberapa kajian kesan ini adalah kesan sementara dan negatif, seperti kekecewaan, juga telah dilaporkan.[191]
Rawatan berorientasikan rangsangan merangkumi terapi seni, muzik dan haiwan kesayangan, senaman, dan aktiviti rekreasi lain. Rangsangan mempunyai dukungan sederhana untuk meningkatkan tingkah laku, mood, dan, pada tahap yang lebih rendah, fungsi. Walau bagaimanapun, sama pentingnya dengan kesan ini, sokongan utama untuk penggunaan terapi rangsangan adalah perubahan dalam rutin seseorang.[191]
Pengasuhan[sunting | sunting sumber]
Oleh kerana Alzheimer tidak dapat disembuhkan dan secara beransur-ansur membuat individu tidak mampu mengurus keperluan mereka sendiri, penjagaan pada dasarnya adalah rawatan dan harus dikendalikan dengan hati-hati selama penyakit ini.
Pada peringkat awal dan sederhana, pengubahsuaian terhadap persekitaran tempat tinggal dan gaya hidup dapat meningkatkan keselamatan pesakit dan mengurangkan beban penjaga.[203][204] Contoh pengubahsuaian tersebut adalah kepatuhan kepada rutin yang dipermudahkan, penempatan kunci keselamatan, pelabelan barang keperluan rumah tangga untuk memberi petunjuk kepada individu yang menghidap penyakit ini atau penggunaan objek kehidupan harian yang diubah.[191][205][206] Sekiranya makan menjadi bermasalah, makanan perlu disediakan dalam kepingan yang lebih kecil atau bahkan ditulenkan.[207] Apabila kesukaran menelan timbul, penggunaan tabung makan mungkin diperlukan. Dalam kes seperti itu, keberkesanan perubatan dan etika penyusuan berterusan adalah pertimbangan penting bagi pengasuh dan ahli keluarga.[208][209] Penggunaan pengekangan fizikal jarang ditunjukkan pada mana-mana peringkat penyakit ini, walaupun ada situasi apabila ia diperlukan untuk mencegah bahaya kepada individu yang menghidap penyakit Alzheimer atau penjaga mereka.[191]
Ketika penyakit itu berkembang, masalah perubatan yang berlainan boleh muncul, seperti penyakit mulut dan gigi, ulser tekanan, kekurangan zat makanan, masalah kebersihan, atau pernafasan, kulit, atau jangkitan mata. Pengurusan yang teliti dapat menghalangnya, sementara rawatan profesional diperlukan ketika ia muncul..[210][211] Pada peringkat akhir penyakit ini, rawatan berpusat pada melegakan ketidakselesaan hingga kematian, sering dengan bantuan rumah sakit.[212]
Prognosis[sunting | sunting sumber]

Tahap awal penyakit Alzheimer sukar didiagnosis. Diagnosis pasti biasanya dibuat apabila gangguan kognitif mengganggu aktiviti kehidupan seharian, walaupun individu itu mungkin masih hidup secara bebas. Gejala akan berkembang dari masalah kognitif ringan, seperti kehilangan ingatan melalui peningkatan tahap gangguan kognitif dan bukan kognitif, menghilangkan kemungkinan hidup bebas, terutama pada peringkat akhir penyakit.[30]
Jangka hayat individu dengan penyakit Alzheimer dikurangkan.[213] Selepas diagnosis, biasanya antara tiga hingga sepuluh tahun.[213]
Kurang daripada 3% orang hidup lebih dari empat belas tahun.[214] Ciri-ciri penyakit yang dikaitkan dengan penurunan kelangsungan hidup adalah peningkatan keparahan gangguan kognitif, penurunan tahap fungsional, sejarah penurunan, dan gangguan dalam pemeriksaan neurologi. Penyakit kebetulan lain seperti masalah jantung, diabetes atau sejarah penyalahgunaan alkohol juga berkaitan dengan kelangsungan hidup yang semakin pendek.[215][216][217] Walaupun usia yang lebih awal di awal semakin tinggi jumlah tahun hidup, jangka hayat dikurangkan terutamanya jika dibandingkan dengan populasi yang sihat di kalangan mereka yang lebih muda.[218] Lelaki mempunyai prognosis kelangsungan hidup yang kurang baik daripada wanita.[214][219]
Pneumonia dan dehidrasi adalah penyebab kematian yang paling kerap disebabkan oleh penyakit Alzheimer, sementara barah adalah penyebab kematian yang lebih jarang daripada populasi umum.[219]
Pengidap Alzheimer yang terkemuka[sunting | sunting sumber]
- Enid Blyton
- Charles Bronson
- Sir Winston Churchill
- Perry Como
- Alfred Deakin
- James Doohan
- Ralph Waldo Emerson
- Barry Goldwater
- Rita Hayworth
- Charlton Heston
- Beatrice Lillie
- Ratu Juliana, Belanda (1948 - 1980)
- Burgess Meredith
- Iris Murdoch
- Maurice Ravel
- Ronald Reagan
- Sugar Ray Robinson
- Margaret Rutherford
- Cyrus Vance
- E.B. White
- Harold Wilson
Rujukan[sunting | sunting sumber]
- ^ a b c d e f g h i j Ralat petik: Tag
<ref>tidak sah; teks bagi rujukanBMJ2009tidak disediakan - ^ a b c d e f g "Dementia Fact sheet". World Health Organization. September 2020.
- ^ a b Mendez MF (November 2012). "Early-onset Alzheimer's disease: nonamnestic subtypes and type 2 AD". Archives of Medical Research. 43 (8): 677–85. doi:10.1016/j.arcmed.2012.11.009. PMC 3532551. PMID 23178565.
- ^ Ballard C, Gauthier S, Corbett A, Brayne C, Aarsland D, Jones E (March 2011). "Alzheimer's disease". Lancet. 377 (9770): 1019–31. doi:10.1016/S0140-6736(10)61349-9. PMID 21371747. S2CID 20893019.
- ^ a b "Dementia diagnosis and assessment" (PDF). National Institute for Health and Care Excellence (NICE). Diarkibkan daripada yang asal (PDF) pada 5 December 2014. Dicapai pada 30 November 2014.
- ^ Commission de la transparence (June 2012). "Drugs for Alzheimer's disease: best avoided. No therapeutic advantage" [Drugs for Alzheimer's disease: best avoided. No therapeutic advantage]. Prescrire International. 21 (128): 150. PMID 22822592.
- ^ a b Querfurth HW, LaFerla FM (January 2010). "Alzheimer's disease". The New England Journal of Medicine. 362 (4): 329–44. doi:10.1056/NEJMra0909142. PMID 20107219. S2CID 205115756.
- ^ a b c "Dementia Fact sheet". World Health Organization. 12 December 2017. Ralat petik: Tag
<ref>tidak sah, nama "GBD2015Pre" digunakan secara berulang dengan kandungan yang berbeza - ^ a b GBD 2015 Mortality Causes of Death Collaborators (October 2016). "Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1459–1544. doi:10.1016/S0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
- ^ a b c d e "Alzheimer's Disease Fact Sheet". National Institute on Aging (dalam bahasa Inggeris). Dicapai pada 25 January 2021.
- ^ Todd S, Barr S, Roberts M, Passmore AP (November 2013). "Survival in dementia and predictors of mortality: a review". International Journal of Geriatric Psychiatry. 28 (11): 1109–24. doi:10.1002/gps.3946. PMID 23526458. S2CID 25445595.
- ^ Ralat petik: Tag
<ref>tidak sah; teks bagi rujukanLongtidak disediakan - ^ "Study reveals how APOE4 gene may increase risk for dementia". National Institute on Aging (dalam bahasa Inggeris). Dicapai pada 17 Mac 2021.
- ^ Ralat petik: Tag
<ref>tidak sah; teks bagi rujukanHsutidak disediakan - ^ a b Thompson CA, Spilsbury K, Hall J, Birks Y, Barnes C, Adamson J (Julai 2007). "Systematic review of information and support interventions for caregivers of people with dementia". BMC Geriatrics. 7: 18. doi:10.1186/1471-2318-7-18. PMC 1951962. PMID 17662119.
- ^ Forbes D, Forbes SC, Blake CM, Thiessen EJ, Forbes S (April 2015). "Exercise programs for people with dementia". The Cochrane Database of Systematic Reviews (Submitted manuscript). 132 (4): CD006489. doi:10.1002/14651858.CD006489.pub4. PMID 25874613.
- ^ National Institute for Health and Clinical Excellence. "Low-dose antipsychotics in people with dementia". National Institute for Health and Care Excellence (NICE). Diarkibkan daripada yang asal pada 5 Disember 2014. Dicapai pada 29 November 2014.
- ^ "Information for Healthcare Professionals: Conventional Antipsychotics". US Food and Drug Administration. 16 June 2008. Diarkibkan daripada yang asal pada 29 November 2014. Dicapai pada 29 November 2014.
- ^ Ralat petik: Tag
<ref>tidak sah; teks bagi rujukanpmid9661992tidak disediakan - ^ Bonin-Guillaume S, Zekry D, Giacobini E, Gold G, Michel JP (January 2005). "[The economical impact of dementia]". Presse Médicale (dalam bahasa French). 34 (1): 35–41. doi:10.1016/s0755-4982(05)83882-5. PMID 15685097.CS1 maint: unrecognized language (link)
- ^ Meek PD, McKeithan K, Schumock GT (1998). "Economic considerations in Alzheimer's disease". Pharmacotherapy. 18 (2 Pt 2): 68–73, discussion 79–82. doi:10.1002/j.1875-9114.1998.tb03880.x (Tidak aktif 2020-03-15). PMID 9543467.CS1 maint: DOI inactive as of Mac 2020 (link)
- ^ "Evaluating Prescription Drugs Used to Treat: Alzheimer's Disease Comparing Effectiveness, Safety, and Price" (PDF). Consumer Reports Drug Effectiveness Review Project. Consumer Reports. May 2012. Diarkibkan daripada yang asal (PDF) pada 5 September 2012. Dicapai pada 1 May 2013.
- ^ a b c d Waldemar G, Dubois B, Emre M, Georges J, McKeith IG, Rossor M, Scheltens P, Tariska P, Winblad B (Januari 2007). "Recommendations for the diagnosis and management of Alzheimer's disease and other disorders associated with dementia: EFNS guideline". European Journal of Neurology. 14 (1): e1–26. doi:10.1111/j.1468-1331.2006.01605.x. PMID 17222085.
- ^ a b c Bäckman L, Jones S, Berger AK, Laukka EJ, Small BJ (September 2004). "Multiple cognitive deficits during the transition to Alzheimer's disease". Journal of Internal Medicine. 256 (3): 195–204. doi:10.1111/j.1365-2796.2004.01386.x. PMID 15324363.
- ^ Nygård L (2003). "Instrumental activities of daily living: a stepping-stone towards Alzheimer's disease diagnosis in subjects with mild cognitive impairment?". Acta Neurologica Scandinavica. Supplementum. 179 (s179): 42–6. doi:10.1034/j.1600-0404.107.s179.8.x. PMID 12603250.
- ^ a b Arnáiz E, Almkvist O (2003). "Neuropsychological features of mild cognitive impairment and preclinical Alzheimer's disease". Acta Neurologica Scandinavica. Supplementum. 179: 34–41. doi:10.1034/j.1600-0404.107.s179.7.x. PMID 12603249.
- ^ Landes AM, Sperry SD, Strauss ME, Geldmacher DS (Disember 2001). "Apathy in Alzheimer's disease". Journal of the American Geriatrics Society. 49 (12): 1700–7. doi:10.1046/j.1532-5415.2001.49282.x. PMID 11844006.
- ^ Murray ED, Buttner N, Price BH (2012). "Depression and Psychosis in Neurological Practice". Dalam Bradley WG, Daroff RB, Fenichel GM, Jankovic J (penyunting). Bradley's neurology in clinical practice (ed. 6th). Philadelphia, PA: Elsevier/Saunders. ISBN 978-1-4377-0434-1.
- ^ Grundman M, Petersen RC, Ferris SH, Thomas RG, Aisen PS, Bennett DA, dll. (Januari 2004). "Mild cognitive impairment can be distinguished from Alzheimer disease and normal aging for clinical trials". Archives of Neurology. 61 (1): 59–66. doi:10.1001/archneur.61.1.59. PMID 14732621.
- ^ a b c d e f g h i j k l m n o p q r s Förstl H, Kurz A (1999). "Clinical features of Alzheimer's disease". European Archives of Psychiatry and Clinical Neuroscience. 249 (6): 288–90. doi:10.1007/s004060050101. PMID 10653284.
- ^ Carlesimo GA, Oscar-Berman M (June 1992). "Memory deficits in Alzheimer's patients: a comprehensive review". Neuropsychology Review. 3 (2): 119–69. doi:10.1007/BF01108841. PMID 1300219.
- ^ Jelicic M, Bonebakker AE, Bonke B (1995). "Implicit memory performance of patients with Alzheimer's disease: a brief review". International Psychogeriatrics. 7 (3): 385–92. doi:10.1017/S1041610295002134. PMID 8821346.
- ^ a b Taler V, Phillips NA (July 2008). "Language performance in Alzheimer's disease and mild cognitive impairment: a comparative review". Journal of Clinical and Experimental Neuropsychology. 30 (5): 501–56. doi:10.1080/13803390701550128. PMID 18569251.
- ^ a b c Frank EM (September 1994). "Effect of Alzheimer's disease on communication function". Journal of the South Carolina Medical Association. 90 (9): 417–23. PMID 7967534.
- ^ Volicer L, Harper DG, Manning BC, Goldstein R, Satlin A (Mei 2001). "Sundowning and circadian rhythms in Alzheimer's disease". The American Journal of Psychiatry. 158 (5): 704–11. doi:10.1176/appi.ajp.158.5.704. PMID 11329390.
- ^ Gold DP, Reis MF, Markiewicz D, Andres D (Januari 1995). "When home caregiving ends: a longitudinal study of outcomes for caregivers of relatives with dementia". Journal of the American Geriatrics Society. 43 (1): 10–6. doi:10.1111/j.1532-5415.1995.tb06235.x. PMID 7806732.
- ^ "What We Know Today About Alzheimer's Disease". Alzheimer's Association. Diarkibkan daripada yang asal pada 7 October 2011. Dicapai pada 1 October 2011.
While scientists know Alzheimer's disease involves progressive brain cell failure, the reason cells fail isn't clear.
- ^ Reitz C, Mayeux R (April 2014). "Alzheimer disease: epidemiology, diagnostic criteria, risk factors and biomarkers". Biochemical Pharmacology. 88 (4): 640–51. doi:10.1016/j.bcp.2013.12.024. PMC 3992261. PMID 24398425.
- ^ Wilson RS, Barral S, Lee JH, Leurgans SE, Foroud TM, Sweet RA, Graff-Radford N, Bird TD, Mayeux R, Bennett DA (2011). "Heritability of different forms of memory in the Late Onset Alzheimer's Disease Family Study". Journal of Alzheimer's Disease. 23 (2): 249–55. doi:10.3233/JAD-2010-101515. PMC 3130303. PMID 20930268.
- ^ a b c Blennow K, de Leon MJ, Zetterberg H (July 2006). "Alzheimer's disease". Lancet. 368 (9533): 387–403. doi:10.1016/S0140-6736(06)69113-7. PMID 16876668.
- ^ a b Waring SC, Rosenberg RN (March 2008). "Genome-wide association studies in Alzheimer disease". Archives of Neurology. 65 (3): 329–34. doi:10.1001/archneur.65.3.329. PMID 18332245.
- ^ Selkoe DJ (June 1999). "Translating cell biology into therapeutic advances in Alzheimer's disease". Nature. 399 (6738 Suppl): A23–31. doi:10.1038/19866. PMID 10392577.
- ^ Borchelt DR, Thinakaran G, Eckman CB, Lee MK, Davenport F, Ratovitsky T, dll. (November 1996). "Familial Alzheimer's disease-linked presenilin 1 variants elevate Abeta1-42/1-40 ratio in vitro and in vivo". Neuron. 17 (5): 1005–13. doi:10.1016/S0896-6273(00)80230-5. PMID 8938131.
- ^ Kim, JH (December 2018). "Genetics of Alzheimer's Disease". Dementia and Neurocognitive Disorders. 17 (4): 131–36. doi:10.12779/dnd.2018.17.4.131. PMC 6425887. PMID 30906402.
- ^ Strittmatter WJ, Saunders AM, Schmechel D, Pericak-Vance M, Enghild J, Salvesen GS, Roses AD (Mac 1993). "Apolipoprotein E: high-avidity binding to beta-amyloid and increased frequency of type 4 allele in late-onset familial Alzheimer disease". Proceedings of the National Academy of Sciences of the United States of America. 90 (5): 1977–81. Bibcode:1993PNAS...90.1977S. doi:10.1073/pnas.90.5.1977. PMC 46003. PMID 8446617.
- ^ a b Mahley RW, Weisgraber KH, Huang Y (April 2006). "Apolipoprotein E4: a causative factor and therapeutic target in neuropathology, including Alzheimer's disease". Proceedings of the National Academy of Sciences of the United States of America. 103 (15): 5644–51. Bibcode:2006PNAS..103.5644M. doi:10.1073/pnas.0600549103. PMC 1414631. PMID 16567625.
- ^ Hall K, Murrell J, Ogunniyi A, Deeg M, Baiyewu O, Gao S, Gureje O, Dickens J, Evans R, Smith-Gamble V, Unverzagt FW, Shen J, Hendrie H (Januari 2006). "Cholesterol, APOE genotype, and Alzheimer disease: an epidemiologic study of Nigerian Yoruba". Neurology. 66 (2): 223–27. doi:10.1212/01.wnl.0000194507.39504.17. PMC 2860622. PMID 16434658.
- ^ Gureje O, Ogunniyi A, Baiyewu O, Price B, Unverzagt FW, Evans RM, dll. (Januari 2006). "APOE epsilon4 is not associated with Alzheimer's disease in elderly Nigerians". Annals of Neurology. 59 (1): 182–85. doi:10.1002/ana.20694. PMC 2855121. PMID 16278853.
- ^ a b Lambert JC, Ibrahim-Verbaas CA, Harold D, Naj AC, Sims R, Bellenguez C, dll. (December 2013). "Meta-analysis of 74,046 individuals identifies 11 new susceptibility loci for Alzheimer's disease". Nature Genetics. 45 (12): 1452–58. doi:10.1038/ng.2802. PMC 3896259. PMID 24162737.
- ^ Jonsson T, Stefansson H, Steinberg S, Jonsdottir I, Jonsson PV, Snaedal J, dll. (Januari 2013). "Variant of TREM2 associated with the risk of Alzheimer's disease". The New England Journal of Medicine (Original article). 368 (2): 107–16. doi:10.1056/NEJMoa1211103. PMC 3677583. PMID 23150908.
- ^ Guerreiro R, Wojtas A, Bras J, Carrasquillo M, Rogaeva E, Majounie E, dll. (Januari 2013). "TREM2 variants in Alzheimer's disease". The New England Journal of Medicine (Original article). 368 (2): 117–27. doi:10.1056/NEJMoa1211851. PMC 3631573. PMID 23150934.
- ^ Mukherjee S, Mez J, Trittschuh EH, Saykin AJ, Gibbons LE, Fardo DW, dll. (December 2018). "Genetic data and cognitively defined late-onset Alzheimer's disease subgroups". Molecular Psychiatry. doi:10.1038/s41380-018-0298-8. PMC 6548676. PMID 30514930.
- ^ Francis PT, Palmer AM, Snape M, Wilcock GK (February 1999). "The cholinergic hypothesis of Alzheimer's disease: a review of progress". Journal of Neurology, Neurosurgery, and Psychiatry. 66 (2): 137–47. doi:10.1136/jnnp.66.2.137. PMC 1736202. PMID 10071091.
- ^ Martorana A, Esposito Z, Koch G (August 2010). "Beyond the cholinergic hypothesis: do current drugs work in Alzheimer's disease?". CNS Neuroscience & Therapeutics. 16 (4): 235–45. doi:10.1111/j.1755-5949.2010.00175.x. PMC 6493875. PMID 20560995.
- ^ Hardy J, Allsop D (Oktober 1991). "Amyloid deposition as the central event in the aetiology of Alzheimer's disease". Trends in Pharmacological Sciences. 12 (10): 383–88. doi:10.1016/0165-6147(91)90609-V. PMID 1763432.
- ^ a b Mudher A, Lovestone S (Januari 2002). "Alzheimer's disease-do tauists and baptists finally shake hands?". Trends in Neurosciences. 25 (1): 22–26. doi:10.1016/S0166-2236(00)02031-2. PMID 11801334.
- ^ Nistor M, Don M, Parekh M, Sarsoza F, Goodus M, Lopez GE, Kawas C, Leverenz J, Doran E, Lott IT, Hill M, Head E (October 2007). "Alpha- and beta-secretase activity as a function of age and beta-amyloid in Down syndrome and normal brain". Neurobiology of Aging. 28 (10): 1493–506. doi:10.1016/j.neurobiolaging.2006.06.023. PMC 3375834. PMID 16904243.
- ^ Lott IT, Head E (March 2005). "Alzheimer disease and Down syndrome: factors in pathogenesis". Neurobiology of Aging. 26 (3): 383–89. doi:10.1016/j.neurobiolaging.2004.08.005. PMID 15639317.
- ^ Polvikoski T, Sulkava R, Haltia M, Kainulainen K, Vuorio A, Verkkoniemi A, Niinistö L, Halonen P, Kontula K (November 1995). "Apolipoprotein E, dementia, and cortical deposition of beta-amyloid protein". The New England Journal of Medicine. 333 (19): 1242–47. doi:10.1056/NEJM199511093331902. PMID 7566000.
- ^ Transgenic mice:
- Games D, Adams D, Alessandrini R, Barbour R, Berthelette P, Blackwell C, Carr T, Clemens J, Donaldson T, Gillespie F (Februari 1995). "Alzheimer-type neuropathology in transgenic mice overexpressing V717F beta-amyloid precursor protein". Nature. 373 (6514): 523–27. Bibcode:1995Natur.373..523G. doi:10.1038/373523a0. PMID 7845465.
- Masliah E, Sisk A, Mallory M, Mucke L, Schenk D, Games D (September 1996). "Comparison of neurodegenerative pathology in transgenic mice overexpressing V717F beta-amyloid precursor protein and Alzheimer's disease". The Journal of Neuroscience. 16 (18): 5795–811. doi:10.1523/JNEUROSCI.16-18-05795.1996. PMC 6578961. PMID 8795633.
- Hsiao K, Chapman P, Nilsen S, Eckman C, Harigaya Y, Younkin S, Yang F, Cole G (Oktober 1996). "Correlative memory deficits, Abeta elevation, and amyloid plaques in transgenic mice". Science. 274 (5284): 99–102. Bibcode:1996Sci...274...99H. doi:10.1126/science.274.5284.99. PMID 8810256.
- Lalonde R, Dumont M, Staufenbiel M, Sturchler-Pierrat C, Strazielle C (November 2002). "Spatial learning, exploration, anxiety, and motor coordination in female APP23 transgenic mice with the Swedish mutation". Brain Research. 956 (1): 36–44. doi:10.1016/S0006-8993(02)03476-5. PMID 12426044.
- ^ Holmes C, Boche D, Wilkinson D, Yadegarfar G, Hopkins V, Bayer A, Jones RW, Bullock R, Love S, Neal JW, Zotova E, Nicoll JA (July 2008). "Long-term effects of Abeta42 immunisation in Alzheimer's disease: follow-up of a randomised, placebo-controlled phase I trial". Lancet. 372 (9634): 216–23. doi:10.1016/S0140-6736(08)61075-2. PMID 18640458.
- ^ Lacor PN, Buniel MC, Furlow PW, Clemente AS, Velasco PT, Wood M, dll. (Januari 2007). "Abeta oligomer-induced aberrations in synapse composition, shape, and density provide a molecular basis for loss of connectivity in Alzheimer's disease". The Journal of Neuroscience. 27 (4): 796–807. doi:10.1523/JNEUROSCI.3501-06.2007. PMC 6672917. PMID 17251419.
- ^ Laurén J, Gimbel DA, Nygaard HB, Gilbert JW, Strittmatter SM (February 2009). "Cellular prion protein mediates impairment of synaptic plasticity by amyloid-beta oligomers". Nature. 457 (7233): 1128–32. Bibcode:2009Natur.457.1128L. doi:10.1038/nature07761. PMC 2748841. PMID 19242475.
- ^ a b Nikolaev A, McLaughlin T, O'Leary DD, Tessier-Lavigne M (February 2009). "APP binds DR6 to trigger axon pruning and neuron death via distinct caspases". Nature. 457 (7232): 981–89. Bibcode:2009Natur.457..981N. doi:10.1038/nature07767. PMC 2677572. PMID 19225519.
- ^ Tomiyama T (2010). "Involvement of beta-amyloid in the etiology of Alzheimer's disease". Brain Nerve. 62 (7): 691–699.
- ^ Tomiyama T, Nagata T, Shimada H, Teraoka R, Fukushima A, Kanemitsu H, Takuma H, Kuwano R, Imagawa M, Ataka S, Wada Y, Yoshioka E, Nishizaki T, Watanabe Y, Mori H (2008). "A new amyloid beta variant favoring oligomerization in Alzheimer's-type dementia". Ann Neurol. 63: 377–387. doi:10.1002/ana.21321.CS1 maint: multiple names: authors list (link)
- ^ Goedert M, Spillantini MG, Crowther RA (July 1991). "Tau proteins and neurofibrillary degeneration". Brain Pathology. 1 (4): 279–86. doi:10.1111/j.1750-3639.1991.tb00671.x. PMID 1669718.
- ^ Iqbal K, Alonso A, Chen S, Chohan MO, El-Akkad E, Gong CX, Khatoon S, Li B, Liu F, Rahman A, Tanimukai H, Grundke-Iqbal I (Januari 2005). "Tau pathology in Alzheimer disease and other tauopathies". Biochimica et Biophysica Acta. 1739 (2–3): 198–210. doi:10.1016/j.bbadis.2004.09.008. PMID 15615638.
- ^ Chun W, Johnson GV (January 2007). "The role of tau phosphorylation and cleavage in neuronal cell death". Frontiers in Bioscience. 12: 733–56. doi:10.2741/2097. PMID 17127334.
- ^ a b Kamer, Angela R.; Craig, Ronald G.; Dasanayake, Ananda P.; Brys, Miroslaw; Glodzik-Sobanska, Lidia; de Leon, Mony J. (July 2008). "Inflammation and Alzheimer's disease: Possible role of periodontal diseases". Alzheimer's & Dementia (dalam bahasa Inggeris). 4 (4): 242–250. doi:10.1016/j.jalz.2007.08.004. PMID 18631974.
- ^ Collins, Stephen M.; Surette, Michael; Bercik, Premysl (November 2012). "The interplay between the intestinal microbiota and the brain". Nature Reviews Microbiology (dalam bahasa Inggeris). 10 (11): 735–742. doi:10.1038/nrmicro2876. ISSN 1740-1526. PMID 23000955.
- ^ Deane R, Zlokovic BV (April 2007). "Role of the blood-brain barrier in the pathogenesis of Alzheimer's disease". Current Alzheimer Research. 4 (2): 191–97. doi:10.2174/156720507780362245. PMID 17430246.
- ^ Miklossy J (August 2011). "Alzheimer's disease - a neurospirochetosis. Analysis of the evidence following Koch's and Hill's criteria". Journal of Neuroinflammation. 8 (1): 90. doi:10.1186/1742-2094-8-90. PMC 3171359. PMID 21816039.
- ^ Allen, HB (27 Jun 2016). "Alzheimer's Disease: Assessing the Role of Spirochetes, Biofilms, the Immune System, and Amyloid-β with Regard to Potential Treatment and Prevention". Journal of Alzheimer's Disease. 53 (4): 1271–76. doi:10.3233/JAD-160388. PMC 5008232. PMID 27372648.
- ^ Xu H, Finkelstein DI, Adlard PA (12 June 2014). "Interactions of metals and Apolipoprotein E in Alzheimer's disease". Frontiers in Aging Neuroscience. 6: 121. doi:10.3389/fnagi.2014.00121. PMC 4054654. PMID 24971061.
Although we still do not know if the metal ion dyshomeostasis present in AD is a cause or consequence of the disease, there is a growing body of evidence showing a direct correlation between metal ions and key AD-related key proteins.
- ^ Su B, Wang X, Nunomura A, Moreira PI, Lee HG, Perry G, Smith MA, Zhu X (Disember 2008). "Oxidative stress signaling in Alzheimer's disease". Current Alzheimer Research. 5 (6): 525–32. doi:10.2174/156720508786898451. PMC 2780015. PMID 19075578.
- ^ Kastenholz B, Garfin DE, Horst J, Nagel KA (2009). "Plant metal chaperones: a novel perspective in dementia therapy". Amyloid. 16 (2): 81–83. doi:10.1080/13506120902879392. PMID 20536399.
- ^ "Aluminium and Alzheimer's disease". Facts about dementia. Alzheimer's Society. Diarkibkan daripada yang asal pada 27 Oktober 2005. Dicapai pada 14 Oktober 2005.
- ^ Bondy SC (Januari 2016). "Low levels of aluminum can lead to behavioral and morphological changes associated with Alzheimer's disease and age-related neurodegeneration". Neurotoxicology (Submitted manuscript). 52: 222–29. doi:10.1016/j.neuro.2015.12.002. PMID 26687397.
- ^ Kandimalla R, Vallamkondu J, Corgiat EB, Gill KD (Mac 2016). "Understanding Aspects of Aluminum Exposure in Alzheimer's Disease Development". Brain Pathology. 26 (2): 139–54. doi:10.1111/bpa.12333. PMID 26494454.
- ^ Santibáñez M, Bolumar F, García AM (November 2007). "Occupational risk factors in Alzheimer's disease: a review assessing the quality of published epidemiological studies". Occupational and Environmental Medicine. 64 (11): 723–32. doi:10.1136/oem.2006.028209. PMC 2078415. PMID 17525096.
- ^ a b Lidsky TI (May 2014). "Is the Aluminum Hypothesis dead?". Journal of Occupational and Environmental Medicine. 56 (5 Suppl): S73–79. doi:10.1097/jom.0000000000000063. PMC 4131942. PMID 24806729.
- ^ Yegambaram M, Manivannan B, Beach TG, Halden RU (2015). "Role of environmental contaminants in the etiology of Alzheimer's disease: a review". Current Alzheimer Research. 12 (2): 116–46. doi:10.2174/1567205012666150204121719. PMC 4428475. PMID 25654508.
- ^ Cataldo JK, Prochaska JJ, Glantz SA (2010). "Cigarette smoking is a risk factor for Alzheimer's Disease: an analysis controlling for tobacco industry affiliation". Journal of Alzheimer's Disease. 19 (2): 465–80. doi:10.3233/JAD-2010-1240. PMC 2906761. PMID 20110594.
- ^ Eikelenboom P, van Exel E, Hoozemans JJ, Veerhuis R, Rozemuller AJ, van Gool WA (2010). "Neuroinflammation - an early event in both the history and pathogenesis of Alzheimer's disease". Neuro-Degenerative Diseases. 7 (1–3): 38–41. doi:10.1159/000283480. PMID 20160456.
- ^ Moulton PV, Yang W (2012). "Air pollution, oxidative stress, and Alzheimer's disease". Journal of Environmental and Public Health (Review). 2012: 1–9. doi:10.1155/2012/472751. PMC 3317180. PMID 22523504.
- ^ Bartzokis G (August 2011). "Alzheimer's disease as homeostatic responses to age-related myelin breakdown". Neurobiology of Aging. 32 (8): 1341–71. doi:10.1016/j.neurobiolaging.2009.08.007. PMC 3128664. PMID 19775776.
- ^ Cai Z, Xiao M (2016). "Oligodendrocytes and Alzheimer's disease". The International Journal of Neuroscience. 126 (2): 97–104. doi:10.3109/00207454.2015.1025778. PMID 26000818.
- ^ a b c Reisberg B, Franssen EH, Hasan SM, Monteiro I, Boksay I, Souren LE, dll. (1999). "Retrogenesis: clinical, physiologic, and pathologic mechanisms in brain aging, Alzheimer's and other dementing processes". European Archives of Psychiatry and Clinical Neuroscience. 249 Suppl 3 (3): 28–36. doi:10.1007/pl00014170. PMID 10654097.
- ^ Alves GS, Oertel Knöchel V, Knöchel C, Carvalho AF, Pantel J, Engelhardt E, Laks J (2015). "Integrating retrogenesis theory to Alzheimer's disease pathology: insight from DTI-TBSS investigation of the white matter microstructural integrity". BioMed Research International. 2015: 291658. doi:10.1155/2015/291658. PMC 4320890. PMID 25685779.
- ^ Brenner Carson, Verna (2015). Caregiving for Alzheimer's Disease. New York: Springer New York Academy of Sciences. m/s. 1–9. ISBN 978-1-4939-2406-6.
- ^ Zis, Panagiotis; Hadjivassiliou, Marios (26 February 2019). "Treatment of Neurological Manifestations of Gluten Sensitivity and Coeliac Disease". Current Treatment Options in Neurology. 21 (3): 10. doi:10.1007/s11940-019-0552-7. PMID 30806821.
- ^ Makhlouf S, Messelmani M, Zaouali J, Mrissa R (2018). "Cognitive impairment in celiac disease and non-celiac gluten sensitivity: review of literature on the main cognitive impairments, the imaging and the effect of gluten free diet". Acta Neurol Belg (Review). 118 (1): 21–27. doi:10.1007/s13760-017-0870-z. PMID 29247390.
- ^ Wenk GL (2003). "Neuropathologic changes in Alzheimer's disease". The Journal of Clinical Psychiatry. 64 Suppl 9: 7–10. PMID 12934968.
- ^ Braak H, Del Tredici K (December 2012). "Where, when, and in what form does sporadic Alzheimer's disease begin?". Current Opinion in Neurology. 25 (6): 708–14. doi:10.1097/WCO.0b013e32835a3432. PMID 23160422.
- ^ Desikan RS, Cabral HJ, Hess CP, Dillon WP, Glastonbury CM, Weiner MW, Schmansky NJ, Greve DN, Salat DH, Buckner RL, Fischl B (Ogos 2009). "Automated MRI measures identify individuals with mild cognitive impairment and Alzheimer's disease". Brain. 132 (Pt 8): 2048–57. doi:10.1093/brain/awp123. PMC 2714061. PMID 19460794.
- ^ Moan R (20 Julai 2009). "MRI Software Accurately IDs Preclinical Alzheimer's Disease". Diagnostic Imaging. Diarkibkan daripada yang asal pada 16 May 2016. Dicapai pada 7 January 2013.
- ^ a b Tiraboschi P, Hansen LA, Thal LJ, Corey-Bloom J (June 2004). "The importance of neuritic plaques and tangles to the development and evolution of AD". Neurology. 62 (11): 1984–89. doi:10.1212/01.WNL.0000129697.01779.0A. PMID 15184601.
- ^ Bouras C, Hof PR, Giannakopoulos P, Michel JP, Morrison JH (1994). "Regional distribution of neurofibrillary tangles and senile plaques in the cerebral cortex of elderly patients: a quantitative evaluation of a one-year autopsy population from a geriatric hospital" (PDF). Cerebral Cortex. 4 (2): 138–50. doi:10.1093/cercor/4.2.138. PMID 8038565.
- ^ Kotzbauer PT, Trojanowsk JQ, Lee VM (October 2001). "Lewy body pathology in Alzheimer's disease". Journal of Molecular Neuroscience. 17 (2): 225–32. doi:10.1385/JMN:17:2:225. PMID 11816795.
- ^ Hashimoto M, Rockenstein E, Crews L, Masliah E (2003). "Role of protein aggregation in mitochondrial dysfunction and neurodegeneration in Alzheimer's and Parkinson's diseases". Neuromolecular Medicine. 4 (1–2): 21–36. doi:10.1385/NMM:4:1-2:21. PMID 14528050.
- ^ Priller C, Bauer T, Mitteregger G, Krebs B, Kretzschmar HA, Herms J (July 2006). "Synapse formation and function is modulated by the amyloid precursor protein". The Journal of Neuroscience. 26 (27): 7212–21. doi:10.1523/JNEUROSCI.1450-06.2006. PMC 6673945. PMID 16822978.
- ^ Turner PR, O'Connor K, Tate WP, Abraham WC (Mei 2003). "Roles of amyloid precursor protein and its fragments in regulating neural activity, plasticity and memory". Progress in Neurobiology. 70 (1): 1–32. doi:10.1016/S0301-0082(03)00089-3. PMID 12927332.
- ^ Hooper NM (April 2005). "Roles of proteolysis and lipid rafts in the processing of the amyloid precursor protein and prion protein". Biochemical Society Transactions. 33 (Pt 2): 335–38. doi:10.1042/BST0330335. PMID 15787600.
- ^ Ohnishi S, Takano K (Mac 2004). "Amyloid fibrils from the viewpoint of protein folding". Cellular and Molecular Life Sciences. 61 (5): 511–24. doi:10.1007/s00018-003-3264-8. PMID 15004691.
- ^ Hernández F, Avila J (September 2007). "Tauopathies". Cellular and Molecular Life Sciences. 64 (17): 2219–33. doi:10.1007/s00018-007-7220-x. PMID 17604998.
- ^ Sun W, Samimi H, Gamez M, Zare H, Frost B (Ogos 2018). "Pathogenic tau-induced piRNA depletion promotes neuronal death through transposable element dysregulation in neurodegenerative tauopathies". Nature Neuroscience. 21 (8): 1038–48. doi:10.1038/s41593-018-0194-1. PMC 6095477. PMID 30038280.
- ^ Van Broeck B, Van Broeckhoven C, Kumar-Singh S (2007). "Current insights into molecular mechanisms of Alzheimer disease and their implications for therapeutic approaches". Neuro-Degenerative Diseases. 4 (5): 349–65. doi:10.1159/000105156. PMID 17622778.
- ^ Huang Y, Mucke L (March 2012). "Alzheimer mechanisms and therapeutic strategies". Cell. 148 (6): 1204–22. doi:10.1016/j.cell.2012.02.040. PMC 3319071. PMID 22424230.
- ^ Yankner BA, Duffy LK, Kirschner DA (Oktober 1990). "Neurotrophic and neurotoxic effects of amyloid beta protein: reversal by tachykinin neuropeptides". Science. 250 (4978): 279–82. Bibcode:1990Sci...250..279Y. doi:10.1126/science.2218531. PMID 2218531.
- ^ Chen X, Yan SD (Disember 2006). "Mitochondrial Abeta: a potential cause of metabolic dysfunction in Alzheimer's disease". IUBMB Life. 58 (12): 686–94. doi:10.1080/15216540601047767. PMID 17424907.
- ^ Greig NH, Mattson MP, Perry T, Chan SL, Giordano T, Sambamurti K, Rogers JT, Ovadia H, Lahiri DK (Disember 2004). "New therapeutic strategies and drug candidates for neurodegenerative diseases: p53 and TNF-alpha inhibitors, and GLP-1 receptor agonists". Annals of the New York Academy of Sciences. 1035: 290–315. doi:10.1196/annals.1332.018. PMID 15681814.
- ^ Heneka MT, Carson MJ, El Khoury J, Landreth GE, Brosseron F, Feinstein DL, dll. (April 2015). "Neuroinflammation in Alzheimer's disease". The Lancet. Neurology. 14 (4): 388–405. doi:10.1016/S1474-4422(15)70016-5. PMC 5909703. PMID 25792098.
- ^ Tapia-Arancibia L, Aliaga E, Silhol M, Arancibia S (November 2008). "New insights into brain BDNF function in normal aging and Alzheimer disease". Brain Research Reviews. 59 (1): 201–20. doi:10.1016/j.brainresrev.2008.07.007. PMID 18708092.
- ^ Schindowski K, Belarbi K, Buée L (Februari 2008). "Neurotrophic factors in Alzheimer's disease: role of axonal transport". Genes, Brain, and Behavior. 7 (Suppl 1): 43–56. doi:10.1111/j.1601-183X.2007.00378.x. PMC 2228393. PMID 18184369.
- ^ Mendez MF (2006). "The accurate diagnosis of early-onset dementia". International Journal of Psychiatry in Medicine. 36 (4): 401–12. doi:10.2190/Q6J4-R143-P630-KW41. PMID 17407994.
- ^ Klafki HW, Staufenbiel M, Kornhuber J, Wiltfang J (November 2006). "Therapeutic approaches to Alzheimer's disease". Brain. 129 (Pt 11): 2840–55. doi:10.1093/brain/awl280. PMID 17018549.
- ^ Dementia: Quick Reference Guide (PDF). London: (UK) National Institute for Health and Clinical Excellence. November 2006. ISBN 978-1-84629-312-2. Diarkibkan daripada yang asal (PDF) pada 27 Februari 2008. Dicapai pada 22 February 2008.
- ^ Schroeter ML, Stein T, Maslowski N, Neumann J (Oktober 2009). "Neural correlates of Alzheimer's disease and mild cognitive impairment: a systematic and quantitative meta-analysis involving 1351 patients". NeuroImage. 47 (4): 1196–206. doi:10.1016/j.neuroimage.2009.05.037. PMC 2730171. PMID 19463961.
- ^ a b McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM (Julai 1984). "Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease". Neurology. 34 (7): 939–44. doi:10.1212/wnl.34.7.939. PMID 6610841.
- ^ Dubois B, Feldman HH, Jacova C, Dekosky ST, Barberger-Gateau P, Cummings J, dll. (Ogos 2007). "Research criteria for the diagnosis of Alzheimer's disease: revising the NINCDS-ADRDA criteria". The Lancet. Neurology. 6 (8): 734–46. doi:10.1016/S1474-4422(07)70178-3. PMID 17616482.
- ^ Blacker D, Albert MS, Bassett SS, Go RC, Harrell LE, Folstein MF (Disember 1994). "Reliability and validity of NINCDS-ADRDA criteria for Alzheimer's disease. The National Institute of Mental Health Genetics Initiative". Archives of Neurology. 51 (12): 1198–204. doi:10.1001/archneur.1994.00540240042014. PMID 7986174.
- ^ American Psychiatric Association (2000). Diagnostic and statistical manual of mental disorders: DSM-IV-TR (ed. 4th Edition Text Revision). Washington, DC: American Psychiatric Association. ISBN 978-0-89042-025-6.
- ^ Ito N (Mei 1996). "[Clinical aspects of dementia]". [Hokkaido Igaku Zasshi] the Hokkaido Journal of Medical Science (dalam bahasa Japanese). 71 (3): 315–20. PMID 8752526.CS1 maint: unrecognized language (link)
- ^ Tombaugh TN, McIntyre NJ (September 1992). "The mini-mental state examination: a comprehensive review". Journal of the American Geriatrics Society. 40 (9): 922–35. doi:10.1111/j.1532-5415.1992.tb01992.x. PMID 1512391.
- ^ Pasquier F (January 1999). "Early diagnosis of dementia: neuropsychology". Journal of Neurology. 246 (1): 6–15. doi:10.1007/s004150050299. PMID 9987708.
- ^ Harvey PD, Moriarty PJ, Kleinman L, Coyne K, Sadowsky CH, Chen M, Mirski DF (2005). "The validation of a caregiver assessment of dementia: the Dementia Severity Scale". Alzheimer Disease and Associated Disorders. 19 (4): 186–94. doi:10.1097/01.wad.0000189034.43203.60. PMID 16327345.
- ^ Antoine C, Antoine P, Guermonprez P, Frigard B (2004). "[Awareness of deficits and anosognosia in Alzheimer's disease]". L'Encephale (dalam bahasa French). 30 (6): 570–77. doi:10.1016/S0013-7006(04)95472-3. PMID 15738860.CS1 maint: unrecognized language (link)
- ^ Cruz VT, Pais J, Teixeira A, Nunes B (2004). "[The initial symptoms of Alzheimer disease: caregiver perception]". Acta Medica Portuguesa (dalam bahasa Portuguese). 17 (6): 435–44. PMID 16197855.CS1 maint: unrecognized language (link)
- ^ Clarfield AM (Oktober 2003). "The decreasing prevalence of reversible dementias: an updated meta-analysis". Archives of Internal Medicine. 163 (18): 2219–29. doi:10.1001/archinte.163.18.2219. PMID 14557220.
- ^ Sun X, Steffens DC, Au R, Folstein M, Summergrad P, Yee J, Rosenberg I, Mwamburi DM, Qiu WQ (Mei 2008). "Amyloid-associated depression: a prodromal depression of Alzheimer disease?". Archives of General Psychiatry. 65 (5): 542–50. doi:10.1001/archpsyc.65.5.542. PMC 3042807. PMID 18458206.
- ^ Geldmacher DS, Whitehouse PJ (Mei 1997). "Differential diagnosis of Alzheimer's disease". Neurology. 48 (5 Suppl 6): S2–9. doi:10.1212/WNL.48.5_Suppl_6.2S. PMID 9153154.
- ^ Potter GG, Steffens DC (Mei 2007). "Contribution of depression to cognitive impairment and dementia in older adults". The Neurologist. 13 (3): 105–17. doi:10.1097/01.nrl.0000252947.15389.a9. PMID 17495754.
- ^ Zhang S, Smailagic N, Hyde C, Noel-Storr AH, Takwoingi Y, McShane R, Feng J (Julai 2014). "(11)C-PIB-PET for the early diagnosis of Alzheimer's disease dementia and other dementias in people with mild cognitive impairment (MCI)". The Cochrane Database of Systematic Reviews (7): CD010386. doi:10.1002/14651858.CD010386.pub2. PMC 6464750. PMID 25052054.
- ^ Smailagic N, Vacante M, Hyde C, Martin S, Ukoumunne O, Sachpekidis C (Januari 2015). "¹⁸F-FDG PET for the early diagnosis of Alzheimer's disease dementia and other dementias in people with mild cognitive impairment (MCI)". The Cochrane Database of Systematic Reviews. 1: CD010632. doi:10.1002/14651858.CD010632.pub2. PMID 25629415.
- ^ a b c d Hsu D, Marshall GA (2017). "Primary and Secondary Prevention Trials in Alzheimer Disease: Looking Back, Moving Forward". Current Alzheimer Research. 14 (4): 426–40. doi:10.2174/1567205013666160930112125. PMC 5329133. PMID 27697063.
- ^ Patterson C, Feightner JW, Garcia A, Hsiung GY, MacKnight C, Sadovnick AD (Februari 2008). "Diagnosis and treatment of dementia: 1. Risk assessment and primary prevention of Alzheimer disease". CMAJ. 178 (5): 548–56. doi:10.1503/cmaj.070796. PMC 2244657. PMID 18299540.
- ^ Rosendorff C, Beeri MS, Silverman JM (2007). "Cardiovascular risk factors for Alzheimer's disease". The American Journal of Geriatric Cardiology. 16 (3): 143–49. doi:10.1111/j.1076-7460.2007.06696.x. PMID 17483665.
- ^ Ding, Jie; Davis-Plourde, Kendra L; Sedaghat, Sanaz; Tully, Phillip J; Wang, Wanmei; Phillips, Caroline; Pase, Matthew P; Himali, Jayandra J; Gwen Windham, B; Griswold, Michael; Gottesman, Rebecca; Mosley, Thomas H; White, Lon; Guðnason, Vilmundur; Debette, Stéphanie; Beiser, Alexa S; Seshadri, Sudha; Arfan Ikram, M; Meirelles, Osorio; Tzourio, Christophe; Launer, Lenore J (November 2019). "Antihypertensive medications and risk for incident dementia and Alzheimer's disease: a meta-analysis of individual participant data from prospective cohort studies". The Lancet Neurology. 19 (1): 61–70. doi:10.1016/S1474-4422(19)30393-X. PMID 31706889.
- ^ Reiss AB, Wirkowski E (2007). "Role of HMG-CoA reductase inhibitors in neurological disorders : progress to date". Drugs. 67 (15): 2111–20. doi:10.2165/00003495-200767150-00001. PMID 17927279.
- ^ Kuller LH (Ogos 2007). "Statins and dementia". Current Atherosclerosis Reports. 9 (2): 154–61. doi:10.1007/s11883-007-0012-9. PMID 17877925.
- ^ McGuinness B, Craig D, Bullock R, Malouf R, Passmore P (Julai 2014). "Statins for the treatment of dementia". The Cochrane Database of Systematic Reviews. 7 (7): CD007514. doi:10.1002/14651858.CD007514.pub3. PMID 25004278.
- ^ Szekely CA, Town T, Zandi PP (2007). NSAIDs for the chemoprevention of Alzheimer's disease. Subcellular Biochemistry. 42. m/s. 229–48. doi:10.1007/1-4020-5688-5_11. ISBN 978-1-4020-5687-1. PMID 17612054.
- ^ Hoozemans JJ, Veerhuis R, Rozemuller JM, Eikelenboom P (Februari 2011). "Soothing the inflamed brain: effect of non-steroidal anti-inflammatory drugs on Alzheimer's disease pathology". CNS & Neurological Disorders Drug Targets. 10 (1): 57–67. doi:10.2174/187152711794488665. PMID 21143138.
- ^ Marjoribanks J, Farquhar C, Roberts H, Lethaby A, Lee J (Januari 2017). "Long-term hormone therapy for perimenopausal and postmenopausal women". The Cochrane Database of Systematic Reviews. 1: CD004143. doi:10.1002/14651858.CD004143.pub5. PMC 6465148. PMID 28093732.
- ^ a b Stern Y (Julai 2006). "Cognitive reserve and Alzheimer disease". Alzheimer Disease and Associated Disorders. 20 (3 Suppl 2): S69–74. doi:10.1097/01.wad.0000213815.20177.19. PMID 16917199.
- ^ a b Paradise M, Cooper C, Livingston G (Februari 2009). "Systematic review of the effect of education on survival in Alzheimer's disease". International Psychogeriatrics. 21 (1): 25–32. doi:10.1017/S1041610208008053. PMID 19026089.
- ^ Neergaard, Lauran (19 February 2011). "Speaking 2 Languages May Delay Getting Alzheimer's". The Denver Post. Associated Press. Diarkibkan daripada yang asal pada 2 Mei 2014.
- ^ Cheng ST (September 2016). "Cognitive Reserve and the Prevention of Dementia: the Role of Physical and Cognitive Activities". Current Psychiatry Reports. 18 (9): 85. doi:10.1007/s11920-016-0721-2. PMC 4969323. PMID 27481112.
- ^ Farina N, Rusted J, Tabet N (Januari 2014). "The effect of exercise interventions on cognitive outcome in Alzheimer's disease: a systematic review". International Psychogeriatrics. 26 (1): 9–18. doi:10.1017/S1041610213001385. PMID 23962667.
- ^ a b c Hu N, Yu JT, Tan L, Wang YL, Sun L, Tan L (2013). "Nutrition and the risk of Alzheimer's disease". BioMed Research International (Review). 2013: 1–12. doi:10.1155/2013/524820. PMC 3705810. PMID 23865055.
- ^ Solfrizzi V, Panza F, Frisardi V, Seripa D, Logroscino G, Imbimbo BP, Pilotto A (Mei 2011). "Diet and Alzheimer's disease risk factors or prevention: the current evidence". Expert Review of Neurotherapeutics. 11 (5): 677–708. doi:10.1586/ern.11.56. PMID 21539488.
- ^ Kanoski SE, Davidson TL (April 2011). "Western diet consumption and cognitive impairment: links to hippocampal dysfunction and obesity". Physiology & Behavior (Review). 103 (1): 59–68. doi:10.1016/j.physbeh.2010.12.003. PMC 3056912. PMID 21167850.
- ^ Solfrizzi V, Capurso C, D'Introno A, Colacicco AM, Santamato A, Ranieri M, Fiore P, Capurso A, Panza F (Januari 2008). "Lifestyle-related factors in predementia and dementia syndromes". Expert Review of Neurotherapeutics. 8 (1): 133–58. doi:10.1586/14737175.8.1.133. PMID 18088206.
- ^ Santos C, Costa J, Santos J, Vaz-Carneiro A, Lunet N (2010). "Caffeine intake and dementia: systematic review and meta-analysis". Journal of Alzheimer's Disease. 20 Suppl 1: S187–204. doi:10.3233/JAD-2010-091387. PMID 20182026.
- ^ Nehlig A (Mac 2013). "The neuroprotective effects of cocoa flavanol and its influence on cognitive performance". British Journal of Clinical Pharmacology (Review). 75 (3): 716–27. doi:10.1111/j.1365-2125.2012.04378.x. PMC 3575938. PMID 22775434.
- ^ Stoclet JC, Schini-Kerth V (Mac 2011). "[Dietary flavonoids and human health]". Annales Pharmaceutiques Francaises. 69 (2): 78–90. doi:10.1016/j.pharma.2010.11.004. PMID 21440100.
- ^ Ono K, Yamada M (April 2012). "Vitamin A and Alzheimer's disease". Geriatrics & Gerontology International (Review). 12 (2): 180–88. doi:10.1111/j.1447-0594.2011.00786.x. PMID 22221326.
- ^ Lerner AJ, Gustaw-Rothenberg K, Smyth S, Casadesus G (Mac–April 2012). "Retinoids for treatment of Alzheimer's disease". BioFactors. 38 (2): 84–89. doi:10.1002/biof.196. PMID 22419567. Check date values in:
|date=(bantuan) - ^ Heo JH, Lee KM (Mac 2013). "The possible role of antioxidant vitamin C in Alzheimer's disease treatment and prevention". American Journal of Alzheimer's Disease and Other Dementias (Review). 28 (2): 120–25. doi:10.1177/1533317512473193. PMID 23307795.
- ^ Boothby LA, Doering PL (Disember 2005). "Vitamin C and vitamin E for Alzheimer's disease". The Annals of Pharmacotherapy. 39 (12): 2073–80. doi:10.1345/aph.1E495. PMID 16227450.
- ^ a b Farina N, Llewellyn D, Isaac MG, Tabet N (April 2017). "Vitamin E for Alzheimer's dementia and mild cognitive impairment". The Cochrane Database of Systematic Reviews. 4: CD002854. doi:10.1002/14651858.CD002854.pub5. PMC 6478142. PMID 28418065.
- ^ Loef M, Schrauzer GN, Walach H (2011). "Selenium and Alzheimer's disease: a systematic review". Journal of Alzheimer's Disease (Review). 26 (1): 81–104. doi:10.3233/JAD-2011-110414. PMID 21593562.
- ^ Loef M, von Stillfried N, Walach H (September 2012). "Zinc diet and Alzheimer's disease: a systematic review". Nutritional Neuroscience (Review). 15 (5): 2–12. doi:10.1179/1476830512Y.0000000010. PMID 22583839.
- ^ Avan A, Hoogenraad TU (2015). "Zinc and Copper in Alzheimer's Disease". Journal of Alzheimer's Disease (Review). 46 (1): 89–92. doi:10.3233/JAD-150186. PMID 25835420.
- ^ Malouf R, Grimley Evans J (Oktober 2008). "Folic acid with or without vitamin B12 for the prevention and treatment of healthy elderly and demented people". The Cochrane Database of Systematic Reviews (4): CD004514. doi:10.1002/14651858.CD004514.pub2. PMID 18843658.
- ^ Wald DS, Kasturiratne A, Simmonds M (Jun 2010). "Effect of folic acid, with or without other B vitamins, on cognitive decline: meta-analysis of randomized trials". The American Journal of Medicine. 123 (6): 522–527.e2. doi:10.1016/j.amjmed.2010.01.017. PMID 20569758.
- ^ Cunnane SC, Chouinard-Watkins R, Castellano CA, Barberger-Gateau P (Januari 2013). "Docosahexaenoic acid homeostasis, brain aging and Alzheimer's disease: Can we reconcile the evidence?". Prostaglandins, Leukotrienes, and Essential Fatty Acids. 88 (1): 61–70. doi:10.1016/j.plefa.2012.04.006. PMID 22575581.
- ^ Burckhardt M, Herke M, Wustmann T, Watzke S, Langer G, Fink A (April 2016). "Omega-3 fatty acids for the treatment of dementia". The Cochrane Database of Systematic Reviews. 4: CD009002. doi:10.1002/14651858.CD009002.pub3. PMC 7117565. PMID 27063583.
- ^ Hamaguchi T, Ono K, Yamada M (Oktober 2010). "REVIEW: Curcumin and Alzheimer's disease". CNS Neuroscience & Therapeutics (review). 16 (5): 285–97. doi:10.1111/j.1755-5949.2010.00147.x. PMC 6493893. PMID 20406252.
- ^ Birks J, Grimley Evans J (Januari 2009). "Ginkgo biloba for cognitive impairment and dementia". The Cochrane Database of Systematic Reviews (1): CD003120. doi:10.1002/14651858.CD003120.pub3. PMID 19160216.
- ^ Krishnan S, Cairns R, Howard R (April 2009). Krishnan S (penyunting). "Cannabinoids for the treatment of dementia". The Cochrane Database of Systematic Reviews (2): CD007204. doi:10.1002/14651858.CD007204.pub2. PMC 7197039. PMID 19370677.
- ^ Bilkei-Gorzo A (Disember 2012). "The endocannabinoid system in normal and pathological brain ageing". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 367 (1607): 3326–41. doi:10.1098/rstb.2011.0388. PMC 3481530. PMID 23108550.
- ^ a b c Birks JS, Harvey RJ (June 2018). "Donepezil for dementia due to Alzheimer's disease". The Cochrane Database of Systematic Reviews. 6: CD001190. doi:10.1002/14651858.CD001190.pub3. PMC 6513124. PMID 29923184.
- ^ a b Birks JS, Grimley Evans J (April 2015). Birks JS (penyunting). "Rivastigmine for Alzheimer's disease". The Cochrane Database of Systematic Reviews (4): CD001191. doi:10.1002/14651858.CD001191.pub3. PMID 25858345.
- ^ Fink, Howard A.; Linskens, Eric J.; MacDonald, Roderick; Silverman, Pombie C.; McCarten, J. Riley; Talley, Kristine M.C.; Forte, Mary L.; Desai, Priyanka J.; Nelson, Victoria A.; Miller, Margaret A.; Hemmy, Laura S.; Brasure, Michelle; Taylor, Brent C.; Ng, Weiwen; Ouellette, Jeannine M.; Sheets, Kerry M.; Wilt, Timothy J.; Butler, Mary (28 April 2020). "Benefits and Harms of Prescription Drugs and Supplements for Treatment of Clinical Alzheimer-Type Dementia". Annals of Internal Medicine. 172 (10): 656–668. doi:10.7326/M19-3887. PMID 32340037.
- ^ Geula C, Mesulam MM (1995). "Cholinesterases and the pathology of Alzheimer disease". Alzheimer Disease and Associated Disorders. 9 Suppl 2: 23–28. doi:10.1097/00002093-199501002-00005. PMID 8534419.
- ^ Stahl SM (November 2000). "The new cholinesterase inhibitors for Alzheimer's disease, Part 2: illustrating their mechanisms of action". The Journal of Clinical Psychiatry. 61 (11): 813–14. doi:10.4088/JCP.v61n1101. PMID 11105732.
- ^ a b Birks J (January 2006). Birks J (penyunting). "Cholinesterase inhibitors for Alzheimer's disease". The Cochrane Database of Systematic Reviews (1): CD005593. doi:10.1002/14651858.CD005593. PMID 16437532.
- ^ Raschetti R, Albanese E, Vanacore N, Maggini M (November 2007). "Cholinesterase inhibitors in mild cognitive impairment: a systematic review of randomised trials". PLOS Medicine. 4 (11): e338. doi:10.1371/journal.pmed.0040338. PMC 2082649. PMID 18044984.
- ^ Alldredge BK, Corelli RL, Ernst ME, Guglielmo BJ, Jacobson PA, Kradjan WA, Williams BR (2013). Applied therapeutics : the clinical use of drugs (ed. 10th). Baltimore: Wolters Kluwer Health/Lippincott Williams & Wilkins. m/s. 2385. ISBN 978-1-60913-713-7.
- ^ a b Lipton SA (Februari 2006). "Paradigm shift in neuroprotection by NMDA receptor blockade: memantine and beyond". Nature Reviews. Drug Discovery. 5 (2): 160–70. doi:10.1038/nrd1958. PMID 16424917.
- ^ "Memantine". US National Library of Medicine (Medline). 4 Januari 2004. Diarkibkan daripada yang asal pada 22 February 2010. Dicapai pada 3 Februari 2010.
- ^ McShane R, Westby MJ, Roberts E, Minakaran N, Schneider L, Farrimond LE, Maayan N, Ware J, Debarros J (Mei 2019). "Memantine for dementia". The Cochrane Database of Systematic Reviews. 3 (3): CD003154. doi:10.1002/14651858.CD003154.pub6. PMC 6425228. PMID 30891742.
- ^ "Namenda prescribing information" (PDF). Forest Pharmaceuticals. Diarkibkan daripada yang asal (PDF) pada 27 Februari 2008. Dicapai pada 19 Februari 2008. (primary source)
- ^ Raina P, Santaguida P, Ismaila A, Patterson C, Cowan D, Levine M, Booker L, Oremus M (Mac 2008). "Effectiveness of cholinesterase inhibitors and memantine for treating dementia: evidence review for a clinical practice guideline". Annals of Internal Medicine. 148 (5): 379–97. doi:10.7326/0003-4819-148-5-200803040-00009. PMID 18316756.
- ^ Ballard C, Waite J (Januari 2006). Ballard CG (penyunting). "The effectiveness of atypical antipsychotics for the treatment of aggression and psychosis in Alzheimer's disease". The Cochrane Database of Systematic Reviews (1): CD003476. doi:10.1002/14651858.CD003476.pub2. PMID 16437455.
- ^ Ballard C, Hanney ML, Theodoulou M, Douglas S, McShane R, Kossakowski K, Gill R, Juszczak E, Yu LM, Jacoby R (Februari 2009). "The dementia antipsychotic withdrawal trial (DART-AD): long-term follow-up of a randomised placebo-controlled trial". The Lancet Neurology. 8 (2): 151–57. doi:10.1016/S1474-4422(08)70295-3. PMID 19138567. Rumusan ringkasan.
- ^ Declercq T, Petrovic M, Azermai M, Vander Stichele R, De Sutter AI, van Driel ML, Christiaens T (Mac 2013). "Withdrawal versus continuation of chronic antipsychotic drugs for behavioural and psychological symptoms in older people with dementia" (PDF). The Cochrane Database of Systematic Reviews. 3 (3): CD007726. doi:10.1002/14651858.CD007726.pub2. hdl:1854/LU-3109108. PMID 23543555.
- ^ Li J, Wu HM, Zhou RL, Liu GJ, Dong BR (April 2008). Wu HM (penyunting). "Huperzine A for Alzheimer's disease". The Cochrane Database of Systematic Reviews (2): CD005592. doi:10.1002/14651858.CD005592.pub2. PMID 18425924.
- ^ a b c d e f Rabins PV, Blacker D, Rovner BW, Rummans T, Schneider LS, Tariot PN, dll. (Steering Committee on Practice Guidelines) (Disember 2007). "American Psychiatric Association practice guideline for the treatment of patients with Alzheimer's disease and other dementias. Second edition". The American Journal of Psychiatry. 164 (12 Suppl): 5–56. PMID 18340692.
- ^ Bottino CM, Carvalho IA, Alvarez AM, Avila R, Zukauskas PR, Bustamante SE, dll. (December 2005). "Cognitive rehabilitation combined with drug treatment in Alzheimer's disease patients: a pilot study". Clinical Rehabilitation. 19 (8): 861–69. doi:10.1191/0269215505cr911oa. PMID 16323385.
- ^ Doody RS, Stevens JC, Beck C, Dubinsky RM, Kaye JA, Gwyther L, dll. (May 2001). "Practice parameter: management of dementia (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology". Neurology. 56 (9): 1154–66. doi:10.1212/WNL.56.9.1154. PMID 11342679.
- ^ Hermans DG, Htay UH, McShane R (Januari 2007). "Non-pharmacological interventions for wandering of people with dementia in the domestic setting". The Cochrane Database of Systematic Reviews (1): CD005994. doi:10.1002/14651858.CD005994.pub2. PMC 6669244. PMID 17253573.
- ^ Robinson L, Hutchings D, Dickinson HO, Corner L, Beyer F, Finch T, Hughes J, Vanoli A, Ballard C, Bond J (Januari 2007). "Effectiveness and acceptability of non-pharmacological interventions to reduce wandering in dementia: a systematic review". International Journal of Geriatric Psychiatry. 22 (1): 9–22. doi:10.1002/gps.1643. PMID 17096455.
- ^ Abraha I, Rimland JM, Trotta FM, Dell'Aquila G, Cruz-Jentoft A, Petrovic M, Gudmundsson A, Soiza R, O'Mahony D, Guaita A, Cherubini A (Mac 2017). "Systematic review of systematic reviews of non-pharmacological interventions to treat behavioural disturbances in older patients with dementia. The SENATOR-OnTop series". BMJ Open. 7 (3): e012759. doi:10.1136/bmjopen-2016-012759. PMC 5372076. PMID 28302633.
- ^ Chung JC, Lai CK, Chung PM, French HP (2002). "Snoezelen for dementia". The Cochrane Database of Systematic Reviews (4): CD003152. doi:10.1002/14651858.CD003152. PMID 12519587.
- ^ Woods B, O'Philbin L, Farrell EM, Spector AE, Orrell M (March 2018). "Reminiscence therapy for dementia". The Cochrane Database of Systematic Reviews. 3: CD001120. doi:10.1002/14651858.CD001120.pub3. PMC 6494367. PMID 29493789.
- ^ Zetteler J (November 2008). "Effectiveness of simulated presence therapy for individuals with dementia: a systematic review and meta-analysis". Aging & Mental Health. 12 (6): 779–85. doi:10.1080/13607860802380631. PMID 19023729.
- ^ Neal M, Barton Wright P (2003). Neal M (penyunting). "Validation therapy for dementia". The Cochrane Database of Systematic Reviews (3): CD001394. doi:10.1002/14651858.CD001394. PMID 12917907.
- ^ Chung JC, Lai CK, Chung PM, French HP (2002). Chung JC (penyunting). "Snoezelen for dementia". The Cochrane Database of Systematic Reviews (4): CD003152. doi:10.1002/14651858.CD003152. PMID 12519587. (up to date as of 2009)
- ^ Spector A, Thorgrimsen L, Woods B, Royan L, Davies S, Butterworth M, Orrell M (September 2003). "Efficacy of an evidence-based cognitive stimulation therapy programme for people with dementia: randomised controlled trial". The British Journal of Psychiatry. 183 (3): 248–54. doi:10.1192/bjp.183.3.248. PMID 12948999.
- ^ Gitlin LN, Corcoran M, Winter L, Boyce A, Hauck WW (Februari 2001). "A randomized, controlled trial of a home environmental intervention: effect on efficacy and upset in caregivers and on daily function of persons with dementia". The Gerontologist. 41 (1): 4–14. doi:10.1093/geront/41.1.4. PMID 11220813.
- ^ Gitlin LN, Hauck WW, Dennis MP, Winter L (Mac 2005). "Maintenance of effects of the home environmental skill-building program for family caregivers and individuals with Alzheimer's disease and related disorders". The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 60 (3): 368–74. doi:10.1093/gerona/60.3.368. PMID 15860476.
- ^ "Treating Behavioral and Psychiatric Symptoms". Alzheimer's Association. 2006. Diarkibkan daripada yang asal pada 25 September 2006. Dicapai pada 25 September 2006.
- ^ Dunne TE, Neargarder SA, Cipolloni PB, Cronin-Golomb A (August 2004). "Visual contrast enhances food and liquid intake in advanced Alzheimer's disease". Clinical Nutrition. 23 (4): 533–38. doi:10.1016/j.clnu.2003.09.015. PMID 15297089.
- ^ Dudek, Susan G. (2007). Nutrition Essentials for Nursing Practice. Hagerstown, Maryland: Lippincott Williams & Wilkins. m/s. 360. ISBN 978-0-7817-6651-7. Dicapai pada 19 Ogos 2008. Unknown parameter
|name-list-format=ignored (bantuan) - ^ Dennehy C (2006). "Analysis of patients' rights: dementia and PEG insertion". British Journal of Nursing. 15 (1): 18–20. doi:10.12968/bjon.2006.15.1.20303. PMID 16415742.
- ^ Chernoff R (April 2006). "Tube feeding patients with dementia". Nutrition in Clinical Practice. 21 (2): 142–46. doi:10.1177/0115426506021002142. PMID 16556924.
- ^ Gambassi G, Landi F, Lapane KL, Sgadari A, Mor V, Bernabei R (July 1999). "Predictors of mortality in patients with Alzheimer's disease living in nursing homes". Journal of Neurology, Neurosurgery, and Psychiatry. 67 (1): 59–65. doi:10.1136/jnnp.67.1.59. PMC 1736445. PMID 10369823.
- ^ Medical issues:
- Head B (January 2003). "Palliative care for persons with dementia". Home Healthcare Nurse. 21 (1): 53–60, quiz 61. doi:10.1097/00004045-200301000-00012. PMID 12544465.
- Friedlander AH, Norman DC, Mahler ME, Norman KM, Yagiela JA (September 2006). "Alzheimer's disease: psychopathology, medical management and dental implications". Journal of the American Dental Association. 137 (9): 1240–51. doi:10.14219/jada.archive.2006.0381. PMID 16946428.
- Belmin J (2007). "Practical guidelines for the diagnosis and management of weight loss in Alzheimer's disease: a consensus from appropriateness ratings of a large expert panel". The Journal of Nutrition, Health & Aging. 11 (1): 33–37. PMID 17315078.
- McCurry SM, Gibbons LE, Logsdon RG, Vitiello M, Teri L (October 2003). "Training caregivers to change the sleep hygiene practices of patients with dementia: the NITE-AD project". Journal of the American Geriatrics Society. 51 (10): 1455–60. doi:10.1046/j.1532-5415.2003.51466.x. PMID 14511168.
- Perls TT, Herget M (December 1995). "Higher respiratory infection rates on an Alzheimer's special care unit and successful intervention". Journal of the American Geriatrics Society. 43 (12): 1341–44. doi:10.1111/j.1532-5415.1995.tb06611.x. PMID 7490383.
- ^ Shega JW, Levin A, Hougham GW, Cox-Hayley D, Luchins D, Hanrahan P, Stocking C, Sachs GA (April 2003). "Palliative Excellence in Alzheimer Care Efforts (PEACE): a program description". Journal of Palliative Medicine. 6 (2): 315–20. doi:10.1089/109662103764978641. PMID 12854952.
- ^ a b Zanetti O, Solerte SB, Cantoni F (2009). "Life expectancy in Alzheimer's disease (AD)". Archives of Gerontology and Geriatrics. 49 Suppl 1: 237–43. doi:10.1016/j.archger.2009.09.035. PMID 19836639.
- ^ a b Mölsä PK, Marttila RJ, Rinne UK (Mac 1995). "Long-term survival and predictors of mortality in Alzheimer's disease and multi-infarct dementia". Acta Neurologica Scandinavica. 91 (3): 159–64. doi:10.1111/j.1600-0404.1995.tb00426.x. PMID 7793228.
- ^ Bowen JD, Malter AD, Sheppard L, Kukull WA, McCormick WC, Teri L, Larson EB (August 1996). "Predictors of mortality in patients diagnosed with probable Alzheimer's disease". Neurology. 47 (2): 433–39. doi:10.1212/wnl.47.2.433. PMID 8757016.
- ^ Larson EB, Shadlen MF, Wang L, McCormick WC, Bowen JD, Teri L, Kukull WA (April 2004). "Survival after initial diagnosis of Alzheimer disease". Annals of Internal Medicine. 140 (7): 501–09. doi:10.7326/0003-4819-140-7-200404060-00008. PMID 15068977.
- ^ Jagger C, Clarke M, Stone A (January 1995). "Predictors of survival with Alzheimer's disease: a community-based study". Psychological Medicine. 25 (1): 171–77. doi:10.1017/S0033291700028191. PMID 7792352.
- ^ Dodge HH, Shen C, Pandav R, DeKosky ST, Ganguli M (Februari 2003). "Functional transitions and active life expectancy associated with Alzheimer disease". Archives of Neurology. 60 (2): 253–59. doi:10.1001/archneur.60.2.253. PMID 12580712.
- ^ a b Ganguli M, Dodge HH, Shen C, Pandav RS, DeKosky ST (May 2005). "Alzheimer disease and mortality: a 15-year epidemiological study". Archives of Neurology. 62 (5): 779–84. doi:10.1001/archneur.62.5.779. PMID 15883266.