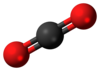
Karbon dioksida

| |||
| |||
| Nama | |||
|---|---|---|---|
Nama lain
| |||
| Pengecam | |||
Imej model 3D Jmol
|
|||
| 3DMet | |||
| 1900390 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.004.271 | ||
| Nombor EC |
| ||
| Nombor E | E290 (bahan pengawet) | ||
| 989 | |||
| KEGG | |||
| MeSH | Carbon+dioxide | ||
PubChem CID
|
|||
| Nombor RTECS |
| ||
| UNII | |||
| Nombor PBB | 1013 (gas), 1845 (solid) | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| CO2 | |||
| Jisim molar | 44.01 g·mol−1 | ||
| Rupa bentuk | Gas tidak berwarna | ||
| Bau |
| ||
| Ketumpatan |
| ||
| Takat lebur | −56.6 °C; −69.8 °F; 216.6 K (titik tigaan at 5.1 atm) | ||
| Titik genting (T, P) | 31.1 °C (304.2 K), 7.38 megapascal (73.8 bar) | ||
| −78.5 °C; −109.2 °F; 194.7 K (1 atm) | |||
| 1.45 g/L pada 25 °C (77 °F), 100 kPa | |||
| Tekanan wap | 5.73 MPa (20 °C) | ||
| Keasidan (pKa) | 6.35, 10.33 | ||
| −20.5·10−6 cm3/mol | |||
| Kekonduksian haba | 0.01662 W·m-1·K-1 (300 K)[2] | ||
Indeks biasan (nD)
|
1.00045 | ||
| Kelikatan |
| ||
| Momen dwikutub | 0 D | ||
| Struktur | |||
| Struktur kristal | Trigon | ||
| Bentuk molekul | Linear | ||
| Termokimia | |||
| Muatan haba tentu, C | 37.135 J/K·mol | ||
| Entropi molar piawai S |
214 J·mol−1·K−1 | ||
Entalpi pembentukan
piawai (ΔfH⦵298) |
−393.5 kJ·mol−1 | ||
| Farmakologi | |||
| Kod ATC | V03AN02 | ||
| Bahaya | |||
| MSDS | Sigma-Aldrich | ||
| NFPA 704 (berlian api) | |||
| Dos maut (LD) atau kepekatan dos maut (LC) | |||
LCLo (paling rendah diketahui)
|
90,000 ppm (manusia, 5 min)[5] | ||
| NIOSH (Had pendedahan kesihatan AS): | |||
PEL (Dibenarkan)
|
TWA 5000 ppm (9000 mg/m3)[4] | ||
REL (Disyorkan)
|
TWA 5000 ppm (9000 mg/m3), ST 30,000 ppm (54,000 mg/m3)[4] | ||
IDLH (Bahaya serta-merta)
|
40,000 ppm[4] | ||
| Sebatian berkaitan | |||
Anion lain
|
|||
Kation lain
|
|||
oksokarbon lain berkaitan
|
|||
Sebatian berkaitan
|
|||
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |||
| | |||
| Rujukan kotak info | |||
Karbon dioksida adalah gas atmosphera yang terdiri daripada satu atom karbon dan dua atom oksigen. Karbon dioksida merupakan sebatian kimia yang dikenali ramai, ia biasanya dikenali dengan formulanya CO2.
Karbon dioksida terhasil daripada pembakaran bahan organik sekiranya cukup oksigen hadir. Ia juga dihasilkan oleh pelbagai mikroorganisma hasil penapaian dan pernafasan selular. Tumbuhan menggunakan karbon dioksida semasa fotosintesis, menggunakan kedua-dua karbon karbon dioksida dan oksigen untuk membina karbohidrat. Tambahan lagi, tumbuhan membebaskan oksigen ke atmosphera di mana ia akhirnya digunakan untuk pernafasan oleh organisma heterotrophik, membentuk kitaran. Kehadirannya di atmosfera Bumi pada kepekatan rendah dan bertindak sebagai gas rumah hijau. Ia merupakan komponen utama kitaran karbon.
Ciri-ciri kimia dan fizikal[sunting | sunting sumber]
Karbon dioksida merupakan gas tanpa warna yang, apabila dihidu pada dos yang tinggi (aktiviti berbahaya disebabkan risiko sesak nafas), menghasilkan rasa masam dalam mulut and rasa menyengat di hidung dan tekak. Kesan ini disebabkan oleh gas melarut dalam selaput mukus dan air liur, membentuk larutan cair asid karbonik. Kepadatannya pada 25 °C adalah 1.98 kg/m3, sekitar 1.5 kali ganda udara. Molekul karbon dioksida (O=C=O) terdiri daripada dua ikatan berkembar dan mempunyai bentuk linear (lurus). Ia tidak mempunyai dipolar eletrik. Apabila teroksida sepenuhnya, ia tidak aktif dan tidak mudah terbakar.
Pada suhu bawah -78 °C, karbon dioksida terpeluwap menjadi ketulan putih yang dikenali sebagai ais kering. Karbon dioksida cair hanya terbentuk pada tekanan melebihi 5.1 atm; pada tekanan biasa, ia bertukar antara bentuk gas dan pepejal secara langsung melalui proses yang dikenali sebagai pemejalwapan.
Air akan meresap karbon dioksida sama banyak dengan isipadanya, dan lebih banyak lagi bawah tekanan. Sekitar 1% daripada karbon dioksida terlarut bertukar menjadi asid karbonik. Asid karbonik seterusnya berpisah sebahagiannya untuk membentuk bikarbonat dan ion karbonat.
Ujian bagi gas ini[sunting | sunting sumber]
Apabila lidi menyala dimasukkan kedalam tabung uji mengandungi gas karbon dioksida, ia padam serta merta, kerana karbon dioksida tidak membantu pembakaran. Untuk ujuan lanjut, karbon dioksida boleh dialirkan melalui larutan kalsium hidroksida. Larutan kalsium hidroksida bertukar menjadi keruh disebabkan pembentukan kalsium karbonat.
Kegunaan[sunting | sunting sumber]
Karbon dioksida cair dan pepejal merupakan bahan penyejuk penting, terutamanya dalam industri makanan, dimana ia digunakan semasa pengangkutan dan penyimpanan aiskrim dan makanan beku yang lain.
Karbon dioksida digunakan bagi membentuk minuman ringan berkarbonat dan air berkarbonat. Secara tradisi, karbonat dalam bir dan wain berkilau terhasil daripada penapaian semulajadi, tetapi sebahagian pengilang menambah karbonat kedalam minuman ini secara buatan.
Agen penaik yang digunakan untuk memasak menghasilkan karbon dioksida menyebabkan doh naik. Yis roti menghasilkan karbon dioksida melalui penapaian doh, sementara penaik kimia seperti (baking powder) dan (baking soda) membebaskan karbon dioksida apabila dipanaskan atau terdedah kepada asid. Karbon dioksida sering digunakan sebagai gas tekanan yang murah dan tidak mudah terbakar. Jaket keselamatan sering kali mempunyai karbon dioksida mampat untuk pengambangan pantas. Kapsul besi juga dijual sebagai bekalan gas mampat bagi pistol udara, penanda bola cat (paintball), dan bagi menghasilkan air berkarbonat - seltzer. Pengelowapan cecair CO2 juga digunakan bagi bahan peletup dalam lombong arang batu.
Karbon dioksida memadamkan api, dan juga sebahagian alat pemadam api (fire extinguisher), terutamanya direka bagi api eletrik, mengandungi cecair karbon dioksida bawah tekanan. Karbon dioksida juga digunakan di atmosphera sebagai kimpalan - welding, walaupun dalam gerbang kimpalan - welding arc, ia bertindak balas kepada pengoksidaan kebanyakan logam. Kegunaan dalam industri kereta juga biasa walaupun terdapat banyak bukti bahawa kimpalan menggunakan karbon dioksida adalah rapuh berbanding yang dilakukan dalam atmosphera lebih stabil - inert, dan kimpalan sedemikian merosot semakin lama akibat pembentukan asid karbonik. Ia digunakan sebagai gas pengimpalan kerana ia lebuh murah berbanding gas nadir lain seperti argon atau helium.
Cecair karbon dioksida adalah pelarut yang baik bagi kebanyakan sebatian organik. Ia mula mendapat perhatian dalam farmaseutikal dan kilang pemprosesan kimia yang lain sebagai pilihan kurang beracun (toksik) berbanding pelarut tradisi lain seperti organoklorida.
Tumbuhan memerlukan karbon dioksida untuk menjalani fotosintesis, dan gas rumah hijau mungkin mengkayakan atmosphera mereka dengan CO2 tambahan merangsang pertumbuhan tanaman. Ia telah dicadangkan bahawa karbon dioksida daripada penghasilan tenaga dipam kedalam kolam untuk membiak alga yang kemudiannya boleh ditukar menjadi bahan api biodiesel. Paras tinggi karbon dioksida dalam atmosphera menghapuskan kebanyakan serangga perosak dengan berkesan. Kesan rumah hijau perlu meningkatkan paras CO2 sehingga 10,000 ppm (1%) untuk selama beberapa jam untuk menghapuskan serangga perosak seperti whitefly, labah-labah mites, dan yang lain.
Di pawagam, air batu kering digunakan bagi menghasilkan kesan khas kabus: apabila air batu kering ditambah kepada air, penyejatan campuran CO2 dan udara lembap sejuk terpeluwap sebagai kabus. Lihat juga mesin kabus.
Air batu kering juga digunakan sebagai pembersih: menembakkan serpihan halus air batu kering kepada permukaan menyejukkan kotoran dan menyebabkan ia melantun keluar.
Dalam perubatan, sehingga 5% karbon dioksida ditambah kepada oksigen tulen digunakan dalam perubatan, sebagai simulasi pernafasan selepas apnea dan untuk mengstabilkan imbangan O2/CO2 dalam darah.
Laser gas pengilangan biasa, laser karbon dioksida, menggunakan karbon dioksida sebagai perantaraan.
Karbon dioksida biasanya disuntik masuk kedalam atau bersebelahan untuk menghasilkan telaga minyak. Ia akan bertindak sebagai agen tekanan dan apabila ia melarut kedalam minyak mentah bawah tanah akan mengurangkan kepekatan minyak mentah dengan banyaknya, membolehkan minyak mengalir lebih pantas melalui tanah ke telaga pengumpul. Dalam lapangan minyak yang matang jaringan paip yang meluas digunakan bagi membawa karbon dioksida ke titik suntikan.
Biologi[sunting | sunting sumber]
Karbon dioksida adalah hasil perkumuhan dalam organisma yang mendapat tenaga daripada penguraian gula atau lemak dengan oksigen sebagai sebahagian daripada metabolisma mereka, dalam proses yang dikenali pernafasan selular. Ini termasuk semua tumbuhan, haiwan, kebanyakan fungi dan sebahagian bakterium. Dalah haiwan peringkat tinggi, karbon dioksida diangkut melalui darah (di mana kebanyakkannya berada dalam larutan) daripada tisu badan ke paru-paru di mana ia disingkirkan.
Kandungan karbon dioksida dalam udara segar adalah kurang daripada 1% (sekitar 350 ppm), dalam udara dihembus keluar sekitar 4.5%. Apabila dihidu dalam kepekatan tinggi (sekitar 5% dari isipadu), ia adalah beracun kepada manusia dan haiwan lain. Hemoglobin, molekul utama dalam sel darah merah, boleh mengikat kepada kedua oksigen dan karbon dioksida. Jika kepekatan CO2 terlalu tinggi, kesemua hemoglobin dipenuhi karbon dioksida dan tiada pengangkutan oksigen berlaku (walaupun terdapat banyak oksigen dalam udara). Akibatnya, orang yang berada dalam bilik tertutup akan mengalami perasaan sukar bernafas akibat pengumpulan karbon dioksida, walaupun sebelum kekurangan oksigen menimbulkan masalah. Karbon dioksida, sama ada dalam bentuk gas atau pepejal, perlu dikendalikan dalam kawasan yang mempunyai pengudaraan yang baik.
OSHA menghadkan kepekatan karbon dioksida di tempat kerja pada kadar 0.5% untuk tempoh yang panjang, atau sehingga 3% untuk dedahan singkat (sehingga sepuluh minit). OSHA menganggap kepekatan melebihi 4% sebagai "ancaman langsung kepada nyawa dan kesihatan." Mereka yang menghidu 5% karbon dioksida untuk tempoh melebihi setengah jam menunjukkan tanda-tanda hiperkapnia teruk (akut), sementara bernafas 7–10% karbon dioksida boleh menyebabkan pitam dalam tempoh beberapa minit.
Menurut kajian yang dilakukan oleh USDA [1][pautan mati kekal], pernafasan purata orang biasa menghasilkan sekitar 450 liter (sekitar 900 gram) karbon dioksida sehari.
CO2 yang di bawa darah boleh didapati dalam pelbagai bentuk. 8% daripada CO2 terdapat dalam plasma sebagai gas. 20% daripadanya terikat kepada hemoglobin. CO2 yang terikat pada hemoglobin tidak bersaing dengan ikatan oksigen kerana ia terikat kepada asid amino bukannya molekul heme. Baki 72% daripadanya dibawa sebagai HCO3− bikarbonat yang merupakan pemampan penting dalam pengawalan pH organisma. Kadar bikarbonat dikawal dan sekiranya ia meningkat, kita bernafas semakin cepat bagi menyingkirkan karbon dioksida yang lebih. Kadar karbon dioksida/bikarbonat dalam darah memberi kesan kepada ketebalan kapilari darah. Sekiranya ia tinggi, kapilari mengembang dan lebih banyak darah meluru masuk dan membawa bikarbonat lebih keparu-paru. Untuk mengelakkan kehilangan karbon dioksida kepada paras rendah merbahaya, badan membangunkan mekanisma kawalan pertahanan khas. Ini termasuk pengucupan saluran udara dan saluran darah, dan peningkatan penghasilan hingus.
Rujukan[sunting | sunting sumber]
- ^ "Carbon Dioxide" (PDF). Air Products. Diarkibkan daripada yang asal (PDF) pada 2020-07-29. Dicapai pada 2020-03-19.
- ^ Touloukian, Y.S., Liley, P.E., and Saxena, S.C. Thermophysical properties of matter - the TPRC data series. Volume 3. Thermal conductivity - nonmetallic liquids and gases. Data book. 1970.
- ^ Schäfer, Michael; Richter, Markus; Span, Roland (2015). "Measurements of the viscosity of carbon dioxide at temperatures from (253.15 to 473.15)K with pressures up to 1.2MPa". The Journal of Chemical Thermodynamics. 89: 7–15. doi:10.1016/j.jct.2015.04.015. ISSN 0021-9614.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0103" (dalam bahasa Inggeris). National Institute for Occupational Safety and Health (NIOSH).
- ^ "Carbon dioxide". Immediately Dangerous to Life or Health Concentrations (IDLH). Institut Kebangsaan untuk Keselamatan dan Kesihatan Pekerjaan (NIOSH).
- ^ "Safety Data Sheet – Carbon Dioxide Gas – version 0.03 11/11" (PDF). AirGas.com. 12 February 2018. Dicapai pada 4 August 2018.
- ^ "Carbon dioxide, refrigerated liquid" (PDF). Praxair. m/s. 9. Diarkibkan daripada yang asal (PDF) pada 29 July 2018. Dicapai pada 26 July 2018.
Pautan luar[sunting | sunting sumber]
 Kategori berkenaan Karbon dioksida di Wikimedia Commons
Kategori berkenaan Karbon dioksida di Wikimedia Commons Takrifan kamus karbon dioksida di Wikikamus
Takrifan kamus karbon dioksida di Wikikamus