Barium
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciri-ciri umum | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Rupa | Kelabu berkilau dengan seri warna kuning pucat[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Barium dalam jadual berkala | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombor atom (Z) | 56 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kumpulan, kala | kumpulan 2 (logam alkali bumi), kala 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | Blok s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Xe] 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Bil. elektron per petala/cengkerang | 2, 8, 18, 18, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciri-ciri fizikal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Takat lebur | 1000 K (727 °C, 1341 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Takat didih | 2118 K (1845 °C, 3353 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ketumpatan suhu bilik hampir | 3.51 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| apabila cecair, pada t.l. | 3.338 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Haba pelakuran | 7.12 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Haba pengewapan | 142 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Muatan haba molar | 28.07 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tekanan wap
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciri-ciri atom | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Keelektronegatifan | Skala Pauling: 0.89 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tenaga pengionan | pertama: 502.9 kJ/mol ke-2: 965.2 kJ/mol ke-3: 3600 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jejari atom | empirik: 222 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jejari kovalen | 215±11 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jejari van der Waals | 268 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rampaian | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktur hablur | kiub berpusatkan badan (bcc) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kelajuan bunyi rod nipis | 1620 m/s (pada 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pekali pengembangan terma | 20.6 µm/(m·K) (pada 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Daya pengaliran terma | 18.4 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kerintangan elektrik | 332 nΩ·m (pada 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat kemagnetan | Paramagnetisme[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kerentanan magnet (χmol) | +20.6·10−6 cm3/mol[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modulus Young | 13 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modulus ricih | 4.9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modulus pukal | 9.6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skala Mohs | 1.25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombor CAS | 7440-39-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penemuan | Carl Wilhelm Scheele (1772) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pengasiangan pertama | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotop utama bagi barium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Barium merupakan unsur kimia dengan simbol Ba dan nombor atom 56. Barium merupakan unsur kelima dalam Kumpulan 2, logam alkali bumi dan bersifat lembut keperakan. Barium tidak terdapat secara semula jadi dalam bentuk tulen kerana ia bertindak balas dengan aktif dengan udara Bumi. Barium oksida dalam sejarah dikenali sebagai baryta tetapi ia bertindak balas dengan air dan karbon dioksida dan tidak terdapat dalam bentuk galian. Bentuk semula jadi galian paling sering didapati adalah dalam bentuk ion barium sulfat tidak larut, BaSO4, dan barium karbonat, BaCO3. Nama barium berasal dari bahasa Greek barys (βαρύς), bererti "berat", menggambarkan ketumpatan tinggi sesetengah bijih mengandungi barium biasa.
Barium memiliki sedikit kegunaan industri, tetapi logam ini telah digunakan bagi menghapus udara dalam tiub vakum. Sebatian barium memberikan warna hijau pada nyalaan api dan digunakan bagi menghasilkan bunga api. Barium sulfat digunakan bagi ketumpatannya, ketidaklarutannya, dan dalam bentuk tulen, sebagai optik sinar-X. Ia digunakan sebagai pes seperti lumpur berat tidak larut bagi menggali telaga minyak, dan jika dalam bentuk tulen, barium digunakan sebagai agen radiokontras bagi pengimbasan saluran penghadaman manusia (gastrointestinal tract). Sebatian barium larut adalah beracun disebabkan pembebasan ion barium yang boleh larut, dan telah digunakan sebagai racun tikus. Kegunaan baru bagi barium dikaji secara berterusan. Ia merupakan sebatian bagi sesetengah superkonduktor bersuhu tinggi dan elektroseramik.
Ciri-ciri[sunting | sunting sumber]

Ciri-ciri fizikal[sunting | sunting sumber]

Barium merupakan logam alkali bumi lembut dengan warna keperakan, yang teroksida dengan pantas di udara.[4] Ia terhablur sebagai kekisi berpusat padu. Ia terbakar dengan warna hijau ke hijau muda dalam ujian api, terhasil akibat pancaran garis spektral pada 524.2 dan 513.7 nm. Ia merupakan sebatian mudah dan terkenal kerana perbandingan graviti spesifik yang tinggi (bagi unsur bumi beralkali). Ketumpatan tinggi ini benar bagi galian mengandungi barium paling biasa, barit (BaSO4), juga dikenali sebagai 'spar berat' akibat ketumpatan tingginya (4.5 g/cm³).
Ciri-ciri kimia[sunting | sunting sumber]
Barium, sebagaimana logam (kumpulan II) unsur bumi beralkali, menurun dengan pantas. Ia bertindak balas secara eksoterma dengan oksigen pada suhu bilik bagi membentuk barium oksida dan barium peroksida. Oleh kerana kesensitifannya pada udara, barium disimpan dalam minyak parafin. Tindak balasnya adalah sangat cergas jika barium dalam bentuk serbuk. Logam ini mudah bertindak balas dengan kebanyakan asid, dengan pengecualian jelas asid sulfurik, kerana pempasifan menghentikan tindak balas dengan membentuk barium sulfat tidak larut. Ia turut bertindak balas dengan air menurut tindak balas:
- Ba + 2 H2O → Ba(OH)2 + H2↑
Barium bergabung dengan beberapa logam, termasuk aluminium, zink, plumbum dan perak, membentuk fasa antara logam dan loyang.[5]
Permata yang mengandungi barium jarang ditemui, dan dipanggil benitoite.
Penghasilan[sunting | sunting sumber]
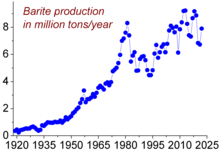
Oleh sebab barium cepat teroksida di udara, sukar untuk mendapatkan logam tulen dan tidak dapat ditemukan secara tulen. Logam itu terutamanya ditemui, dan diekstrak daripada, barit. Kerana barit sangat tidak larut, ia tidak dapat digunakan secara langsung untuk penyediaan sebatian barium, atau logam barium. Sebaliknya, bijih dipanaskan dengan karbon untuk mengurangkannya menjadi barium sulfida:[6]
- BaSO4 + 2 C → BaS + 2 CO2
Bahan barium sulfida kemudian dihidrolisis atau ditindak balaskan dengan asid untuk membentuk sebatian barium lain, seperti klorida, nitrat, dan karbonat. Barium dihasilkan secara komersil melalui elektrolisis barium klorida (BaCl2):
Logam barium juga diperoleh melalui penurunan barium oksida dengan aluminium pada suhu 1100 ke 1200 °C:
- 4 BaO + 2 Al → BaO·Al2O3 + 3 Ba
Wap barium kemudiannya disejukkan dan dikondensasikan untuk mendapatkan pepejal logam yang boleh ditempa menjadi rod ataupun wayar. Sebagai pepejal mudah terbakar, logam ini disimpan dalam bekas keluli atau beg plastik yang diisi dengan udara argon.[5]
Unsur[sunting | sunting sumber]
Ba2+ merupakan tahap pengoksidaan utama dalam bidang kimia barium. Sifat-sifatnya biasanya menyerupai ion-ion logam alkali bumi yang lain seperti strontium dan kalsium. Kesemua halida, pseudohalida dan kalkogen diketahui dan biasanya merupakan pepejal tanpa warna. Garam sulfatnya terkenal dengan sifatnya yang tidak larut. BaO membentuk peroksida apabila dipanaskan dalam udara. Oksidanya ialah oksida bes dan bertindak balas dengan asid untuk membentuk garam. Barium menurunkan oksida, klorida dan sulfida logam-logam yang kurang aktif seperti yang berikut:
- Ba + CdO → BaO + Cd
- Ba + ZnCl2 → BaCl2 + Zn
- 3 Ba + Al2S3 → 3 BaS + 2 Al
Dalam persekitaran suhu tinggi, barium bergabung dengan nitrogen dan hidrogen untuk menghasilkan nitrida, Ba3N2 dan hidrida, BaH2 masing-masing. Barium sianida terbentuk apabila dipanaskan bersama nitrogen dan karbon seperti di bawah:
- Ba + N2 + 2 C → Ba(CN)2
Sejarah[sunting | sunting sumber]
Nama barium berasal daripada perkataan Yunani βαρύς barys, iaitu "berat", menggambarkan ketumpatan bijih-bijih barium umum. Ahli alkimia pada Zaman Pertengahan awal telah tahu tentang galian-galian barium. Batu-batu licin berupa kelikir barit yang dijumpai di Bologna, Itali dikenali sebagai "batuan Bologna". Sifatnya yang bersinar selama bertahun-tahun selepas pendedahan kepada cahaya menarik perhatian ahli-ahli alkimia terhadap batuan tersebut.[7]
Carl Scheele mengenal pasti barit mempunyai unsur baharu pada 1774, tetapi hanya berjaya mengasingkan barium oksida dan bukannya barium tulen. Johan Gottlieb Gahn juga dapat mengasingkan barium dua tahun kemudian dalam kajian serupa. Barium teroksida pada awalnya dipanggil sebagai barote oleh Guyton de Morveau, dan kemudiannya ditukarkan oleh Antoine Lavoisier kepada baryta. Pada abad ke-18 juga, pakar mineralogi Inggeris, William Withering menemui mineral berat di dalam lombong-lombong plumbum Cumberland yang kini dikenali sebagai witerit. Barium mula diasingkan melalui elektrolisis garam-garam barium lebur oleh Sir Humphry Davy di England pada 1808.[8] Davy menamakan barium selepas istilah baryta yang ditambahkan akhiran "-ium" yang menandakan unsur logam berdasarkan analogi penamaan kalsium.[7] Robert Bunsen dan Augustus Mattheissen memeperoleh barium tulen melalui elektrolisis campuran barium klorida dan ammonium klorida lebur.[9][10]
Penghasilan oksigen tulen melalui proses Brin merupakan aplikasi barium peroksida secara besar-besaran sebelum elektrolisis dan penyulingan berperingkat menjadi kaedah-kaedah utama penghasilan gas oksigen. Dalam proses ini, barium oksida dirtindak balas pada suhu 500–600 °C dengan udara untuk menghasilkan barium peroksida yang terurai pada suhu melebihi 700 °C lalu membebaskan oksigen.[11][12]
- 2 BaO + O2 ⇌ 2 BaO2
Rujukan[sunting | sunting sumber]
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (ed. 2nd), Oxford: Butterworth-Heinemann, m/s. 112, ISBN 0-7506-3365-4CS1 maint: multiple names: authors list (link)
- ^ Lide, D. R., penyunting (2005). "Magnetic susceptibility of the elements and inorganic compounds". CRC Handbook of Chemistry and Physics (PDF) (ed. 86th). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. m/s. E110. ISBN 0-8493-0464-4.
- ^ Stwertka, Albert (2002). A guide to the elements. Oxford University Press US. m/s. 144. ISBN 0195150279.
- ^ a b Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jochen; Wolf, Hans Uwe (2007). Barium and Barium Compounds. Wiley-VCH. doi:10.1002/14356007.a03_325.pub2. ISBN 9783527306732. Unknown parameter
|encyclopedia=ignored (bantuan) - ^ "Toxicological Profile for Barium and Barium Compounds. Agency for Toxic Substances and Disease Registry" (PDF). CDC. 2007.
- ^ a b Robert E. Krebs (2006). The history and use of our earth's chemical elements: a reference guide. Greenwood Publishing Group. m/s. 80. ISBN 0313334382.
- ^ Davy, H. (1808) "Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia," Philosophical Transactions of the Royal Society of London, vol. 98, pages 333-370.
- ^ "Masthead". Annalen der Chemie und Pharmacie. 93 (3): fmi–fmi. 1855. doi:10.1002/jlac.18550930301.
- ^ Wagner, Rud.; Neubauer, C.; Deville, H. Sainte-Claire; Sorel; Wagenmann, L.; Techniker; Girard, Aim� (1856). "Notizen". Journal f�r Praktische Chemie. 67: 490–508. doi:10.1002/prac.18560670194. replacement character in
|first7=at position 4 (bantuan); replacement character in|journal=at position 10 (bantuan) - ^ Jensen, William B. (2009). "The Origin of the Brin Process for the Manufacture of Oxygen". Journal of Chemical Education. 86 (11): 1266. doi:10.1021/ed086p1266.
- ^ Ihde, Aaron John (1984-04-01). The development of modern chemistry. m/s. 681. ISBN 9780486642352.
Pautan luar[sunting | sunting sumber]
 Kategori berkenaan Barium di Wikimedia Commons
Kategori berkenaan Barium di Wikimedia Commons
Jadual berkala
| |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||

