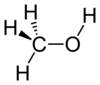
Metanol
| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC pilihan
Methanol[1] | |||
| Nama lain
Karbinol
Hidroksimetana Metil alkohol Metil hidrat Metil hidroksida Alkohol metilik Metilol | |||
| Pengecam | |||
Imej model 3D Jmol
|
|||
| 3DMet | |||
| 1098229 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.599 | ||
| Nombor EC |
| ||
| 449 | |||
| KEGG | |||
| MeSH | Methanol | ||
PubChem CID
|
|||
| Nombor RTECS |
| ||
| UNII | |||
| Nombor PBB | 1230 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| CH3OH | |||
| Jisim molar | 32.04 g mol−1 | ||
| Rupa bentuk | Cecair lutsinar | ||
| Ketumpatan | 0.792 g·cm−3[2] | ||
| Takat lebur | −97.6 °C (−143.7 °F; 175.6 K) | ||
| Takat didih | 64.7 °C (148.5 °F; 337.8 K) | ||
| boleh larut campur | |||
| log P | -0.69 | ||
| Tekanan wap | 13.02 kPa (pada 20 °C) | ||
| Keasidan (pKa) | 15.5[3] | ||
| -21.40·10−6 sm³/mol | |||
Indeks biasan (nD)
|
1.33141[4] | ||
| Kelikatan | 0.545 mPa×s (at 25 °C) [5] | ||
| Momen dwikutub | 1.69 D | ||
| Bahaya | |||
| Piktogram GHS |    [6] [6]
| ||
| Perkataan isyarat GHS | Danger[6] | ||
| H225, H301, H311, H331, H370[6] | |||
| P210, P233, P240, P241, P242, P243, P260, P264, P270, P280, P301+310, P303+361+353, P304+340, P330, P363, P370+378, P403+233, P235, P405, P501[6] | |||
| NFPA 704 (berlian api) | |||
| Takat kilat | 11 hingga[convert: unknown unit] | ||
| 470[7] °C (878 °F; 743 K) | |||
| Had letupan | 6%-36%[8] | ||
| Dos maut (LD) atau kepekatan dos maut (LC) | |||
LD50 (median dos)
|
5628 mg/kg (tikus besar, oral) 7300 mg/kg (tikus kecil, oral) 12880 mg/kg (tikus besar, oral) 14200 mg/kg (arnab, oral)[9] | ||
LC50 (median kepekatan)
|
64,000 ppm (rat, 4 hr)[9] | ||
LCLo (paling rendah diketahui)
|
33,082 ppm (kucing, 6 j) 37,594 ppm (tikus kecil, 2 j)[9] | ||
| NIOSH (Had pendedahan kesihatan AS): | |||
PEL (Dibenarkan)
|
TWA 200 ppm (260 mg/m3)[8] | ||
REL (Disyorkan)
|
TWA 200 ppm (260 mg/m3) ST 250 ppm (325 mg/m3) [kulit][8] | ||
IDLH (Bahaya serta-merta)
|
6000 ppm[8] | ||
| Sebatian berkaitan | |||
Sebatian berkaitan
|
Metanatiol Silanol | ||
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |||
| | |||
| Rujukan kotak info | |||
Metanol, juga dikenali sebagai alkohol metil antara lainnya, adalah sebatian kimia dengan formula CH3OH (sering singkatan MeOH). Metanol industri pada hari ini dihasilkan melalui proses berpemangkin langsung daripada karbon monoksida, karbon dioksida dan hidrogen.
Bahan ini dalam bentuk cecairnya berkutub, dan digunakan sebagai antibeku, pelarut, bahan bakar dan sebagai penyahasli etanol. Ia juga digunakan untuk menghasilkan biodiesel melalui tindak balas transesterifikasi.
Metanol atmosfera dihasilkan secara semula jadi melalui metabolisme anaerobik pelbagai jenis bakteria, dan ia biasanya hadir dalam jumlah yang kecil di persekitaran. Hasilnya, atmosfera mengandungi sedikit wap metanol; namun dalam beberapa hari, wap-wap ini dioksidakan cahaya matahari untuk menghasilkan karbon dioksida dan air.
Sebatian ini juga terdapat dalam kuantiti yang banyak di tempat terbentuknya bintang-bintang di angkasa, maka ia digunakan dalam ilmu astronomi sebagai penanda bagi kawasan-kawasan tersebut. Ia dikesan melalui garis pelepasan spektrumnya.[10]
Oleh itu, metanol sering digunakan sebagai penyahasli tambahan untuk etanol dalam kegunaan industri. Penambahan metanol ini mengecualikan industri etanol (dikenali sebagai "alkohol rosak" atau "semangat bermetil") daripada dikenakan cukai minuman keras di Amerika Syarikat serta beberapa negara lain.
Sejarah[sunting | sunting sumber]
Masyarakat Mesir Purba pernah menggunakan metanol sebagai salah satu bahan kimia dalam tahmitan dan diperoleh melalui pirolisis kayu.
Robert Boyle berjaya memperoleh metanol tulen pada 1661 melalui penyulingan kering kayu pak.[11] Marcelin Berthelot pula berjaya menghasilkan metanol menerusi penyabunan metil klorida pada 1858.[12][13]
Ciri-ciri[sunting | sunting sumber]
Ia adalah alkohol yang paling ringkas dengan hanya satu kumpulan metilnya yang dikaitkan dengan kumpulan hidroksil. Cecair metanol bersifat ringan, meruap, berwarna, mudah terbakar dengan bau tersendiri yang sangat menyerupai bau etanol (alkohol dalam minuman keras).[14] Walau bagaimanapun, metanol sangat beracun dan tidak sesuai diambil.
Kumpulan hidroksil yang berkutub membolehkan metanol larut dalam air dalam apa jua nisbah, serta mudah larut dalam dietil eter dan hidrokarbon. Metanol tidak begitu larut dalam minyak sayuran serta lemak.[15]
Kewujudan[sunting | sunting sumber]
Badan manusia yang biasa memiliki sediktit metanol, dengan purata jumlah sebanyak 4.5 bahagian per juta menurut satu kajian ujian nafas.[16] Metanol boleh wujud dalam badan manusia disebabkan oleh pemakanan pektin pada tumbuhan.[17] Bakteria anaerob serta fitoplankton boleh menghasilkan metanol.[18][19]
Metanol boleh ditemui di kawasan pembentukan bintang di angkasa lepas dan dimanfaatkan oleh para ahli astronomi sebagai penanda kawasan tersebut melalui garis spektrum yang dipancar.[20]
Kegunaan[sunting | sunting sumber]
Metanol digunakan terutamanya sebagai suapan bagi pembuatan bahan kimia, serta juga sebagai bahan bakar untuk kenderaan khusus. Seperti disebutkan di atas, ia merupakan satu agen penyahasli yang biasa digunakan. Ia larutan makmal yang sangat berguna dalam proses kromatografi cecair bertekanan tinggi (HPLC), spektroskopi ultraungu/cahaya nampak, dan kromatografi cecair-spektrometri jisim kerana potongan ultraungunya yang rendah.
Penghasilan bahan-bahan kimia[sunting | sunting sumber]
Metanol lazimnya ditukar menjadi formaldehid melalui proses pengoksidaan:
- 2 CH3OH + O2 → 2 CH2O + 2 H2O.
Selain itu, metanol boleh ditukar kepada asid asetik melalui proses Cativa. Metanol juga merupakan sebatian perantara kepada kebanyakan metilamina ringkas, metil halida dan metil ester.[21]
Bahan api[sunting | sunting sumber]
Metanol boleh dijadikan bahan api dalam enjin pembakaran dalam; metanol dibakar menghasilkan karbon dioksida dan air:
- 2 CH3OH + 3 O2 → 2 CO2 + 4 H2O.
Penghasilan[sunting | sunting sumber]
Daripada gas sintesis[sunting | sunting sumber]
Karbon monoksida hidrogen dan bertimdak balas dengan pemangkin untuk menghasilkan metanol. Hari ini, pemangkin yang paling banyak digunakan adalah campuran tembaga dan zink oksida, disokong pada alumina, sepertimana ia pertama kali digunakan oleh ICI pada tahun 1966. Dalan 5-10 MPa (50-100 atm) dan 250 °C (482 °F), tindak balas ini bercirikan pemilihan tinggi (>99.8%):
- CO + 2 H2 → CH3OH.
Pengeluaran gas sintesis daripada metana menghasilkan tiga mol hidrogen untuk setiap mol karbon monoksida, sedangkan penghasilan gas ini menggunakan hanya dua mol gas hidrogen setiap mol karbon monoksida. Salah satu cara untuk menguruskan hidrogen yang berlebihan adalah menyuntik karbon dioksida ke reaktor penghasilan metanol, di mana ia juga bertindak balas untuk membentuk metanol menurut persamaan:
- CO2 + 3 H2 → CH3OH + H2O.
Dari segi mekanisme, proses ini berlaku melalui penukaran awal CO kepada CO2 yang kemudiannya dihidrogenkan:[22]
- CO2 + 3 H2 → CH3OH + H2O.
di mana hasil sampingan H2O dikitar semula melalui tindak balas peralihan air-gas,
- CO + H2O → CO2 + H2,
Ini memberikan tindak balas keseluruhan reaksi, yang adalah sama seperti di atas.
- CO + 2 H2 → CH3OH.
Keselamatan[sunting | sunting sumber]
Metanol adalah mudah terbakar. wap metanol adalah lebih berat daripada udara dan boleh meresap ke udara sekeliling. Kebakaran akibat metanol perlu dipadam dengan bahan kimia kering, karbon dioksida, semburan air atau busa tahan alkohol.[23]
Metanol mudah memasuki badan manusia melalui sedutan, penelanan atau sentuhan,[24] dan mudah tersebar ke seluruh badan melalui bendalir-bendalir badan. Jumlah kecil metanol boleh dikumuhkan tanpa sebarang perubahan melalui peparu atau buah pinggang.
Keracunan[sunting | sunting sumber]
Metanol mempunyai tahap keracunan akut yang rendah terhadap manusia, tetapi berbahaya apabila diminum dalam jumlah yang besar, lazimnya dengan etanol. Sekurang-kurangnya 10 ml etanol tulen adalah cukup untuk menyebabkan kebutaan kekal akibat kemusnahan saraf optik. 30 ml metanol boleh membawa maut.[25]
Metanol yang diminum dimetabolikkan terlebih dahulu menjadi formaldehid dan kemudian asid formik atau garam format oleh enzim alkohol dehidrogenase.[26] Sebatian-sebatian ini beracun kepada sistem saraf pusat dan mungkin menyebabkan buta, koma, dan maut.
Keracunan metanol lazimnya berlaku akibat peminuman minuman keras yang tercemar.[27] Keracunan ini boleh dirawat dengan ubat fomepizola atau sekiranya tiada, etanol melalui penghambatan alkohol dehidrogenase.
Rujukan[sunting | sunting sumber]
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. m/s. 692. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Templat:RubberBible86th
- ^ Ballinger, P.; Long, F.A. (1960). "Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds". J. Am. Chem. Soc. 82 (4): 795–798. doi:10.1021/ja01489a008.
- ^ "RefractiveIndex.INFO - Refractive index database".
- ^ González, Begoña (2007). "Density, dynamic viscosity, and derived properties of binary mixtures of methanol or ethanol with water, ethyl acetate, and methyl acetate at T = (293.15, 298.15, and 303.15) K". The Journal of Chemical Thermodynamics. 39 (12): 1578–1588. doi:10.1016/j.jct.2007.05.004.
- ^ a b c d "Methanol" (PDF). Lab Chem. Valtech. Dicapai pada 10 Mac 2016.
- ^ "METHANOL INSTITUTE". Diarkibkan daripada yang asal pada 11 Mac 2012. Unknown parameter
|dead-url=ignored (bantuan) - ^ a b c d "NIOSH Pocket Guide to Chemical Hazards #0397". National Institute for Occupational Safety and Health.
- ^ a b c "Methanol". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health.
- ^ Brooks Hays (17 April 2015). "Why astronomers hate the lawn-mowing Roomba". Space Daily.
- ^ Boyle discusses the distillation of liquids from the wood of the box shrub in: Robert Boyle, The Sceptical Chymist (London, England: J. Cadwell, 1661), m/s. 192–195.
- ^ S. Lee: Methanol synthesis technology. CRC Press, 1990, ISBN 0-8493-4610-X.
- ^ J. R. Couper, O. T. Beasley, W. R. Penney: The chemical process industries infrastructure: function and economics. Marcel Dekker, 2000, ISBN 0-8247-0435-5.
- ^ National Institute for Occupational Safety and Health (22 August 2008). "The Emergency Response Safety and Health Database: Methanol". Dicapai pada 17 March 2009.
- ^ Diarkibkan 26 Ogos 2011 di methanex.com (Error: unknown archive URL) (PDF, 578 kB)
- ^ Turner C (2006). "A longitudinal study of methanol in the exhaled breath of 30 healthy volunteers using selected ion flow tube mass spectrometry, SIFT-MS". Physiological Measurement. 27 (7): 637–48. Bibcode:2006PhyM...27..637T. doi:10.1088/0967-3334/27/7/007. PMID 16705261.
- ^ Lindinger W (1997). "Endogenous production of methanol after the consumption of fruit". Alcoholism, Clinical and Experimental Research. 21 (5): 939–43. doi:10.1111/j.1530-0277.1997.tb03862.x. PMID 9267548.
- ^ "Major Source of Methanol in the Ocean Identified". Woods Hole Oceanographic Institution. March 10, 2016. Dicapai pada 2016-03-30.
- ^ Mincer, Tracy J.; Aicher, Athena C. (2016). "Methanol Production by a Broad Phylogenetic Array of Marine Phytoplankton". PLOS One. 11 (3): e0150820. Bibcode:2016PLoSO..1150820M. doi:10.1371/journal.pone.0150820. PMC 4786210. PMID 26963515.
- ^ Brooks Hays (17 April 2015). "Why astronomers hate the lawn-mowing Roomba". Space Daily.
- ^ Fiedler, E.; Grossmann, G.; Burkhard Kersebohm, D.; Weiss, G. and Witte, C. (2005). "Methanol". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a16_465. ISBN 978-3527306732.CS1 maint: uses authors parameter (link)
- ^ Olaf Deutschmann, Helmut Knözinger, Karl Kochloefl, Thomas Turek "Heterogeneous Catalysis and Solid Catalysts, 3. Industrial Applications" in Ullmann's Encyclopedia of Industrial Chemistry" 2012, Wiley-VCH, Weinheim. DOI:10.1002/14356007.o05_o03
- ^ "The Emergency Response Safety and Health Database: Systematic Agent: METHANOL" (dalam bahasa Inggeris). Centers for Disease Control and Prevention. Dicapai pada 3 Ogos 2018.
- ^ R. Kavet, K. M. Nauss: The Toxicity of Inhaled Methanol Vapors. (PDF, 2.2 MB) dalam: Critical Reviews in Toxicology. 1990.
- ^ Vale A (2007). "Methanol". Medicine. 35 (12): 633–4. doi:10.1016/j.mpmed.2007.09.014.
- ^ Barceloux, DG; Bond, GR; Krenzelok, EP; Cooper, H; Vale, JA; American Academy of Clinical Toxicology Ad Hoc Committee on the Treatment Guidelines for Methanol, Poisoning (2002). "American Academy of Clinical Toxicology practice guidelines on the treatment of methanol poisoning". Journal of toxicology. Clinical toxicology. 40 (4): 415–46. PMID 12216995.
- ^ Beauchamp, GA; Valento, M (September 2016). "Toxic Alcohol Ingestion: Prompt Recognition And Management In The Emergency Department". Emergency Medicine Practice. 18 (9): 1–20. PMID 27538060.
Pautan luar[sunting | sunting sumber]
- Kad Keselamatan Kimia Antarabangsa 0057
- Methyl Alcohol (Methanol) CDC/NIOSH, pautan kepada maklumat keselamatan metanol.
- CDC – NIOSH Pocket Guide to Chemical Hazards – Methyl Alcohol
- Methanol Fact Sheet – National Pollutant Inventory (Inventori Bahan Pencemar Negara Australia)
- Arkib tidak diketahui templat webarchive
- ECHA InfoCard ID from Wikidata
- Convert errors
- Articles containing unverified chemical infoboxes
- Metanol
- Alkanol
- Pelarut alkohol
- Pemeliharaan anatomi
- Bahan api bio
- Storan tenaga
- Pencemar udara berbahaya
- Metabolit manusia
- Neurotoksin
- Pengoksigen
- Bahan kimia komoditi
- Pemodulat alosterik positif reseptor GABAA