Metabolisme asid lemak
Metabolisme asid lemak terdiri daripada pelbagai proses metabolik yang melibatkan atau berkait rapat dengan asid lemak, satu keluarga molekul yang dikelaskan dalam kategori makronutrien lipid. Proses ini terutamanya boleh dibahagikan kepada (1) proses katabolik yang menjana tenaga dan (2) proses anabolik, di mana ia berfungsi sebagai blok buat sebatian lain.[1]
Dalam katabolisme, asid lemak dimetabolismekan untuk menghasilkan tenaga, terutamanya dalam bentuk adenosina trifosfat (ATP). Jika dibandingkan dengan kelas makronutrien lain (karbohidrat dan protein), asid lemak menghasilkan ATP paling banyak pada asas tenaga setiap gram apabila ia teroksida sepenuhnya kepada CO2 dan air melalui pengoksidaan beta dan kitaran asid sitrik.[2] Oleh itu, asid lemak (terutamanya dalam bentuk trigliserida) merupakan bentuk simpanan bahan api yang paling utama dalam kebanyakan haiwan, dan pada tahap yang lebih rendah dalam tumbuhan.
Dalam anabolisme, asid lemak utuh ialah pelopor penting kepada trigliserida, fosfolipid, pengutus kedua, hormon dan badan keton. Sebagai contoh, fosfolipid membentuk dwilapisan fosfolipid, di mana semua membran sel dibina daripada asid lemak. Fosfolipid terdiri daripada membran plasma dan membran lain yang merangkumi semua organel dalam sel seperti nukleus, mitokondria, retikulum endoplasma, dan jasad Golgi. Dalam jenis anabolisme lain, asid lemak diubah suai untuk membentuk sebatian lain seperti pengutus kedua dan hormon setempat. Prostaglandin yang diperbuat daripada asid arakidonik yang disimpan dalam membran sel mungkin adalah yang paling terkenal bagi hormon setempat ini.
Katabolisme asid lemak[sunting | sunting sumber]




Asid lemak disimpan sebagai trigliserida dalam depot lemak tisu adiposa. Di antara waktu makan, ia dilepaskan seperti berikut:
- Lipolisis, penyingkiran rantai asid lemak daripada gliserol yang terikat dalam bentuk simpanannya sebagai trigliserida (atau lemak) oleh lipase. Lipase ini diaktifkan oleh paras epinefrina dan glukagon yang tinggi dalam darah (atau norepinefrina yang dirembeskan oleh saraf simpatetik dalam tisu adiposa), disebabkan oleh penurunan paras glukosa darah selepas makan, yang pada masa yang sama menurunkan paras insulin dalam darah.[1]
- Setelah dibebaskan daripada gliserol, asid lemak bebas memasuki darah, yang mengangkutnya, melekat pada albumin plasma, ke seluruh badan.[4]
- Asid lemak bebas rantai panjang memasuki sel yang memetabolismekan (iaitu kebanyakan sel hidup dalam badan kecuali sel darah merah dan neuron dalam sistem saraf pusat ) melalui protein pengangkutan tertentu seperti protein pengangkutan asid lemak keluarga SLC27.[5][6] Sel darah merah tidak mengandungi mitokondria, dan oleh itu, tidak berupaya memetabolismekan asid lemak; tisu-tisu sistem saraf pusat tidak boleh menggunakan asid lemak walaupun mengandungi mitokondria kerana asid lemak rantaian panjang (berbanding dengan asid lemak rantai sederhana[7][8] ) tidak boleh melintasi penghalang darah-otak[9] ke dalam cecair interstitial yang membasahi sel-sel ini.
- Sebaik sahaja di dalam sel, asid lemak rantai panjang-KoA ligase memangkinkan tindak balas antara molekul asid lemak dengan ATP (yang dipecahkan kepada AMP dan pirofosfat tak organik) untuk memberikan asil lemak-adenilat yang kemudiannya bertindak balas dengan koenzim A bebas untuk memberikan molekul asil-KoA berlemak.
- Agar asil-KoA memasuki mitokondria, pengulang-alik karnitina digunakan:[10][11][12]
- Asil-KoA dipindahkan ke kumpulan hidroksil karnitin oleh karnitina palmitoiltransferase I yang terletak pada muka sitosol membran mitokondria luar dan dalam.
- Asil-karnitin diangkut ke dalam oleh translokase karnitina-asilkarnitina ketika karnitina diangkut ke luar.
- Asil-karnitina ditukarkan kembali kepada asil-KoA oleh karnitina palmitoiltransferase II di bahagian dalam membran mitokondria dalam. Karnitina yang dibebaskan dialihkan kembali ke sitosol semasa asil-KoA diangkut ke dalam matriks mitokondria.
- Pengoksidaan beta dalam matriks mitokondria, kemudian memotong rantai karbon panjang asid lemak (dalam bentuk molekul asil-KoA) kepada satu siri unit dua karbon (asetat), yang digabungkan dengan koenzim A, membentuk molekul asetil-KoA yang terpeluwap dengan oksaloasetat untuk membentuk sitrat pada "permulaan" kitaran asid sitrik.[2] Adalah mudah untuk memikirkan tindak balas ini sebagai menandakan "titik permulaan" kitaran, kerana saat ini adalah ketika bahan api—asetil-KoA—ditambah ke dalam kitaran, yang akan dilesapkan sebagai CO2 dan H2O dengan pembebasan kuantiti tenaga yang banyak ditangkap dalam bentuk ATP semasa setiap pusingan kitaran dan seterusnya, pemfosforilan oksidaan.
- Secara ringkas, langkah-langkah pengoksidaan beta adalah seperti berikut:[2]
- Penyahhidrogenan oleh asil-KoA dehidrogenase, menghasilkan 1 FADH2
- Penghidratan oleh enoil-KoA hidratase
- Penyahhidrogenan oleh 3-hidroksiasil-KoA dehidrogenase, menghasilkan 1 NADH + H+
- Pembelahan oleh tiolase yang menghasilkan 1 asetil-KoA dan asid lemak yang kini telah dipendekkan oleh 2 karbon (membentuk asil-KoA baru yang dipendekkan)
- Tindak balas pengoksidaan beta diulang sehingga asid lemak telah dikurangkan sepenuhnya kepada asetil-KoA atau, dalam, kes asid lemak dengan bilangan atom karbon ganjil, asetil-KoA dan 1 molekul propionil-KoA setiap molekul asid lemak. Setiap potongan beta oksidatif molekul asil-KoA akhirnya menghasilkan 5 molekul ATP dalam fosforilasi oksidatif.[13][14]
- Asetil-KoA yang dihasilkan oleh pengoksidaan beta memasuki kitaran asid sitrik dalam mitokondria dengan bergabung dengan oksaloasetat untuk membentuk sitrat. Ditambah dengan fosforilasi oksidatif, ini menghasilkan pembakaran lengkap asetil-KoA kepada CO2 dan air. Tenaga yang dibebaskan dalam proses ini ditangkap dalam bentuk 1 GTP dan 11 molekul ATP bagi setiap molekul asetil-KoA yang teroksida.[2][10] Inilah nasib asetil-KoA di mana sahaja pengoksidaan beta asid lemak berlaku, kecuali dalam keadaan tertentu dalam hati.
- Propionil-KoA kemudiannya ditukar kepada suksinil-KoA melaluipropionil-KoA karboksilase (PCC) bergantungan biotin dan metilmalonil-KoA mutase (MCM) bergantungan Vitamin B12 secara berurutan.[15][16] Suksinil-KoA mula-mula ditukar kepada malat, dan kemudian kepada piruvat, di mana ia kemudiannya diangkut ke matriks untuk memasuki kitaran asid sitrik.
Dalam hati, oksaloasetat boleh dialihkan sepenuhnya atau sebahagiannya ke dalam laluan glukoneogenik semasa tempoh puasa, kelaparan, diet rendah karbohidrat, senaman berat berpanjangan dan dalam diabetes melitus jenis 1 yang tidak terkawal. Di bawah keadaan ini, oksaloasetat dihidrogenkan kepada malat yang kemudiannya dikeluarkan daripada mitokondria sel hati untuk ditukar kepada glukosa dalam sitoplasma sel hati, dari mana ia dilepaskan ke dalam darah.[10] Di dalam hati, oleh itu, oksaloasetat tidak tersedia untuk pemeluwapan dengan asetil-KoA apabila glukoneogenesis yang ketara telah dirangsang oleh insulin yang rendah (atau ketiadaannya) dan kepekatan glukagon yang tinggi dalam darah. Di bawah keadaan ini, asetil-KoA dialihkan kepada pembentukan asetoasetat dan beta-hidroksibutirat.[10] Asetoasetat, beta-hidroksibutirat, dan produk pecahan spontannya, aseton, selalunya dikenali sebagai badan keton (ambil perhatian bahawa ia bukannya "badan" sama sekali, tetapi bahan kimia larut air). Keton dilepaskan oleh hati ke dalam darah. Semua sel dengan mitokondria boleh mengambil keton daripada darah dan menukarkannya semula kepada asetil-KoA, yang kemudiannya boleh digunakan sebagai bahan api dalam kitaran asid sitrik mereka, kerana tiada tisu lain boleh mengalihkan oksaloasetatnya ke dalam laluan glukoneogenik dengan cara ini boleh berlaku di hati. Tidak seperti asid lemak bebas, keton boleh melintasi penghalang darah-otak dan oleh itu tersedia sebagai bahan api untuk sel-sel sistem saraf pusat, bertindak sebagai pengganti glukosa, di mana sel-sel ini biasanya bertahan.[10] Kejadian tahap keton yang tinggi dalam darah semasa kelaparan, diet rendah karbohidrat, senaman berat yang berpanjangan, atau diabetes mellitus jenis 1 yang tidak terkawal dikenali sebagai ketosis, dan, dalam bentuk yang melampau seperti dalam diabetes melitus jenis 1 di luar kawalan, sebagai ketoasidosis.
- Gliserol yang dikeluarkan oleh tindakan lipase difosforilasi oleh gliserol kinase dalam hati (satu-satunya tisu di mana tindak balas ini boleh berlaku), dan gliserol 3-fosfat yang terhasil dioksidakan kepada dihidroksiaseton fosfat. Enzim glikolisis triosa fosfat isomerase menukarkan sebatian ini kepada gliseraldehid 3-fosfat, yang dioksidakan melalui glikolisis, atau ditukar kepada glukosa melalui glukoneogenesis.
Asid lemak sebagai sumber tenaga[sunting | sunting sumber]

Asid lemak, disimpan sebagai trigliserida dalam organisma, adalah sumber tenaga tertumpu kerana ia mengandungi sedikit oksigen dan bersifat kontang. Hasil tenaga daripada satu gram asid lemak adalah kira-kira 9 kcal (37 kJ), jauh lebih tinggi daripada 4 kcal (17 kJ) bagi karbohidrat. Oleh kerana bahagian hidrokarbon asid lemak adalah hidrofobik, molekul ini boleh disimpan dalam persekitaran yang agak kontang. Karbohidrat, sebaliknya, lebih terhidrat. Sebagai contoh, 1 g glikogen mengikat kira-kira 2 g air, yakni kira-kira 1.33 kcal/g (4 kcal/3 g). Ini bermakna asid lemak boleh menampung lebih daripada enam kali jumlah tenaga bagi setiap unit jisim tersimpan. Dengan kata lain, jika tubuh manusia bergantung kepada karbohidrat untuk menyimpan tenaga, maka seseorang itu perlu membawa 31 kg (67.5 lb) glikogen terhidrat untuk mempunyai tenaga bersamaan dengan 4.6 kg (10 lb) lemak.[10]
Haiwan berhibernasi memberikan contoh yang baik berkenaan penggunaan rizab lemak sebagai bahan bakar. Sebagai contoh, beruang berhibernasi selama kira-kira 7 bulan, dan sepanjang tempoh ini, tenaga diperoleh daripada degradasi simpanan lemak. Burung yang berhijrah juga membina rizab lemak yang besar sebelum memulakan perjalanan antara benua mereka.[17]
Simpanan lemak manusia dewasa muda purata antara 10–20 kg, tetapi sangat berbeza bergantung pada jantina dan kecenderungan individu.[18] Sebaliknya, tubuh manusia menyimpan hanya kira-kira 400 g glikogen, di mana 300 g terkunci di dalam otot rangka dan tidak tersedia buat badan secara keseluruhan. 100 g atau lebih glikogen yang disimpan di dalam hati akan habis dalam masa satu hari selepas kelaparan.[10] Selepas itu, glukosa yang dilepaskan ke dalam darah oleh hati untuk kegunaan umum oleh tisu badan perlu disintesis daripada asid amino glukogenik dan beberapa substrat glukoneogenik lain, yang tidak termasuk asid lemak.[1] Namun begitu, lipolisis membebaskan gliserol yang boleh memasuki laluan glukoneogenesis.
Sintesis karbohidrat daripada gliserol dan asid lemak[sunting | sunting sumber]
Asid lemak dipecahkan kepada asetil-KoA melalui pengoksidaan beta di dalam mitokondria, manakala asid lemak disintesis daripada asetil-KoA di luar mitokondria, dalam sitosol. Kedua-dua laluan adalah berbeza bukan sahaja di mana ia berlaku, tetapi juga dalam tindak balas yang berlaku, dan substrat yang digunakan. Kedua-dua laluan itu saling merencati, menghalang asetil-KoA yang dihasilkan oleh pengoksidaan beta daripada memasuki laluan sintetik melalui tindak balas Asetil-KoA karboksilase.[1] Ia juga tidak boleh ditukar kepada piruvat kerana tindak balas kompleks piruvat dehidrogenase tidak dapat diterbalikkan.[10] Sebaliknya, asetil-KoA yang dihasilkan oleh pengoksidaan beta asid lemak berkondensasi dengan oksaloasetat untuk memasuki kitaran asid sitrik. Semasa setiap pusingan kitaran, dua atom karbon meninggalkan kitaran sebagai CO2 dalam tindak balas penyahkarboksilan yang dimangkin oleh isositrat dehidrogenase dan alfa-ketoglutarat dehidrogenase. Oleh itu, setiap pusingan kitaran asid sitrik mengoksidakan unit asetil-KoA sambil menjana semula molekul oksaloasetat, yang mana asetil-KoA pada asalnya bergabung untuk membentuk asid sitrik. Tindak balas penyahkarboksilan berlaku sebelum malat terbentuk dalam kitaran.[1] Hanya tumbuhan yang mempunyai enzim untuk menukar asetil-KoA kepada oksaloasetat, di mana malat boleh dibentuk untuk ditukar kepada glukosa.[1]
Walau bagaimanapun, asetil-KoA boleh ditukar kepada asetoasetat, yang boleh menyahkarboksilat kepada aseton (sama ada secara spontan, atau dimangkinkan oleh asetoasetat dekarboksilase). Ia kemudiannya boleh dimetabolismekan lagi kepada isopropanol yang dikumuhkan dalam nafas/air kencing, atau oleh CYP2E1 kepada hidroksiaseton (asetol). Asetol boleh ditukar kepada propilena glikol. Ini bertukar kepada piruvat (oleh dua enzim alternatif), atau propionaldehid, atau kepada L-laktaldehid dan kemudiannya L-laktat (isomer laktat biasa).[19][20][21] Laluan lain menukarkan asetol kepada metilglioksal, kemudian kepada piruvat atau kepada D-laktaldehid (melaluiSD-laktoil-glutation atau sebaliknya) sebelum menjadi D-laktat.[20][22][23] Metabolisme D-laktat (kepada glukosa) adalah perlahan atau terjejas pada manusia, jadi kebanyakan D-laktat dikumuhkan dalam air kencing; oleh ituD-laktat yang diperoleh daripada aseton boleh menyumbang dengan ketara kepada asidosis metabolik yang dikaitkan dengan ketosis atau keracunan isopropanol.[20]L-Laktat boleh melengkapkan penukaran bersih asid lemak kepada glukosa. Eksperimen pertama untuk menunjukkan penukaran aseton kepada glukosa telah dijalankan pada tahun 1951. Eksperiman ini dan selanjutnya menggunakan pelabelan isotop karbon.[21] Sehingga 11% daripada glukosa boleh diperoleh daripada aseton semasa kebuluran pada manusia.[21]
Gliserol yang dilepaskan ke dalam darah semasa lipolisis trigliserida dalam tisu adipos hanya boleh diambil oleh hati. Di sini, ia ditukar kepada gliserol 3-fosfat melalui tindakan gliserol kinase yang menghidrolisis satu molekul ATP setiap molekul gliserol yang terfosforilasi. Gliserol 3-fosfat kemudiannya dioksidakan kepada dihidroksiaseton fosfat, yang seterusnya, ditukar kepada gliseraldehid 3-fosfat oleh enzim triosa fosfat isomerase. Dari sini, tiga atom karbon gliserol asal boleh dioksidakan melalui glikolisis atau ditukar kepada glukosa melalui glukoneogenesis.[10]
Fungsi dan kegunaan lain asid lemak[sunting | sunting sumber]
Isyarat intrasel[sunting | sunting sumber]

Asid lemak adalah sebahagian daripada fosfolipid yang membentuk sebahagian besar membran plasma, atau membran sel. Fosfolipid ini boleh dipecahkan kepada diasilgliserol (DAG) dan inositol trisfosfat (IP3) melalui hidrolisis fosfatidilinositol 4,5-bisfosfat (PIP2) oleh enzim fosfolipase C (PLC) yang terikat di membran sel.[24]
Hormon eikosanoid parakrin[sunting | sunting sumber]


Satu produk metabolisme asid lemak ialah prostaglandin, sebatian yang mempunyai pelbagai kesan seperti hormon pada haiwan. Prostaglandin telah ditemui dalam hampir setiap tisu pada manusia dan haiwan lain. Ia dihasilkan daripada asid arakidonik, asid lemak tak tepu 20-karbon. Oleh itu, setiap prostaglandin mengandungi 20 atom karbon, termasuk cincin 5-karbon. Ia merupakan subkelas eikosanoid, dan membentuk kelas prostanoid terbitan asid lemak.[25]
Prostaglandin disintesis dalam membran sel oleh pembelahan arakidonat daripada fosfolipid yang membentuk membran. Ini dimangkinkan sama ada oleh fosfolipase A2 yang bertindak secara langsung di fosfolipid membran, atau oleh lipase yang bertindak terhadap DAG (diasilgliserol). Arakidonat kemudiannya diolah oleh komponen siklooksigenase dalam prostaglandin sintase. Ini membentuk cincin siklopentana kira-kira di tengah rantai asid lemak. Tindak balas juga menambah 4 atom oksigen yang diperoleh daripada dua molekul O2. Molekul yang terhasil ialah prostaglandin G2 yang ditukarkan oleh komponen hidroperoksidase kompleks enzim kepada prostaglandin H2. Sebatian yang sangat tidak stabil ini cepat berubah menjadi prostaglandin lain, prostasiklin dan tromboksana.[25] Ini kemudiannya dilepaskan ke dalam cecair interstisial yang mengelilingi sel-sel yang telah menghasilkan hormon eikosanoid.
Jika arakidonat bertindak oleh lipoksigenase berbanding siklooksigenase, asid hidroksieikosatetraenoik dan leukotriena pula terbentuk, dan ia juga bertindak sebagai hormon setempat.
Prostaglandin mempunyai dua terbitan: prostasiklin dan tromboksana. Prostacyclin adalah vasodilator setempat yang kuat, dan menghalang pengumpulan platelet darah. Melalui peranan mereka dalam vasodilatasi, prostasiklin juga terlibat dalam keradangan. Ia disintesis di dinding saluran darah, dan berfungsi secara fisiologi untuk mencegah pembentukan pembekuan yang tidak perlu serta mengawal pengecutan tisu otot licin.[26] Sebaliknya, tromboksana (dihasilkan oleh sel platelet) ialah vasokonstriktor, dan memudahkan penggumpalan platelet. Nama mereka berasal dari peranan mereka dalam pembentukan pembekuan darah (trombosis).
Pengangkutan dan penyimpanan[sunting | sunting sumber]



Sebilangan besar asid lemak dalam badan diperoleh daripada diet, dalam bentuk trigliserida sama ada dari haiwan atau tumbuhan. Asid lemak dalam lemak yang diperoleh daripada haiwan darat cenderung tepu, manakala asid lemak dalam trigliserida ikan dan tumbuhan selalunya politaktepu dan oleh itu hadir sebagai minyak.
Trigliserida ini tidak boleh diserap oleh usus.[27] Ia dipecahkan menjadi mono- dan di-gliserida serta asid lemak bebas (tetapi tiada gliserol bebas) oleh lipase pankreas, yang membentuk kompleks 1:1 dengan protein yang dipanggil kolipase (juga juzuk jus pankreas) yang diperlukan untuk aktivitinya. Kompleks yang diaktifkan hanya boleh berfungsi pada antara muka air-lemak. Oleh itu, adalah penting bahawa lemak terlebih dahulu diemulsikan oleh garam hempedu untuk menjamin aktiviti optimum bagi enzim ini.[28] Produk pencernaan yang terdiri daripada campuran tri-, di- dan monogliserida dan asid lemak bebas yang bersama-sama dengan kandungan larut lemak yang lain dalam diet (cth vitamin larut lemak dan kolesterol) dan garam hempedu, membentuk misel campuran dalam kandungan duodenum berair (lihat gambar rajah di sebelah kanan).[27][29]
Kandungan misel ini (tetapi bukan garam hempedu) memasuki enterosit (sel epitelium yang melapisi usus kecil), di mana ia disintesis semula menjadi trigliserida, dan dibungkus menjadi kilomikron yang dilepaskan ke dalam lakteal (kapilari sistem limfa usus).[30] Lakteal ini mengalir ke dalam saluran toraks yang bermuara ke dalam darah vena di persimpangan urat jugular kiri dan subklavia kiri di sebelah kiri bawah leher. Ini bermakna bahawa produk pencernaan larut lemak dilepaskan terus ke dalam peredaran umum tanpa terlebih dahulu melalui hati, tidak seperti semua produk pencernaan lain. Sebab kelainan ini tidak diketahui.[31]

Kilomikron beredar ke seluruh badan, memberikan plasma darah rupa susu atau berkrim selepas makan berlemak.[perlu rujukan] Lipoprotein lipase pada permukaan endotelium kapilari, terutamanya dalam tisu adipos, di samping tisu-tisu lain pada tahap rendah, dan sebahagiannya mencerna kilomikron menjadi asid lemak bebas, gliserol dan sisa kilomikron. Asid lemak diserap oleh adiposit,[perlu rujukan] tetapi sisa-sisa gliserol dan kilomikron kekal dalam plasma darah, dan akhirnya akan dikeluarkan daripada peredaran oleh hati. Asid lemak bebas yang dikeluarkan oleh pencernaan kilomikron diserap oleh adiposit,[perlu rujukan] di mana ia disintesis semula menjadi trigliserida menggunakan gliserol yang diperoleh daripada glukosa dalam glikolisis.[perlu rujukan] Trigliserida ini disimpan dalam titisan lemak adiposit sehingga ia diperlukan untuk keperluan bahan api tisu lain.
Hati menyerap sebahagian daripada glukosa daripada darah dalam vena portal yang datang dari usus. Selepas hati telah mengisi semula simpanan glikogennya (yang berjumlah hanya kira-kira 100 g glikogen apabila penuh), kebanyakan glukosa yang lain ditukar kepada asid lemak seperti yang diterangkan di bawah. Asid lemak ini digabungkan dengan gliserol untuk membentuk trigliserida yang dibungkus ke dalam titisan yang hampir sama dengan kilomikron, tetapi dikenali sebagai lipoprotein ketumpatan sangat rendah (VLDL). Titisan VLDL ini diproses dengan cara yang sama seperti kilomikron, kecuali saki-baki VLDL dikenali sebagai lipoprotein ketumpatan sederhana (IDL) yang mampu menghilangkan kolesterol daripada darah. Ini menukarkan IDL kepada lipoprotein ketumpatan rendah (LDL) yang diambil oleh sel yang memerlukan kolesterol untuk dimasukkan ke dalam membran selnya atau untuk tujuan sintetik (cth., pembentukan hormon steroid). Baki LDL dikeluarkan oleh hati.[32]
Tisu adipos dan kelenjar susu juga mengambil glukosa daripada darah untuk ditukar kepada trigliserida. Ini berlaku dengan cara yang sama seperti di hati, kecuali tisu ini tidak melepaskan trigliserida yang dihasilkan sebagai VLDL ke dalam darah. Sel tisu adiposa menyimpan trigliserida dalam titisan lemaknya, akhirnya melepaskannya semula sebagai asid lemak bebas dan gliserol ke dalam darah (seperti yang diterangkan di atas) apabila kepekatan plasma insulin rendah, dan paras glukagon dan/atau epinefrina adalah tinggi.[33] Kelenjar susu mengeluarkan lemak (sebagai titisan lemak krim) ke dalam susu yang dihasilkannya di bawah pengaruh prolaktin, sejenis hormon pituitari anterior.
Semua sel dalam badan perlu menghasilkan dan mengekalkan membran dan membran organelnya. Sama ada mereka bergantung sepenuhnya pada asid lemak bebas yang diserap daripada darah atau dapat mensintesis asid lemak mereka sendiri daripada glukosa darah, tidak diketahui. Sel-sel sistem saraf pusat hampir pasti mempunyai keupayaan untuk menghasilkan asid lemak mereka sendiri kerana molekul ini tidak dapat mencapainya melalui penghalang darah-otak.[34] Walau bagaimanapun, tidak diketahui bagaimana ia dicapai oleh asid lemak penting yang tidak dapat dicipta sendiri oleh mamalia, tetapi merupakan komponen penting membran sel (dan fungsi lain yang diterangkan di atas).
Sintesis asid lemak[sunting | sunting sumber]

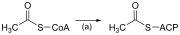
Sama seperti pengoksidaan beta, sintesis asid lemak rantai lurus berlaku melalui enam tindak balas berulang yang ditunjukkan di bawah, sehingga asid palmitik 16 atom karbon dihasilkan.[35][36]
Rajah yang dibentangkan menunjukkan bagaimana asid lemak disintesis dalam mikroorganisma dan menyenaraikan enzim yang terdapat dalam Escherichia coli.[35] Tindak balas ini dilakukan oleh sintase asid lemak II (FASII), yang secara amnya mengandungi pelbagai enzim yang bertindak sebagai satu kompleks. FASII terdapat dalam prokariot, tumbuhan, kulat, dan parasit serta dalam mitokondria.[37]
Dalam haiwan dan juga beberapa kulat seperti yis, tindak balas yang sama ini berlaku pada asid lemak sintase I (FASI), protein dimer besar yang mempunyai semua aktiviti enzim yang diperlukan untuk mencipta asid lemak. FASI kurang cekap daripada FASII; bagaimanapun, ia membolehkan pembentukan lebih banyak molekul, termasuk asid lemak "rantai sederhana" melalui penamatan rantaian awal.[37] Enzim asiltransferase dan transasilase menggabungkan asid lemak dalam fosfolipid, triasilgliserol dsb. dengan memindahkan asid lemak antara penerima asil dan penderma. Mereka juga mempunyai tugas untuk mensintesis lipid bioaktif serta molekul dahulunya.[38]
Sebaik sahaja asid lemak karbon 16:0 telah terbentuk, ia boleh menjalani beberapa pengubahsuaian, mengakibatkan penyahtepuan dan/atau pemanjangan. Pemanjangan, bermula dengan stearat (18:0), dilakukan terutamanya dalam retikulum endoplasma oleh beberapa enzim terikat membran. Langkah-langkah enzimatik yang terlibat dalam proses pemanjangan pada dasarnya adalah sama seperti yang dijalankan oleh sintesis asid lemak, tetapi empat langkah berturut-turut utama pemanjangan dilakukan oleh protein individu, yang mungkin dikaitkan secara fizikal.[39][40]
| Langkah | Enzim | Tindak balas | Penerangan |
|---|---|---|---|
| (a) | Asetil KoA:ACP transasilase | Mengaktifkan asetil-KoA bagi tindak balas dengan malonil-ACP | |
| (b) | Malonil KoA:ACP transasilase | Mengaktifkan malonil-KoA bagi tindak balas dengan asetil-ACP | |
| (c) | 3-ketoasil-ACP sintase | 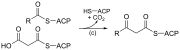 |
Bertindak balas rantai asil terikat ACP dengan malonil-ACP pemanjang rantai |
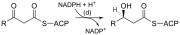
| (d) | 3-ketoasil-ACP reduktase | Mengurangkan karbon 3 keton kepada kumpulan hidroksil | |
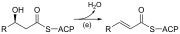
| (e) | 3-Hidroksiasil ACP dehidrase | Menyingkirkan molekul air | |
| (f) | Enoil-ACP reduktase | Menurunkan ikatan ganda dua C2-C3. |
Singkatan: ACP – Protein pembawa asil, KoA – Koenzim A, NADP – Nikotinamida adenina dinukleotida fosfat.
Ambil perhatian bahawa semasa sintesis lemak agen penurun ialah NADPH, manakala NAD ialah agen pengoksidaan dalam pengoksidaan beta (pecahan asid lemak kepada asetil-KoA). Perbezaan ini menunjukkan prinsip umum bahawa NADPH digunakan semasa tindak balas biosintetik, manakala NADH dijana dalam tindak balas menghasilkan tenaga.[34] (Oleh itu NADPH juga diperlukan untuk sintesis kolesterol daripada asetil-KoA; manakala NADH dijana semasa glikolisis). Sumber NADPH adalah dua kali ganda. Apabila malat didekarboksilasi secara oksidatif oleh "enzim malik bersambungan NADP+", piruvat, CO 2 dan NADPH terbentuk. NADPH juga dibentuk oleh laluan pentosa fosfat yang menukar glukosa kepada ribosa yang boleh digunakan dalam sintesis nukleotida dan asid nukleik, atau ia boleh dikatabolismekan kepada piruvat.[34]
Penukaran karbohidrat kepada asid lemak[sunting | sunting sumber]
Pada manusia, asid lemak terbentuk daripada karbohidrat terutamanya dalam hati dan tisu adipos serta dalam kelenjar susu semasa penyusuan. Piruvat yang dihasilkan oleh glikolisis ialah perantara penting dalam penukaran karbohidrat kepada asid lemak dan kolesterol.[34] Ini berlaku melalui penukaran piruvat kepada asetil-KoA dalam mitokondria. Walau bagaimanapun, asetil-KoA ini perlu diangkut ke dalam sitosol, di mana sintesis asid lemak dan kolesterol berlaku. Ini tidak boleh berlaku secara langsung. Untuk mendapatkan asetil-KoA sitosol, sitrat (dihasilkan oleh pemeluwapan asetil-KoA dengan oksaloasetat) dikeluarkan daripada kitaran asid sitrik dan dibawa merentasi membran mitokondria dalam ke dalam sitosol.[34] Di sana, ia dibelah oleh ATP sitrat liase menjadi asetil-KoA dan oksaloasetat. Oksaloasetat dikembalikan kepada mitokondria sebagai malat (dan kemudian ditukar semula menjadi oksaloasetat untuk memindahkan lebih banyak asetil-KoA keluar daripada mitokondria).[41] Asetil-KoA sitosol dikarboksilasi oleh asetil KoA karboksilase menjadi malonil-KoA, langkah pertama yang dilakukan dalam sintesis asid lemak.[41][42]
Kawal atur sintesis asid lemak[sunting | sunting sumber]
Asetil-KoA dibentuk menjadi malonil-KoA oleh asetil-KoA karboksilase, di mana malonil-KoA ditakdirkan untuk menyuap ke dalam laluan sintesis asid lemak. Asetil-KoA karboksilase ialah titik pengawalan dalam sintesis asid lemak rantai lurus tepu, dan tertakluk kepada kedua-dua pemfosforilan dan kawal atur alosterik. Kawal atur pemfosforilan berlaku kebanyakannya pada mamalia, manakala kawal atur alosterik wujud dalam kebanyakan organisma. Kawalan alosterik berlaku sebagai perencatan maklum balas oleh palmitoil-KoA dan pengaktifan oleh sitrat. Apabila terdapat paras palmitoil-KoA yang tinggi, produk akhir sintesis asid lemak tepu, ia menyahaktifkan asetil-KoA karboksilase secara alosterik untuk mengelakkan pengumpulan asid lemak dalam sel. Sitrat bertindak untuk mengaktifkan asetil-KoA karboksilase di bawah paras yang tinggi kerana paras yang tinggi menunjukkan bahawa terdapat cukup asetil-KoA untuk disuap ke dalam kitaran Krebs dan menghasilkan tenaga.[43]
Paras plasma insulin yang tinggi dalam plasma darah (contohnya selepas makan) menyebabkan penyahfosforilasi dan pengaktifan asetil-KoA karboksilase, sekali gus menggalakkan pembentukan malonil-KoA daripada asetil-KoA, dan akibatnya penukaran karbohidrat kepada asid lemak, manakala epinefrina dan glukagon (dilepaskan ke dalam darah semasa kelaparan dan kerahan tenaga) menyebabkan pemfosforilan, menghalang lipogenesis yang memihak kepada pengoksidaan asid lemak melalui pengoksidaan beta.[34][42]
Gangguan[sunting | sunting sumber]
Gangguan metabolisme asid lemak boleh diterangkan dari segi, contohnya, hipertrigliseridemia (paras trigliserida terlalu tinggi), atau jenis hiperlipidemia lain. Ini mungkin berasalan keluarga atau diperoleh.
Jenis gangguan metabolisme asid lemak secara famili biasanya dikelaskan sebagai ralat metabolisme lipid bawaan. Gangguan ini boleh disifatkan sebagai gangguan pengoksidaan asid lemak atau sebagai gangguan penyimpanan lipid, dan merupakan salah satu daripada beberapa kecacatan metabolisme bawaan yang disebabkan oleh kecacatan enzim atau protein pengangkutan yang menjejaskan keupayaan badan untuk mengoksidakan asid lemak untuk menghasilkan tenaga dalam otot, hati dan jenis sel lain. Apabila gangguan pengoksidaan asid lemak menjejaskan otot, ia disifatkan sebagai miopati metabolisme.
Selain itu, sel-sel kanser boleh memaparkan metabolisme asid lemak yang tidak teratur berkenaan kedua-dua sintesis asid lemak[44] dan pengoksidaan asid lemak mitokondria (FAO)[45] yang terlibat dalam pelbagai aspek tumorigenesis dan pertumbuhan sel.
Rujukan[sunting | sunting sumber]
- ^ a b c d e f Stryer, Lubert (1995). "Fatty acid metabolism.". In: Biochemistry (ed. Fourth). New York: W.H. Freeman and Company. m/s. 603–628. ISBN 0-7167-2009-4.
- ^ a b c d Oxidation of fatty acids
- ^ "Lipolysis: pathway under construction". Curr. Opin. Lipidol. 16 (3): 333–40. 2005. doi:10.1097/01.mol.0000169354.20395.1c. PMID 15891395.
- ^ Mobilization and cellular uptake of stored fats (triacylglycerols) (with animation)
- ^ Stahl, Andreas (1 February 2004). "A current review of fatty acid transport proteins (SLC27)". Pflügers Archiv: European Journal of Physiology. 447 (5): 722–727. doi:10.1007/s00424-003-1106-z. PMID 12856180.
- ^ Anderson, Courtney M.; Stahl, Andreas (April 2013). "SLC27 fatty acid transport proteins". Molecular Aspects of Medicine. 34 (2–3): 516–528. doi:10.1016/j.mam.2012.07.010. PMC 3602789. PMID 23506886.
- ^ Ebert, D.; Haller, RG.; Walton, ME. (Jul 2003). "Energy contribution of octanoate to intact rat brain metabolism measured by13C nuclear magnetic resonance spectroscopy". J Neurosci. 23 (13): 5928–35. doi:10.1523/JNEUROSCI.23-13-05928.2003. PMC 6741266. PMID 12843297.
- ^ Marin-Valencia, I.; Good, LB.; Ma, Q.; Malloy, CR.; Pascual, JM. (Feb 2013). "Heptanoate as a neural fuel: energetic and neurotransmitter precursors in normal and glucose transporter I-deficient (G1D) brain". J Cereb Blood Flow Metab. 33 (2): 175–82. doi:10.1038/jcbfm.2012.151. PMC 3564188. PMID 23072752.
- ^ Stryer, Lubert (1995). "Fatty acid metabolism.". In: Biochemistry (ed. Fourth). New York: W.H. Freeman and Company. m/s. 770–771. ISBN 0-7167-2009-4.
- ^ a b c d e f g h i Stryer, Lubert (1995). Biochemistry (ed. Fourth). New York: W.H. Freeman and Company. m/s. 510–515, 581–613, 775–778. ISBN 0-7167-2009-4.
- ^ Activation and transportation of fatty acids to the mitochondria via the carnitine shuttle (with animation)
- ^ Vivo, Darryl C.; Bohan, Timothy P.; Coulter, David L.; Dreifuss, Fritz E.; Greenwood, Robert S.; Nordli, Douglas R.; Shields, W. Donald; Stafstrom, Carl E.; Tein, Ingrid (1998). "l-Carnitine Supplementation in Childhood Epilepsy: Current Perspectives". Epilepsia. 39 (11): 1216–1225. doi:10.1111/j.1528-1157.1998.tb01315.x. ISSN 0013-9580. PMID 9821988.
- ^ Oxidation of odd carbon chain length fatty acids
- ^ Oxidation of unsaturated fatty acids
- ^ "Propionyl-CoA carboxylase - A review". Molecular Genetics and Metabolism. 122 (4): 145–152. December 2017. doi:10.1016/j.ymgme.2017.10.002. PMC 5725275. PMID 29033250.
- ^ "Comparative aspects of propionate metabolism". Comp. Biochem. Physiol. B. 92 (2): 227–31. 1989. doi:10.1016/0305-0491(89)90270-8. PMID 2647392.
- ^ Stryer, Lubert (1995). Biochemistry (ed. Fourth). New York: W.H. Freeman and Company. m/s. 777. ISBN 0-7167-2009-4.
- ^ Sloan, A.W; Koeslag, J.H.; Bredell, G.A.G. (1973). "Body composition work capacity and work efficiency of active and inactive young men". European Journal of Applied Physiology. 32: 17–24. doi:10.1007/bf00422426.
- ^ Ruddick JA (1972). "Toxicology, metabolism, and biochemistry of 1,2-propanediol". Toxicol Appl Pharmacol. 21 (1): 102–111. doi:10.1016/0041-008X(72)90032-4. PMID 4553872.
- ^ a b c Glew, Robert H. Invited review. "You Can Get There From Here: Acetone, Anionic Ketones and Even-Carbon Fatty Acids can Provide Substrates for Gluconeogenesis". Nigerian Journal of Physiological Science. 25 (1): 2–4. Diarkibkan daripada yang asal pada 26 September 2013. Dicapai pada 7 August 2016.
- ^ a b c Park, Sung M.; Klapa, Maria I.; Sinskey, Anthony J.; Stephanopoulos, Gregory (1999). "Metabolite and isotopomer balancing in the analysis of metabolic cycles: II. Applications" (PDF). Biotechnology and Bioengineering. 62 (4): 398. doi:10.1002/(sici)1097-0290(19990220)62:4<392::aid-bit2>3.0.co;2-s. ISSN 0006-3592. PMID 9921151.
- ^ Miller DN, Bazzano G; Bazzano (1965). "Propanediol metabolism and its relation to lactic acid metabolism". Ann NY Acad Sci. 119 (3): 957–973. Bibcode:1965NYASA.119..957M. doi:10.1111/j.1749-6632.1965.tb47455.x. PMID 4285478.
- ^ D. L. Vander Jagt; B. Robinson; K. K. Taylor; L. A. Hunsaker (1992). "Reduction of trioses by NADPH-dependent aldo-keto reductases. Aldose reductase, methylglyoxal, and diabetic complications". The Journal of Biological Chemistry. 267 (7): 4364–4369. doi:10.1016/S0021-9258(18)42844-X. PMID 1537826.
- ^ Stryer, Lubert (1995). "Signal transduction cascades.". In: Biochemistry (ed. Fourth). New York: W.H. Freeman and Company. m/s. 343–350. ISBN 0-7167-2009-4.
- ^ a b Stryer, Lubert (1995). "Eicosanoid hormones are derived from fatty acids.". In: Biochemistry (ed. Fourth). New York: W.H. Freeman and Company. m/s. 624–627. ISBN 0-7167-2009-4.
- ^ Nelson, Randy F. (2005). An introduction to behavioral endocrinology (ed. 3rd). Sunderland, Mass: Sinauer Associates. m/s. 100. ISBN 978-0-87893-617-5.
- ^ a b Digestion of fats (triacylglycerols)
- ^ Hofmann AF (1963). "The function of bile salts in fat absorption. The solvent properties of dilute micellar solutions of conjugated bile salts". Biochem. J. 89 (1): 57–68. doi:10.1042/bj0890057. PMC 1202272. PMID 14097367.
- ^ Stryer, Lubert (1995). "Membrane structures and dynamics.". In: Biochemistry (ed. Fourth). New York: W.H. Freeman and Company. m/s. 268–270. ISBN 0-7167-2009-4.
- ^ Smith, Sareen S. Gropper, Jack L.; Smith, Jack S (2013). Advanced nutrition and human metabolism (ed. 6th). Belmont, CA: Wadsworth/Cengage Learning. ISBN 978-1133104056.
- ^ Williams, Peter L.; Warwick, Roger; Dyson, Mary; Bannister, Lawrence H. (1989). "Angiology.". In: Gray's Anatomy (ed. Thirty-seventh). Edinburgh: Churchill Livingstone. m/s. 841–843. ISBN 0443-041776.
- ^ Stryer, Lubert (1995). "Biosynthesis of membrane lipids and steroids.". In: Biochemistry (ed. Fourth). New York: W.H. Freeman and Company. m/s. 697–700. ISBN 0-7167-2009-4.
- ^ Stralfors, Peter; Honnor, Rupert C. (1989). "Insulin-induced dephosphorylation of hormone-sensitive lipase". European Journal of Biochemistry. 182 (2): 379–385. doi:10.1111/j.1432-1033.1989.tb14842.x. PMID 2661229.
- ^ a b c d e f Stryer, Lubert (1995). Biochemistry (ed. Fourth). New York: W.H. Freeman and Company. m/s. 559–565, 614–623. ISBN 0-7167-2009-4. Ralat petik: Tag
<ref>tidak sah, nama "stryer" digunakan secara berulang dengan kandungan yang berbeza - ^ a b Dijkstra, Albert J., R. J. Hamilton, and Wolf Hamm. "Fatty Acid Biosynthesis." Trans Fatty Acids. Oxford: Blackwell Pub., 2008. 12. Print.
- ^ "MetaCyc pathway: superpathway of fatty acids biosynthesis". MetaCyc Metabolic Pathway Database. BioCyc. (E. coli).
- ^ a b Christie, William W. (20 April 2011). "Fatty Acids: Straight-chain Saturated, Structure, Occurrence and Biosynthesis". Dalam American Oil Chemists' Society (penyunting). AOCS Lipid Library. Diarkibkan daripada yang asal pada 2011-07-21. Dicapai pada 2011-05-02.
- ^ Yamashita, Atsushi; Hayashi, Yasuhiro; Nemoto-Sasaki, Yoko; Ito, Makoto; Oka, Saori; Tanikawa, Takashi; Waku, Keizo; Sugiura, Takayuki (2014-01-01). "Acyltransferases and transacylases that determine the fatty acid composition of glycerolipids and the metabolism of bioactive lipid mediators in mammalian cells and model organisms". Progress in Lipid Research (dalam bahasa Inggeris). 53: 18–81. doi:10.1016/j.plipres.2013.10.001. ISSN 0163-7827. PMID 24125941.
- ^ "MetaCyc pathway: stearate biosynthesis I (animals)". MetaCyc Metabolic Pathway Database. BioCyc.
- ^ "MetaCyc pathway: very long chain fatty acid biosynthesis II". MetaCyc Metabolic Pathway Database. BioCyc.
- ^ a b Ferre, P.; F. Foufelle (2007). "SREBP-1c Transcription Factor and Lipid Homeostasis: Clinical Perspective". Hormone Research. 68 (2): 72–82. doi:10.1159/000100426. PMID 17344645. Dicapai pada 2010-08-30.
this process is outlined graphically in page 73
- ^ a b Voet, Donald; Judith G. Voet; Charlotte W. Pratt (2006). Fundamentals of Biochemistry, 2nd Edition. John Wiley and Sons, Inc. m/s. 547, 556. ISBN 978-0-471-21495-3.
- ^ Diwan, Joyce J. "Fatty Acid Synthesis." Rensselaer Polytechnic Institute (RPI) :: Architecture, Business, Engineering, IT, Humanities, Science. Web. 30 Apr. 2011.<"Fatty Acid Synthesis". Diarkibkan daripada yang asal pada 2011-06-07. Dicapai pada 2011-05-02.>.
- ^ "Clinical importance of FASN in relation to HIF-1α and SREBP-1c in gastric adenocarcinoma". Life Sciences. 224: 169–176. May 2019. doi:10.1016/j.lfs.2019.03.056. PMID 30914315.
- ^ "Downregulation of fatty acid oxidation by involvement of HIF-1α and PPARγ in human gastric adenocarcinoma and its related clinical significance". Journal of Physiology and Biochemistry. 77 (2): 249–260. May 2021. doi:10.1007/s13105-021-00791-3. ISSN 1138-7548. PMID 33730333.